Comprar planes
Comprar tu propia cobertura
Planes a través de tu empleador
Conoce sobre los beneficios médicos, dentales, de farmacia y voluntarios que tu empleador puede ofrecer.
Aprender
¿Vives o trabajas fuera del país?
Enfermedad de Von Hippel-Lindau (PDQ®) información para profesionales de salud [NCI]
Esta información es producida y suministrada por el Instituto Nacional del Cáncer (NCI, por sus siglas en inglés). La información en este tema puede haber cambiado desde que se escribió. Para la información más actual, comuníquese con el Instituto Nacional del Cáncer a través del Internet en la página web http://cancer.gov o llame al 1-800-4-CANCER.
Introducción
La enfermedad de Von Hippel-Lindau (VHL) es una afección de herencia autosómica dominante que predispone a las personas a múltiples neoplasias. Las variantes patogénicas germinales del gen VHL predisponen a las personas a presentar tipos específicos de tumores benignos, tumores malignos y quistes en muchos sistemas orgánicos. Entre estos, hemangioblastomas del sistema nervioso central; hemangioblastomas de retina; carcinomas renales de células claras y quistes renales; feocromocitomas, quistes, cistoadenomas y tumores neuroendocrinos de páncreas; tumores de saco endolinfático; y cistoadenomas de epidídimo (varones) y de ligamento ancho del útero (mujeres).[
Referencias:
- Choyke PL, Glenn GM, Walther MM, et al.: von Hippel-Lindau disease: genetic, clinical, and imaging features. Radiology 194 (3): 629-42, 1995.
- Lonser RR, Glenn GM, Walther M, et al.: von Hippel-Lindau disease. Lancet 361 (9374): 2059-67, 2003.
- Pithukpakorn M, Glenn G: von Hippel-Lindau syndrome. Community Oncology 1 (4): 232-43, 2004.
- Glenn GM, Daniel LN, Choyke P, et al.: Von Hippel-Lindau (VHL) disease: distinct phenotypes suggest more than one mutant allele at the VHL locus. Hum Genet 87 (2): 207-10, 1991.
- Wolters WPG, Dreijerink KMA, Giles RH, et al.: Multidisciplinary integrated care pathway for von Hippel-Lindau disease. Cancer 128 (15): 2871-2879, 2022.
Características genéticas
GenVHL
El gen VHL es un gen supresor de tumores ubicado en en la citobanda 3p25-26 del brazo corto del cromosoma 3.[
Prevalencia y efectos fundadores infrecuentes
La incidencia estimada de la enfermedad de VHL oscila entre 1 por 27 000 y 1 por 43 000 nacidos vivos en la población general.[
Penetrancia de variantes patogénicas
Las variantes patogénicas del gen VHL son muy penetrantes, se observan manifestaciones en más del 90 % de los portadores a la edad de 65 años.[
Factores de riesgo de la enfermedad de Von Hippel-Lindau
Cada uno de los descendientes (de ambos sexos) de una persona con enfermedad de VHL tiene una probabilidad del 50 % de heredar el alelo con la variante patogénica de VHL del progenitor afectado. Para obtener más información, consultar la sección
Correlaciones entre genotipo y fenotipo
Las alteraciones específicas en el gen VHL a veces ayudan a predecir el riesgo individual de carcinoma de células renales (RCC) y otros tumores asociados a VHL. La clasificación de los pacientes en grupos de riesgo a partir de los genotipos ha sido un objetivo útil para informar la detección de las manifestaciones de la enfermedad de VHL. Se han hecho intentos para subdividir a los pacientes de acuerdo a las variantes familiares. Por ejemplo, en 1991, los investigadores clasificaron los casos de VHL en 2 tipos diferentes: VHL de tipo 1 (VHL sin feocromocitomas) y VHL de tipo 2 (VHL con feocromocitomas).[
En los últimos años, ha habido excepciones a estas clasificaciones de la enfermedad de VHL, lo que indica que se justifica la detección en todas las personas con VHL.[
Variantes patogénicas de novo y mosaicismo
En algunos casos, una persona recibe un diagnóstico de enfermedad de VHL, incluso cuando no tiene familiares con esta enfermedad. Esta circunstancia se da cuando una persona afectada tiene una variante patogénica de novo (nueva) en el gen VHL. Los pacientes con diagnóstico de enfermedad de VHL, pero sin historia familiar de esta enfermedad, representan cerca del 23 % de los grupos familiares con enfermedad de VHL.[
Dependiendo del estadio de la embriogénesis en la que surge la variante nueva, es posible que aparezcan diferentes linajes de células somáticas portadoras de la variante. Esto influye en el grado de mosaicismo que se observa en los linajes celulares. El mosaicismo se produce cuando dos o más líneas celulares en una persona difieren en su genotipo. Estas líneas celulares diferentes provienen del mismo cigoto.[
Trastornos alélicos
La policitemia asociada al gen VHL (también conocida como eritrocitosis familiar de tipo 2 o policitemia de Chuvash) es un trastorno sanguíneo autosómico recesivo raro causado por variantes patogénicas homocigóticas o heterocigóticas compuestas del gen VHL en el que las personas afectadas presentan un número anormalmente alto de eritrocitos (policitemia). Las personas con esta afección tienen variantes patogénicas bialélicas del gen VHL. En un principio, se creía que los tumores sindrómicos típicos de la enfermedad de VHL no se presentaban en estas personas afectadas.[
Otras alteraciones genéticas
En el RCC esporádico, la inactivación del gen VHL debida a mutación es el acontecimiento molecular más frecuente. Además de la inactivación de VHL, los tumores del carcinoma renal de células claras (ccRCC) esporádico a menudo albergan variantes de otros genes, como PBRM1, SETD2 y BAP1.[
Referencias:
- Latif F, Tory K, Gnarra J, et al.: Identification of the von Hippel-Lindau disease tumor suppressor gene. Science 260 (5112): 1317-20, 1993.
- Knudson AG, Strong LC: Mutation and cancer: neuroblastoma and pheochromocytoma. Am J Hum Genet 24 (5): 514-32, 1972.
- Knudson AG: Genetics of human cancer. Annu Rev Genet 20: 231-51, 1986.
- Maher ER, Iselius L, Yates JR, et al.: Von Hippel-Lindau disease: a genetic study. J Med Genet 28 (7): 443-7, 1991.
- Binderup ML, Galanakis M, Budtz-Jørgensen E, et al.: Prevalence, birth incidence, and penetrance of von Hippel-Lindau disease (vHL) in Denmark. Eur J Hum Genet 25 (3): 301-307, 2017.
- Evans DG, Howard E, Giblin C, et al.: Birth incidence and prevalence of tumor-prone syndromes: estimates from a UK family genetic register service. Am J Med Genet A 152A (2): 327-32, 2010.
- Neumann HP, Wiestler OD: Clustering of features of von Hippel-Lindau syndrome: evidence for a complex genetic locus. Lancet 337 (8749): 1052-4, 1991.
- Poulsen ML, Budtz-Jørgensen E, Bisgaard ML: Surveillance in von Hippel-Lindau disease (vHL). Clin Genet 77 (1): 49-59, 2010.
- Reich M, Jaegle S, Neumann-Haefelin E, et al.: Genotype-phenotype correlation in von Hippel-Lindau disease. Acta Ophthalmol 99 (8): e1492-e1500, 2021.
- Salama Y, Albanyan S, Szybowska M, et al.: Comprehensive characterization of a Canadian cohort of von Hippel-Lindau disease patients. Clin Genet 96 (5): 461-467, 2019.
- Brauch H, Kishida T, Glavac D, et al.: Von Hippel-Lindau (VHL) disease with pheochromocytoma in the Black Forest region of Germany: evidence for a founder effect. Hum Genet 95 (5): 551-6, 1995.
- Hoffman MA, Ohh M, Yang H, et al.: von Hippel-Lindau protein mutants linked to type 2C VHL disease preserve the ability to downregulate HIF. Hum Mol Genet 10 (10): 1019-27, 2001.
- Sgambati MT, Stolle C, Choyke PL, et al.: Mosaicism in von Hippel-Lindau disease: lessons from kindreds with germline mutations identified in offspring with mosaic parents. Am J Hum Genet 66 (1): 84-91, 2000.
- Austin KD, Hall JG: Nontraditional inheritance. Pediatr Clin North Am 39 (2): 335-48, 1992.
- Ang SO, Chen H, Hirota K, et al.: Disruption of oxygen homeostasis underlies congenital Chuvash polycythemia. Nat Genet 32 (4): 614-21, 2002.
- Pastore YD, Jelinek J, Ang S, et al.: Mutations in the VHL gene in sporadic apparently congenital polycythemia. Blood 101 (4): 1591-5, 2003.
- Cario H, Schwarz K, Jorch N, et al.: Mutations in the von Hippel-Lindau (VHL) tumor suppressor gene and VHL-haplotype analysis in patients with presumable congenital erythrocytosis. Haematologica 90 (1): 19-24, 2005.
- Popova T, Hebert L, Jacquemin V, et al.: Germline BAP1 mutations predispose to renal cell carcinomas. Am J Hum Genet 92 (6): 974-80, 2013.
- Farley MN, Schmidt LS, Mester JL, et al.: A novel germline mutation in BAP1 predisposes to familial clear-cell renal cell carcinoma. Mol Cancer Res 11 (9): 1061-71, 2013.
- Cancer Genome Atlas Research Network: Comprehensive molecular characterization of clear cell renal cell carcinoma. Nature 499 (7456): 43-9, 2013.
- Benusiglio PR, Couvé S, Gilbert-Dussardier B, et al.: A germline mutation in PBRM1 predisposes to renal cell carcinoma. J Med Genet 52 (6): 426-30, 2015.
Aspectos de la biología molecular
El gen supresor de tumores VHL codifica 2 proteínas: una proteína de 213 aminoácidos (pVHL30) y una proteína de 154 aminoácidos; esta última se produce a partir de traducción interna.[
Factores inducibles por hipoxia 1-α y 2-α
La pVHL regula las concentraciones celulares de las proteínas HIF1-α y HIF2-α actuando como un sitio de reconocimiento del sustrato HIF, una parte del complejo de la ubiquitina–ligasa E3.[
La hipoxia inactiva las prolil–hidroxilasas, lo que conduce a la falta de hidroxilación de HIF. Las HIF1-α y HIF2-α no hidroxiladas no se unen al complejo proteico VHL para la ubiquitinación y, por lo tanto, se acumulan. Las concentraciones constitutivamente altas resultantes de HIF1-α y HIF2-α aumentan la transcripción de una variedad de genes, entre ellos genes de factores de crecimiento y angiogénicos, enzimas del metabolismo intermediario y genes que promueven fenotipos celulares con características de pluripotencialidad (stemness).[
Los HIF1-α y HIF2-α exhiben características funcionales diferentes que contrastan de manera parcial. En el contexto del carcinoma de células renales (RCC), se observa que el gen EPAS1, también conocido como HIF2A, actúa como oncogén, mientras que el gen HIF1A actúa como gen supresor de tumores. Al parecer HIF2-α aumenta de manera preferencial la actividad de Myc, mientras que HIF1-α inhibe la actividad de Myc.[
En varios estudios con modelos de animales transgénicos o con xenoinjertos se observó que la inactivación de HIF2-α por parte de pVHL es necesaria y suficiente para la actividad de supresión de tumores de las proteínas pVHL. En la actualidad, HIF2-α se ha consolidado como una diana terapéutica para las neoplasias malignas asociadas a la enfermedad de Von Hippel-Lindau (VHL).[
Regulación de microtúbulos y control de cilios del centrosoma
Los datos emergentes apuntan a la importancia del control mediado por pVHL del cilio primario y el ciclo ciliar del centrosoma. El cilio primario inmóvil actúa como un mecanosensor, regula la señalización celular y controla el comienzo de la mitosis celular.[
Control del ciclo celular
En líneas celulares con inactivación de VHL, se observó que después de la privación de pVHL la reintroducción de pVHL detiene el ciclo celular y aumenta la expresión de p27.[
Control de la matriz extracelular
Se necesita pVHL funcional para el ensamblaje adecuado de la matriz de fibronectina extracelular.[
Regulación de la autofagia oncogénica
En el carcinoma renal de células claras (ccRCC), la actividad del receptor de potencial transitorio de melastatina 3 (TRPM3) estimula, mediante múltiples mecanismos complementarios, la autofagia oncogénica dependiente de las proteínas 1 asociadas a microtúbulos, de cadena ligera, 3 α y β (LC3A y LC3B). La supresión tumoral de VHL se presenta por inhibición de esta autofagia oncogénica de manera coordinada a través de la actividad de miR-204, que se expresa a partir del intrón 6 del gen codificador de TRPM3. La TRPM3 representa una diana aprovechable para el tratamiento del ccRCC.[
Modelos animales de la enfermedad de Von Hippel-Lindau
Los ratones con inactivación de Vhl mueren dentro del útero. Los ratones heterocigóticos para Vhl presentan lesiones vasculares en el hígado similares a hemangioblastomas.[
Referencias:
- Iliopoulos O, Ohh M, Kaelin WG: pVHL19 is a biologically active product of the von Hippel-Lindau gene arising from internal translation initiation. Proc Natl Acad Sci U S A 95 (20): 11661-6, 1998.
- Pause A, Lee S, Lonergan KM, et al.: The von Hippel-Lindau tumor suppressor gene is required for cell cycle exit upon serum withdrawal. Proc Natl Acad Sci U S A 95 (3): 993-8, 1998.
- Kurban G, Hudon V, Duplan E, et al.: Characterization of a von Hippel Lindau pathway involved in extracellular matrix remodeling, cell invasion, and angiogenesis. Cancer Res 66 (3): 1313-9, 2006.
- Thoma CR, Toso A, Gutbrodt KL, et al.: VHL loss causes spindle misorientation and chromosome instability. Nat Cell Biol 11 (8): 994-1001, 2009.
- Maxwell PH, Wiesener MS, Chang GW, et al.: The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature 399 (6733): 271-5, 1999.
- Ivan M, Kondo K, Yang H, et al.: HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing. Science 292 (5516): 464-8, 2001.
- Jaakkola P, Mole DR, Tian YM, et al.: Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science 292 (5516): 468-72, 2001.
- Keith B, Johnson RS, Simon MC: HIF1α and HIF2α: sibling rivalry in hypoxic tumour growth and progression. Nat Rev Cancer 12 (1): 9-22, 2012.
- Gordan JD, Bertout JA, Hu CJ, et al.: HIF-2alpha promotes hypoxic cell proliferation by enhancing c-myc transcriptional activity. Cancer Cell 11 (4): 335-47, 2007.
- Koh MY, Lemos R, Liu X, et al.: The hypoxia-associated factor switches cells from HIF-1α- to HIF-2α-dependent signaling promoting stem cell characteristics, aggressive tumor growth and invasion. Cancer Res 71 (11): 4015-27, 2011.
- Koh MY, Darnay BG, Powis G: Hypoxia-associated factor, a novel E3-ubiquitin ligase, binds and ubiquitinates hypoxia-inducible factor 1alpha, leading to its oxygen-independent degradation. Mol Cell Biol 28 (23): 7081-95, 2008.
- Monzon FA, Alvarez K, Peterson L, et al.: Chromosome 14q loss defines a molecular subtype of clear-cell renal cell carcinoma associated with poor prognosis. Mod Pathol 24 (11): 1470-9, 2011.
- Kondo K, Klco J, Nakamura E, et al.: Inhibition of HIF is necessary for tumor suppression by the von Hippel-Lindau protein. Cancer Cell 1 (3): 237-46, 2002.
- Kondo K, Kim WY, Lechpammer M, et al.: Inhibition of HIF2alpha is sufficient to suppress pVHL-defective tumor growth. PLoS Biol 1 (3): E83, 2003.
- Zimmer M, Doucette D, Siddiqui N, et al.: Inhibition of hypoxia-inducible factor is sufficient for growth suppression of VHL-/- tumors. Mol Cancer Res 2 (2): 89-95, 2004.
- Zimmer M, Ebert BL, Neil C, et al.: Small-molecule inhibitors of HIF-2a translation link its 5'UTR iron-responsive element to oxygen sensing. Mol Cell 32 (6): 838-48, 2008.
- Metelo AM, Noonan HR, Li X, et al.: Pharmacological HIF2α inhibition improves VHL disease-associated phenotypes in zebrafish model. J Clin Invest 125 (5): 1987-97, 2015.
- Scheuermann TH, Li Q, Ma HW, et al.: Allosteric inhibition of hypoxia inducible factor-2 with small molecules. Nat Chem Biol 9 (4): 271-6, 2013.
- Pan J, Snell W: The primary cilium: keeper of the key to cell division. Cell 129 (7): 1255-7, 2007.
- Simons M, Walz G: Polycystic kidney disease: cell division without a c(l)ue? Kidney Int 70 (5): 854-64, 2006.
- Thoma CR, Frew IJ, Hoerner CR, et al.: pVHL and GSK3beta are components of a primary cilium-maintenance signalling network. Nat Cell Biol 9 (5): 588-95, 2007.
- Hergovich A, Lisztwan J, Barry R, et al.: Regulation of microtubule stability by the von Hippel-Lindau tumour suppressor protein pVHL. Nat Cell Biol 5 (1): 64-70, 2003.
- Hergovich A, Lisztwan J, Thoma CR, et al.: Priming-dependent phosphorylation and regulation of the tumor suppressor pVHL by glycogen synthase kinase 3. Mol Cell Biol 26 (15): 5784-96, 2006.
- Roe JS, Kim HR, Hwang IY, et al.: von Hippel-Lindau protein promotes Skp2 destabilization on DNA damage. Oncogene 30 (28): 3127-38, 2011.
- Kim J, Jonasch E, Alexander A, et al.: Cytoplasmic sequestration of p27 via AKT phosphorylation in renal cell carcinoma. Clin Cancer Res 15 (1): 81-90, 2009.
- Roe JS, Youn HD: The positive regulation of p53 by the tumor suppressor VHL. Cell Cycle 5 (18): 2054-6, 2006.
- Roe JS, Kim H, Lee SM, et al.: p53 stabilization and transactivation by a von Hippel-Lindau protein. Mol Cell 22 (3): 395-405, 2006.
- Ohh M, Yauch RL, Lonergan KM, et al.: The von Hippel-Lindau tumor suppressor protein is required for proper assembly of an extracellular fibronectin matrix. Mol Cell 1 (7): 959-68, 1998.
- Lolkema MP, Gervais ML, Snijckers CM, et al.: Tumor suppression by the von Hippel-Lindau protein requires phosphorylation of the acidic domain. J Biol Chem 280 (23): 22205-11, 2005.
- Hall DP, Cost NG, Hegde S, et al.: TRPM3 and miR-204 establish a regulatory circuit that controls oncogenic autophagy in clear cell renal cell carcinoma. Cancer Cell 26 (5): 738-53, 2014.
- Mikhaylova O, Stratton Y, Hall D, et al.: VHL-regulated MiR-204 suppresses tumor growth through inhibition of LC3B-mediated autophagy in renal clear cell carcinoma. Cancer Cell 21 (4): 532-46, 2012.
- Haase VH, Glickman JN, Socolovsky M, et al.: Vascular tumors in livers with targeted inactivation of the von Hippel-Lindau tumor suppressor. Proc Natl Acad Sci U S A 98 (4): 1583-8, 2001.
- Frew IJ, Thoma CR, Georgiev S, et al.: pVHL and PTEN tumour suppressor proteins cooperatively suppress kidney cyst formation. EMBO J 27 (12): 1747-57, 2008.
- Hickey MM, Lam JC, Bezman NA, et al.: von Hippel-Lindau mutation in mice recapitulates Chuvash polycythemia via hypoxia-inducible factor-2alpha signaling and splenic erythropoiesis. J Clin Invest 117 (12): 3879-89, 2007.
- Varela I, Tarpey P, Raine K, et al.: Exome sequencing identifies frequent mutation of the SWI/SNF complex gene PBRM1 in renal carcinoma. Nature 469 (7331): 539-42, 2011.
- Dalgliesh GL, Furge K, Greenman C, et al.: Systematic sequencing of renal carcinoma reveals inactivation of histone modifying genes. Nature 463 (7279): 360-3, 2010.
- Peña-Llopis S, Vega-Rubín-de-Celis S, Liao A, et al.: BAP1 loss defines a new class of renal cell carcinoma. Nat Genet 44 (7): 751-9, 2012.
Manifestaciones clínicas
Intervalos de edad y riesgo acumulado de diferentes neoplasias asociadas a la enfermedad
La edad de inicio de la enfermedad de Von Hippel-Lindau (VHL) varía entre familias y miembros de la misma familia. En este hecho se basan las directrices sobre la edad de inicio y la frecuencia de los exámenes de vigilancia presintomática. De todas las manifestaciones de la enfermedad de VHL, los hemangioblastomas de retina y los feocromocitomas son los que se presentan a una edad más temprana; por lo tanto, se recomienda la detección en niños menores de 10 años. Por lo menos en un estudio se demostró que la incidencia de las lesiones nuevas varía según la edad del paciente, la variante patogénica subyacente y el órgano afectado.[
| Neoplasia | Media de edad (intervalo) en años | Riesgo acumulado (%) |
|---|---|---|
| PHEO = feocromocitoma | ||
| a Adaptado de Choyke et al[ |
||
| b Se dispone de datos limitados sobre los cistoadenomas de ligamento ancho, ligamento redondo y epidídimo. | ||
| Carcinoma de células renales | 37 (16–67) | 24–45 |
| Feocromocitoma | 30 (5–58) | 10–20 |
| Tumor o quiste de páncreas | 36 (5–70) | 35–70 |
| Hemangioblastoma de retina | 25 (1–67) | 25–60 |
| Hemangioblastoma de cerebelo | 33 (9–78) | 44–72 |
| Hemangioblastoma de tronco encefálico | 32 (12–46) | 10–25 |
| Hemangioblastoma de médula espinal | 33 (12–66) | 13–50 |
| Tumor de saco endolinfático | 22 (12–50) | 10 |
Para obtener más información, consultar la sección
Referencias:
- Binderup ML, Budtz-Jørgensen E, Bisgaard ML: Risk of new tumors in von Hippel-Lindau patients depends on age and genotype. Genet Med 18 (1): 89-97, 2016.
- Choyke PL, Glenn GM, Walther MM, et al.: von Hippel-Lindau disease: genetic, clinical, and imaging features. Radiology 194 (3): 629-42, 1995.
- Lonser RR, Glenn GM, Walther M, et al.: von Hippel-Lindau disease. Lancet 361 (9374): 2059-67, 2003.
Manifestaciones tisulares
Manifestaciones renales
Más del 55 % de las personas con la enfermedad de Von Hippel-Lindau (VHL) solo presentan múltiples quistes de células renales. Los carcinomas de células renales (RCC) relacionados con la enfermedad de VHL suelen ser multifocales y bilaterales, y forman masas con componentes quísticos y sólidos.[
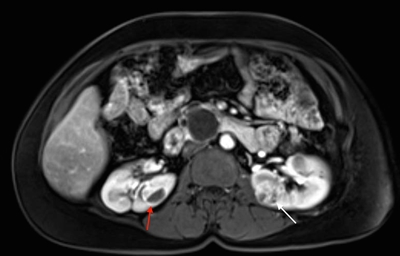
Es posible que los tumores de más de 3 cm aumenten de grado a medida que crecen y que produzcan metástasis.[
Hemangioblastomas de retina
Las manifestaciones retinianas, que se notificaron por primera vez hace más de un siglo, fueron una de las primeras características reconocidas de la enfermedad de VHL. Los hemangioblastomas de retina (que también se llaman angiomas capilares retinianos) son una de las manifestaciones más comunes de la enfermedad de VHL y se presentan en más del 50 % de los pacientes.[
Los hemangioblastomas retinianos surgen más a menudo en la periferia de la retina. También se pueden presentar en otros lugares como el nervio óptico, un área más difícil de tratar. Estos hemangioblastomas son tumores esféricos de color naranja brillante que tienen un suministro vascular tortuoso. Casi el 50 % de los pacientes tienen hemangioblastomas de retina bilaterales.[
Los estudios longitudinales ayudan a explicar la historia natural de estos tumores. Si no se tratan, los hemangioblastomas de retina a veces son una fuente importante de morbilidad en los pacientes con enfermedad de VHL. Cerca del 8 % de los pacientes [
Hemangioblastomas de cerebelo y médula espinal
Los hemangioblastomas son la manifestación más común en los pacientes con enfermedad de VHL y afectan a más del 70 % de las personas. En un estudio prospectivo se evaluó la evolución natural del los hemangioblastomas.[
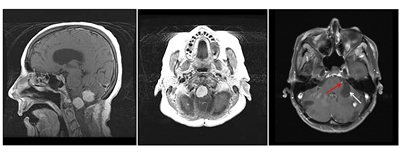
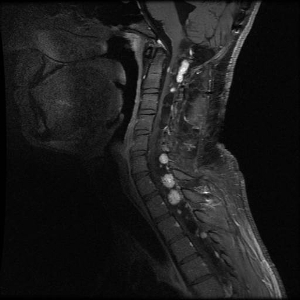
Feocromocitomas y paragangliomas
La tasa de formación de feocromocitomas en la población de pacientes con enfermedad de VHL es del 25 % al 30 %.[
Los paragangliomas son raros en los pacientes con enfermedad de VHL, pero a veces se presentan en la cabeza, el cuello o el abdomen.[
La media de edad en el momento del diagnóstico de los feocromocitomas y paragangliomas relacionados con la enfermedad de VHL es de alrededor de 30 años.[
Manifestaciones pancreáticas
Los pacientes con enfermedad de VHL a veces presentan múltiples cistoadenomas serosos, tumores neuroendocrinos de páncreas y quistes pancreáticos simples.[
Los quistes y los cistoadenomas de páncreas no son malignos, pero los tumores neuroendocrinos de páncreas exhiben características de malignidad.[
Tumores de saco endolinfático
Los tumores de saco endolinfático son tumores adenomatosos del conducto endolinfático o del saco endolinfático en la parte posterior del peñasco.[
Los tumores de saco endolinfático son una causa importante de morbilidad en pacientes con enfermedad de VHL. Los tumores de saco endolinfático evidentes en las imágenes producen muchos síntomas, entre ellos, hipoacusia (95 % de los pacientes); acúfenos (92 %); síntomas vestibulares, como vértigo y desequilibrio (62 %); plenitud auditiva (29 %) y paresia facial (8 %).[
La hipoacusia vinculada a los tumores de saco endolinfático suele ser irreversible. Las imágenes seriadas para la detección temprana de los tumores de saco endolinfático en pacientes asintomáticos y la resección de lesiones evidentes en las imágenes radiológicas son componentes importantes de la atención de pacientes con enfermedad de VHL.[
Cistoadenomas papilares de ligamento ancho o de ligamento redondo del útero
A veces aparecen tumores en el ligamento ancho del útero en mujeres con enfermedad de VHL, estos se conocen como cistoadenomas papilares. Estos tumores son muy raros, se han notificado menos de 20 casos en la bibliografía.[
Cistoadenomas de epidídimo
Los quistes de epidídimo llenos de líquido, o espermatoceles, son muy comunes en los hombres adultos. En los pacientes con enfermedad de VHL, a veces se forman neoplasias quísticas más complejas en el epidídimo conocidas como cistoadenomas papilares, que son raros en la población general. Mas de un tercio de todos los casos de cistoadenomas de epidídimo notificados en la bibliografía médica, y la mayoría de lo casos de cistoadenomas bilaterales corresponden a pacientes con enfermedad de VHL.[
En una serie pequeña, el análisis histológico no reveló características que suelen asociarse con una neoplasia maligna, como figuras mitóticas, pleomorfismo nuclear y necrosis. Las lesiones exhibieron una positividad fuerte para CK7 y negatividad para RCC. Todos los tumores fueron positivos para la anhidrasa carbónica IX (CAIX). En la mayoría de los casos fueron positivos para PAX8. Estas características evocan el RCC papilar de células claras, una forma relativamente benigna de RCC sin potencial metastásico conocido.[
Referencias:
- Choyke PL, Glenn GM, Walther MM, et al.: The natural history of renal lesions in von Hippel-Lindau disease: a serial CT study in 28 patients. AJR Am J Roentgenol 159 (6): 1229-34, 1992.
- Poston CD, Jaffe GS, Lubensky IA, et al.: Characterization of the renal pathology of a familial form of renal cell carcinoma associated with von Hippel-Lindau disease: clinical and molecular genetic implications. J Urol 153 (1): 22-6, 1995.
- Walther MM, Choyke PL, Glenn G, et al.: Renal cancer in families with hereditary renal cancer: prospective analysis of a tumor size threshold for renal parenchymal sparing surgery. J Urol 161 (5): 1475-9, 1999.
- Walther MM, Lubensky IA, Venzon D, et al.: Prevalence of microscopic lesions in grossly normal renal parenchyma from patients with von Hippel-Lindau disease, sporadic renal cell carcinoma and no renal disease: clinical implications. J Urol 154 (6): 2010-4; discussion 2014-5, 1995.
- Chew EY: Ocular manifestations of von Hippel-Lindau disease: clinical and genetic investigations. Trans Am Ophthalmol Soc 103: 495-511, 2005.
- Choyke PL, Glenn GM, Walther MM, et al.: von Hippel-Lindau disease: genetic, clinical, and imaging features. Radiology 194 (3): 629-42, 1995.
- Lonser RR, Glenn GM, Walther M, et al.: von Hippel-Lindau disease. Lancet 361 (9374): 2059-67, 2003.
- Dollfus H, Massin P, Taupin P, et al.: Retinal hemangioblastoma in von Hippel-Lindau disease: a clinical and molecular study. Invest Ophthalmol Vis Sci 43 (9): 3067-74, 2002.
- Wong WT, Agrón E, Coleman HR, et al.: Clinical characterization of retinal capillary hemangioblastomas in a large population of patients with von Hippel-Lindau disease. Ophthalmology 115 (1): 181-8, 2008.
- Binderup MLM, Stendell AS, Galanakis M, et al.: Retinal hemangioblastoma: prevalence, incidence and frequency of underlying von Hippel-Lindau disease. Br J Ophthalmol 102 (7): 942-947, 2018.
- Kreusel KM, Bechrakis NE, Krause L, et al.: Retinal angiomatosis in von Hippel-Lindau disease: a longitudinal ophthalmologic study. Ophthalmology 113 (8): 1418-24, 2006.
- Schmidt D, Neumann HP: Retinal vascular hamartoma in von Hippel-Lindau disease. Arch Ophthalmol 113 (9): 1163-7, 1995.
- Wittström E, Nordling M, Andréasson S: Genotype-phenotype correlations, and retinal function and structure in von Hippel-Lindau disease. Ophthalmic Genet 35 (2): 91-106, 2014.
- Reich M, Jaegle S, Neumann-Haefelin E, et al.: Genotype-phenotype correlation in von Hippel-Lindau disease. Acta Ophthalmol 99 (8): e1492-e1500, 2021.
- Toy BC, Agrón E, Nigam D, et al.: Longitudinal analysis of retinal hemangioblastomatosis and visual function in ocular von Hippel-Lindau disease. Ophthalmology 119 (12): 2622-30, 2012.
- Huntoon K, Wu T, Elder JB, et al.: Biological and clinical impact of hemangioblastoma-associated peritumoral cysts in von Hippel-Lindau disease. J Neurosurg 124 (4): 971-6, 2016.
- Kanno H, Kuratsu J, Nishikawa R, et al.: Clinical features of patients bearing central nervous system hemangioblastoma in von Hippel-Lindau disease. Acta Neurochir (Wien) 155 (1): 1-7, 2013.
- Lonser RR, Butman JA, Huntoon K, et al.: Prospective natural history study of central nervous system hemangioblastomas in von Hippel-Lindau disease. J Neurosurg 120 (5): 1055-62, 2014.
- Walther MM, Reiter R, Keiser HR, et al.: Clinical and genetic characterization of pheochromocytoma in von Hippel-Lindau families: comparison with sporadic pheochromocytoma gives insight into natural history of pheochromocytoma. J Urol 162 (3 Pt 1): 659-64, 1999.
- Aufforth RD, Ramakant P, Sadowski SM, et al.: Pheochromocytoma Screening Initiation and Frequency in von Hippel-Lindau Syndrome. J Clin Endocrinol Metab 100 (12): 4498-504, 2015.
- Welander J, Söderkvist P, Gimm O: Genetics and clinical characteristics of hereditary pheochromocytomas and paragangliomas. Endocr Relat Cancer 18 (6): R253-76, 2011.
- Eisenhofer G, Walther MM, Huynh TT, et al.: Pheochromocytomas in von Hippel-Lindau syndrome and multiple endocrine neoplasia type 2 display distinct biochemical and clinical phenotypes. J Clin Endocrinol Metab 86 (5): 1999-2008, 2001.
- Zbar B, Kishida T, Chen F, et al.: Germline mutations in the Von Hippel-Lindau disease (VHL) gene in families from North America, Europe, and Japan. Hum Mutat 8 (4): 348-57, 1996.
- Chen F, Slife L, Kishida T, et al.: Genotype-phenotype correlation in von Hippel-Lindau disease: identification of a mutation associated with VHL type 2A. J Med Genet 33 (8): 716-7, 1996.
- Friedrich CA: Genotype-phenotype correlation in von Hippel-Lindau syndrome. Hum Mol Genet 10 (7): 763-7, 2001.
- Eisenhofer G, Vocke CD, Elkahloun A, et al.: Genetic screening for von Hippel-Lindau gene mutations in non-syndromic pheochromocytoma: low prevalence and false-positives or misdiagnosis indicate a need for caution. Horm Metab Res 44 (5): 343-8, 2012.
- Shuch B, Ricketts CJ, Metwalli AR, et al.: The genetic basis of pheochromocytoma and paraganglioma: implications for management. Urology 83 (6): 1225-32, 2014.
- Eisenhofer G, Timmers HJ, Lenders JW, et al.: Age at diagnosis of pheochromocytoma differs according to catecholamine phenotype and tumor location. J Clin Endocrinol Metab 96 (2): 375-84, 2011.
- Charlesworth M, Verbeke CS, Falk GA, et al.: Pancreatic lesions in von Hippel-Lindau disease? A systematic review and meta-synthesis of the literature. J Gastrointest Surg 16 (7): 1422-8, 2012.
- Libutti SK, Choyke PL, Bartlett DL, et al.: Pancreatic neuroendocrine tumors associated with von Hippel Lindau disease: diagnostic and management recommendations. Surgery 124 (6): 1153-9, 1998.
- Blansfield JA, Choyke L, Morita SY, et al.: Clinical, genetic and radiographic analysis of 108 patients with von Hippel-Lindau disease (VHL) manifested by pancreatic neuroendocrine neoplasms (PNETs). Surgery 142 (6): 814-8; discussion 818.e1-2, 2007.
- Manski TJ, Heffner DK, Glenn GM, et al.: Endolymphatic sac tumors. A source of morbid hearing loss in von Hippel-Lindau disease. JAMA 277 (18): 1461-6, 1997.
- Choo D, Shotland L, Mastroianni M, et al.: Endolymphatic sac tumors in von Hippel-Lindau disease. J Neurosurg 100 (3): 480-7, 2004.
- Megerian CA, Haynes DS, Poe DS, et al.: Hearing preservation surgery for small endolymphatic sac tumors in patients with von Hippel-Lindau syndrome. Otol Neurotol 23 (3): 378-87, 2002.
- Kim HJ, Butman JA, Brewer C, et al.: Tumors of the endolymphatic sac in patients with von Hippel-Lindau disease: implications for their natural history, diagnosis, and treatment. J Neurosurg 102 (3): 503-12, 2005.
- Lonser RR, Kim HJ, Butman JA, et al.: Tumors of the endolymphatic sac in von Hippel-Lindau disease. N Engl J Med 350 (24): 2481-6, 2004.
- Nogales FF, Goyenaga P, Preda O, et al.: An analysis of five clear cell papillary cystadenomas of mesosalpinx and broad ligament: four associated with von Hippel-Lindau disease and one aggressive sporadic type. Histopathology 60 (5): 748-57, 2012.
- Cox R, Vang R, Epstein JI: Papillary cystadenoma of the epididymis and broad ligament: morphologic and immunohistochemical overlap with clear cell papillary renal cell carcinoma. Am J Surg Pathol 38 (5): 713-8, 2014.
- Brady A, Nayar A, Cross P, et al.: A detailed immunohistochemical analysis of 2 cases of papillary cystadenoma of the broad ligament: an extremely rare neoplasm characteristic of patients with von hippel-lindau disease. Int J Gynecol Pathol 31 (2): 133-40, 2012.
- Odrzywolski KJ, Mukhopadhyay S: Papillary cystadenoma of the epididymis. Arch Pathol Lab Med 134 (4): 630-3, 2010.
- Uppuluri S, Bhatt S, Tang P, et al.: Clear cell papillary cystadenoma with sonographic and histopathologic correlation. J Ultrasound Med 25 (11): 1451-3, 2006.
- Vijayvargiya M, Jain D, Mathur SR, et al.: Papillary cystadenoma of the epididymis associated with von Hippel-Lindau disease diagnosed on fine needle aspiration cytology. Cytopathology 25 (4): 279-81, 2014.
Evaluación del riesgo genético para la enfermedad de Von Hippel-Lindau
El principal factor de riesgo de la enfermedad de VHL (o cualquier forma hereditaria de cáncer de riñón) es la presencia de un familiar afectado. Durante la evaluación del riesgo también se debe considerar el sexo y la edad de aparición de neoplasias específicas asociadas a la enfermedad de VHL. Por ejemplo, los feocromocitomas a veces aparecen temprano en la niñez,[
Cada descendiente (niño o niña) de una persona con enfermedad de VHL tiene una probabilidad del 50 % de heredar el alelo variante del gen VHL del progenitor afectado.
Diagnóstico clínico de la enfermedad de Von Hippel-Lindau
El diagnóstico de la enfermedad de VHL a menudo se basa en criterios clínicos. Si la historia familiar es compatible con la enfermedad de VHL, es posible establecer un diagnóstico clínico de VHL en un familiar que no se evaluó antes cuando esta persona presenta uno o más tumores específicos relacionados con la enfermedad de VHL (por ejemplo, hemangioblastoma del SNC o de retina, feocromocitomas, ccRCC o tumores de saco endolinfático). Si un paciente no tiene antecedentes familiares de enfermedad de VHL, debe cumplir con uno de los siguientes criterios: 1) dos o más hemangioblastomas del SNC, o 2) un hemangioblastoma del SNC y a) un tumor visceral o b) un tumor de saco endolinfático. Para obtener más información sobre los detalles del diagnóstico de la enfermedad de VHL, consulte el
En 1998, se notificaron todas las variantes patogénicas germinales identificadas en una cohorte de 93 familias con enfermedad de VHL. Desde entonces, el diagnóstico de la enfermedad de VHL se basa en una combinación de lo siguiente: 1) manifestaciones clínicas relacionadas con la enfermedad de VHL y 2) pruebas genéticas para las variantes patogénicas de VHL identificadas en las familias. Esta estrategia diagnóstica puede ser diferente entre los miembros de una familia. En el
| Historia familiar compatible con la enfermedad de VHL | Pruebas genéticas | Escenarios para el diagnóstico clínico | Exigencias para el diagnóstico clínico |
|---|---|---|---|
| SNC = sistema nervioso central; ccRCC = carcinoma renal de células claras. | |||
| Adaptación y actualización de Glenn et al[ |
|||
| Historia familiar compatible con la enfermedad de VHL. | Prueba de DNA para la misma variante patogénica deVHLque se detectó antes en uno o más familiares biológicos afectados. | Cuando se desconoce la variante patogénica deVHLen un familiar biológico | Para establecer el diagnóstico clínico se necesita al menos uno de los siguientes elementos: |
| - Cistoadenoma de epidídimo o de ligamento ancho del útero | |||
| - Hemangioblastoma del SNC | |||
| - ccRCC multifocal | |||
| - Feocromocitoma | |||
| - Hemangioblastoma de retina | |||
| - Tumor neuroendocrino de páncreas | |||
| - Quistes pancreáticos o cistoadenoma | |||
| - Tumor de saco endolinfático | |||
| Sin historia familiar compatible con enfermedad de VHL | Es posible que se obtengan resultados negativos en las pruebas genéticas si la variante patogénica deVHLes poscigótica (por ejemplo, mosaicismo deVHL) | Cuando se desconoce la variante patogénica deVHLo se obtuvo un resultado negativo en la prueba germinal, pero hay signos clínicos de enfermedad de VHL | Para establecer el diagnóstico clínico se necesita al menos uno de los siguientes elementos: |
| - Hemangioblastoma del SNC | |||
| - Hemangioblastoma de retina | |||
| Si solo se presenta una de las opciones anteriores, también se debe observar uno de los siguientes elementos para establecer el diagnóstico clínico: | |||
| - ccRCC | |||
| - Feocromocitoma | |||
| - Quistes pancreáticos o cistoadenoma | |||
| - Tumor de saco endolinfático | |||
| - Cistoadenoma de epidídimo o de ligamento ancho del útero | |||
Pruebas genéticas para la enfermedad de Von Hippel-Lindau
Se recomienda informar a los familiares en riesgo sobre la posibilidad de hacer pruebas genéticas para la detección de la enfermedad de VHL. A cualquier familiar con diagnóstico clínico de enfermedad de VHL, o con signos o síntomas de esta enfermedad, por lo general, se le ofrecen primero pruebas genéticas. En más del 99 % de las familias afectadas por la enfermedad de VHL se detectan variantes patogénicas germinales del gen VHL.
El análisis de la secuencia de los 3 exones detecta variantes de un solo nucleótido en el gen VHL (~72 % de todas las variantes patogénicas).[
Antes de las pruebas genéticas se proporciona asesoramiento genético. Este tipo de asesoramiento incluye un análisis de las implicaciones médicas, económicas y psicosociales para el paciente y sus familiares consanguíneos. Después de esta orientación, el paciente puede elegir someterse a las pruebas genéticas, tras un consentimiento informado. Se proporciona asesoramiento genético adicional en el momento de notificar los resultados al paciente. Cuando se identifica una variante patogénica de VHL en una familia, los familiares biológicos que obtienen un resultado negativo para la misma variante no son portadores del rasgo (es decir, son verdaderos negativos) y no están predispuestos a manifestaciones de la enfermedad de VHL. Además, los hijos de familiares que obtienen un resultado negativo verdadero tampoco están en riesgo de enfermedad de VHL. Por lo tanto, no necesitan hacerse pruebas clínicas en su vida.[
Diagnóstico genético de la enfermedad de Von Hippel-Lindau
La presencia de una variante patogénica germinal del gen VHL se considera suficiente para establecer el diagnóstico genético.
Ese hallazgo predispone a la persona a presentar manifestaciones clínicas de la enfermedad de VHL, y le confiere un riesgo del 50 % de transmitir la variante patogénica de VHL a cada descendente (de cualquier sexo). Se ha establecido una asociación con las manifestaciones clínicas de la enfermedad de VHL para cerca de 400 variantes patogénicas únicas del gen VHL, su presencia verifica la causalidad patogénica de la variante. La evaluación genética para el diagnóstico en una familia que no ha sido sometida a pruebas por lo general comienza en una persona con diagnóstico clínico. Si se identifica una variante patogénica de VHL, esa variante específica se convierte en el marcador de DNA para someter a pruebas a otros familiares biológicos. Algunas personas quizás cumplan con los criterios clínicos de diagnóstico de la enfermedad de VHL, pero no presentan un resultado positivo para una variante patogénica de VHL. Cuando estas personas tampoco tienen una historia familiar compatible con la enfermedad de VHL, es posible que presenten variantes patogénicas de novo o mosaicismo. Esto último se detecta mediante una prueba genética en otros tejidos corporales, como fibroblastos de la piel o células exfoliadas de la mejilla. Para obtener más información, consultar la sección
Referencias:
- Choyke PL, Glenn GM, Walther MM, et al.: von Hippel-Lindau disease: genetic, clinical, and imaging features. Radiology 194 (3): 629-42, 1995.
- Maher ER, Yates JR, Harries R, et al.: Clinical features and natural history of von Hippel-Lindau disease. Q J Med 77 (283): 1151-63, 1990.
- Lonser RR, Glenn GM, Walther M, et al.: von Hippel-Lindau disease. Lancet 361 (9374): 2059-67, 2003.
- Pithukpakorn M, Glenn G: von Hippel-Lindau syndrome. Community Oncology 1 (4): 232-43, 2004.
- Glenn GM, Daniel LN, Choyke P, et al.: Von Hippel-Lindau (VHL) disease: distinct phenotypes suggest more than one mutant allele at the VHL locus. Hum Genet 87 (2): 207-10, 1991.
- Stolle C, Glenn G, Zbar B, et al.: Improved detection of germline mutations in the von Hippel-Lindau disease tumor suppressor gene. Hum Mutat 12 (6): 417-23, 1998.
- Coppin L, Grutzmacher C, Crépin M, et al.: VHL mosaicism can be detected by clinical next-generation sequencing and is not restricted to patients with a mild phenotype. Eur J Hum Genet 22 (9): 1149-52, 2014.
Detección temprana de las manifestaciones de la enfermedad de Von Hippel-Lindau
Hay directrices para la detección de las manifestaciones de la enfermedad de VHL. En general, estas recomendaciones parten de la opinión y el consenso de expertos, pero la mayoría de ellas no se basan en la evidencia. Se dispone de varias directrices de detección y vigilancia para la enfermedad de VHL.[
| Prueba o análisis | Afección a detectar |
|---|---|
| SNC = sistema nervioso central; CAI = canal auditivo interno; IRM = imágenes por resonancia magnética. | |
| a Adaptación de la VHL Alliance.[ |
|
| b Los antecedentes y el examen físico apropiados para la edad incluyen los siguientes aspectos: examen neurológico, preguntas y pruebas auditivas y vestibuloneurales, síntomas visuales, evaluación de los síntomas del exceso de catecolaminas (cefaleas, palpitaciones, diaforesis, hiperactividad, ansiedad, poliuria y dolor abdominal). | |
| Antecedentes y examen físicob | Todas las afecciones enumeradas en este cuadro |
| Examen ocular en persona mediante oftalmoscopia con dilatación | Hemangioblastoma de retina |
| Medición de la presión arterial y el pulso, metanefrinas libres en plasma o metanefrinas fraccionadas libres en orina de 24 horas | Feocromocitoma o paraganglioma |
| IRM del encéfalo y la columna vertebral completa con contraste o sin este | Hemangioblastoma del SNC |
| IRM del abdomen con contraste o sin este | Carcinoma de células renales, feocromocitoma o paraganglioma, tumor o quiste neuroendocrino de páncreas |
| Examen audiológico, IRM del CAI | Tumor de saco endolinfático |
Nivel de evidencia: 5
Detección de los feocromocitomas
Es posible la detección temprana de los feocromocitomas cuando se realizan pruebas clave como las concentraciones de catecolaminas y metanefrinas y las imágenes abdominales transversales. La mayoría de los feocromocitomas pequeños (≤1 cm) tienen concentraciones indetectables de catecolaminas o metanefrinas, pero estas concentraciones pueden aumentar con la progresión del tumor.[
Pruebas bioquímicas para los feocromocitomas
Las pruebas bioquímicas son esenciales para la evaluación de las personas con enfermedad de VHL, ya que las concentraciones de metabolitos a menudo se elevan en ausencia de hallazgos anatómicos en las imágenes. La evaluación comienza en la niñez; algunas pautas recomiendan iniciarlas a los 5 años de edad (
Pruebas con imágenes para los feocromocitomas
Las imágenes transversales se obtienen desde el principio de la 2. década de vida para evaluar los riñones, las glándulas suprarrenales y el páncreas. Las imágenes por resonancia magnética (IRM) y por tomografía computarizada (TC) son métodos con excelentes características de rendimiento para la detección de feocromocitomas, su sensibilidad supera el 90 %.[
Detección de los tumores de saco endolinfático
Los tumores de saco endolinfático a menudo causan disfunción audiovestibular permanente. La identificación temprana y el tratamiento de estos tumores pueden disminuir significativamente la morbilidad. Por lo general, la detección de los tumores de saco endolinfático incluye evaluación clínica, audiograma y pruebas con imágenes. La guía de consenso de expertos de la VHL Alliance sobre las recomendaciones para la detección de los tumores de saco endolinfático se fundamenta en la evidencia disponible.[
Referencias:
- Wolters WPG, Dreijerink KMA, Giles RH, et al.: Multidisciplinary integrated care pathway for von Hippel-Lindau disease. Cancer 128 (15): 2871-2879, 2022.
- Binderup MLM, Smerdel M, Borgwadt L, et al.: von Hippel-Lindau disease: Updated guideline for diagnosis and surveillance. Eur J Med Genet 65 (8): 104538, 2022.
- VHL Alliance: VHLA Suggested Active Surveillance Guidelines. Boston, MA: VHL Alliance, 2020.
Available online . Last accessed October 22, 2024. - Daniels AB, Tirosh A, Huntoon K, et al.: Guidelines for surveillance of patients with von Hippel-Lindau disease: Consensus statement of the International VHL Surveillance Guidelines Consortium and VHL Alliance. Cancer 129 (19): 2927-2940, 2023.
- Sanford T, Gomella PT, Siddiqui R, et al.: Long term outcomes for patients with von Hippel-Lindau and Pheochromocytoma: defining the role of active surveillance. Urol Oncol 39 (2): 134.e1-134.e8, 2021.
- Neary NM, King KS, Pacak K: Drugs and pheochromocytoma--don't be fooled by every elevated metanephrine. N Engl J Med 364 (23): 2268-70, 2011.
- Shuch B, Ricketts CJ, Metwalli AR, et al.: The genetic basis of pheochromocytoma and paraganglioma: implications for management. Urology 83 (6): 1225-32, 2014.
- Čtvrtlík F, Koranda P, Schovánek J, et al.: Current diagnostic imaging of pheochromocytomas and implications for therapeutic strategy. Exp Ther Med 15 (4): 3151-3160, 2018.
- Ilias I, Pacak K: Current approaches and recommended algorithm for the diagnostic localization of pheochromocytoma. J Clin Endocrinol Metab 89 (2): 479-91, 2004.
- Ilias I, Meristoudis G: Functional Imaging of Paragangliomas with an Emphasis on Von Hippel-Lindau-Associated Disease: A Mini Review. J Kidney Cancer VHL 4 (3): 30-36, 2017.
- Mehta GU, Kim HJ, Gidley PW, et al.: Endolymphatic Sac Tumor Screening and Diagnosis in von Hippel-Lindau Disease: A Consensus Statement. J Neurol Surg B Skull Base 83 (Suppl 2): e225-e231, 2022.
- Poulsen ML, Gimsing S, Kosteljanetz M, et al.: von Hippel-Lindau disease: surveillance strategy for endolymphatic sac tumors. Genet Med 13 (12): 1032-41, 2011.
- Butman JA, Nduom E, Kim HJ, et al.: Imaging detection of endolymphatic sac tumor-associated hydrops. J Neurosurg 119 (2): 406-11, 2013.
Tratamiento de las manifestaciones de la enfermedad
Tratamiento de los tumores renales
Intervenciones quirúrgicas para los tumores renales
El tratamiento de la enfermedad de Von Hippel-Lindau (VHL) fue cambiando mucho a medida que los profesionales clínicos aprendían a equilibrar el riesgo de diseminación del cáncer al mismo tiempo que reducían la morbilidad renal. En algunas de las series quirúrgicas iniciales se usó la nefrectomía radical bilateral seguida de trasplante renal como tratamiento de tumores renales[
Los pacientes con enfermedad de VHL en ocasiones tienen docenas de tumores renales. Por lo tanto, la resección de toda la enfermedad renal evidente no siempre es posible. Con el fin de reducir al mínimo la morbilidad derivada de múltiples procedimientos quirúrgicos, la disminución del funcionamiento renal y el riesgo de progresión a distancia, se ha buscado un método que equilibre el tratamiento para evitar sobretratar o subtratar. El Instituto Nacional del Cáncer (NCI) evaluó un umbral específico de tamaño tumoral como desencadenante para llevar a cabo la intervención quirúrgica. En una evaluación de 52 pacientes con enfermedad de VHL o carcinoma renal papilar hereditario tratados cuando la lesión renal sólida más grande alcanzó los 3 cm, se demostró la ausencia de evidencia de metástasis a distancia o necesidad de terapia de reemplazo renal al cabo de una mediana de seguimiento de 60 meses.[
Muchos pacientes con enfermedad de VHL continuamente están desarrollando nuevos RCC y es posible que necesiten más intervenciones. Las adherencias y las cicatrices perinéfricas hacen que los procedimientos quirúrgicos subsiguientes sean más difíciles. Si bien se podría considerar una nefrectomía radical, la cirugía conservadora de nefronas sigue siendo el abordaje preferido, cuando es posible. Aunque quizás la incidencia de complicaciones sea más alta con la cirugía conservadora de nefronas repetida y de rescate, es posible que esto permita mantener un funcionamiento renal excelente y desenlaces oncológicos favorables durante el seguimiento intermedio.[
Nivel de evidencia: 3di
Procedimientos de ablación para tumores renales
Con las técnicas de ablación térmica se aplica calor o frío extremos en una masa para destruirla. La crioablación (CA) y la ablación por radiofrecuencia (ARF) se usaron por primera vez para el tratamiento de masas renales pequeñas a finales de la década de 1990.[
Es posible que la ablación térmica desempeñe una función cada vez más importante como terapia de rescate para las personas con un riesgo alto de morbilidad quirúrgica. La CA se evaluó como un tratamiento de rescate en una serie de 14 pacientes para evitar la morbilidad relacionada con la repetición de la cirugía conservadora de nefronas. Los resultados mostraron un cambio mínimo en el funcionamiento renal después del tratamiento con CA. Solo se sospechó recidiva en 4 de 33 tumores (12,1 %) al cabo de una mediana de seguimiento de 37 meses.[
En síntesis, las aplicaciones clínicas de los procedimientos de ablación en la enfermedad de VHL no están definidas de forma clara, y la cirugía sigue siendo la intervención más estudiada. La evidencia clínica disponible indica que los procedimientos ablativos solo se recomiendan para masas renales pequeñas (≤3 cm) con realce sólido en pacientes de edad avanzada con riesgo quirúrgico alto, en especial aquellos que se enfrentan a cirugía renal de rescate debido a una tasa alta de complicaciones. La edad temprana, un tamaño de tumor superior a 4 cm, los tumores hiliares y las lesiones quísticas se consideran contraindicaciones relativas para la ablación térmica.[
Nivel de evidencia: 3di
Tratamiento de los feocromocitomas
Vigilancia de los feocromocitomas
Los feocromocitomas a veces son una fuente significativa de morbilidad en los pacientes con enfermedad de VHL porque el exceso de catecolaminas puede provocar efectos cardiovasculares importantes.[
Intervenciones quirúrgicas para los feocromocitomas
La resección quirúrgica es una herramienta importante para el tratamiento de los feocromocitomas en personas con enfermedad de VHL. Es importante que se obtengan evaluaciones endocrinas detalladas en todos los pacientes y que se administre tratamiento alfabloqueante antes de la resección quirúrgica de los feocromocitomas. A menudo, los medicamentos se deben iniciar y ajustar poco a poco antes de la cirugía para prevenir complicaciones cardiovasculares potencialmente mortales. Para obtener más información en inglés, consultar la sección
Los feocromocitomas en los pacientes con enfermedad de VHL quizás se traten de manera diferente a como se tratan en los pacientes con tumores esporádicos o que tienen otros síndromes de cáncer hereditario. Dado que los feocromocitomas son multifocales y bilaterales en casi el 50 % de los casos en personas con enfermedad de VHL, muchos pacientes se han sometido a una adrenalectomía bilateral y han necesitado reemplazo de corticoesteroides de por vida.[
La posibilidad de una adrenalectomía parcial donde quede cáncer residual es una preocupación para los pacientes con feocromocitoma maligno. Sin embargo, en la población con enfermedad de VHL, la tasa de neoplasia maligna para los feocromocitomas es baja (<5 %).[
Si se hace una adrenalectomía total, la vena suprarrenal se suele dividir temprano para limitar la liberación de catecolaminas durante la movilización de la glándula. Sin embargo, en una adrenalectomía parcial, la división de la vena suprarrenal puede provocar congestión venosa y compromiso de la glándula.[
Los abordajes quirúrgicos de resección abierta y laparoscópica son inocuos, pero se prefiere la extirpación por laparoscopia siempre que sea posible.[
Tratamiento de las manifestaciones pancreáticas
Los tumores relacionados con la enfermedad de VHL, como los tumores neuroendocrinos de páncreas, a veces se encuentran de manera fortuita al observar una imagen o al aplicar los protocolos de vigilancia de por vida.[
Evaluación diagnóstica y pruebas con imágenes para las manifestaciones pancreáticas
Los quistes pancreáticos son benignos y casi nunca necesitan intervención. Los quistes pancreáticos en la enfermedad de VHL no muestran realce en las imágenes y no tienen potencial maligno, independientemente del tamaño. La enfermedad quística difusa del páncreas casi nunca afecta el funcionamiento endocrino. En pocas ocasiones, el quiste reemplaza el páncreas normal y a veces causa una pérdida del funcionamiento exocrino. Cuando se presenta distensión abdominal, cólicos, diarrea o dolor abdominal al ingerir comidas grasosas, es posible obtener estudios enzimáticos en la materia fecal para determinar si se indica la administración de suplementos exocrinos. Las lesiones pancreáticas sólidas o mixtas requieren evaluación y tratamiento especializados, ya que pueden ser cistoadenomas o tumores neuroendocrinos de páncreas. La mayoría de los tumores neuroendocrinos de páncreas no son funcionantes, pero se podría considerar la evaluación de laboratorio con marcadores bioquímicos, como la cromogranina A, durante la evaluación diagnóstica o el seguimiento. Las evaluaciones con imágenes por tomografía computarizada (TC) o resonancia magnética (IRM) con contraste son métodos excelentes para caracterizar las lesiones del páncreas. También se ha utilizado la tomografía por emisión de positrones (TEP) o TC con galio Ga 68-dotate para detectar tumores relacionados con la enfermedad de VHL.[
Vigilancia de las manifestaciones pancreáticas
Los cistoadenomas serosos no tienen potencial maligno y es seguro someterlos a observación. La obstrucción local del colédoco o el conducto pancreático es infrecuente con estas lesiones. Los tumores neuroendocrinos de páncreas sólidos tienen un potencial metastásico bajo, y es posible seguirlos con observación cuando son pequeños, localizados y asintomáticos. La duración y el tipo de imágenes del páncreas dependen del centro, pero los principios generales incluyen imágenes cada 1 a 2 años con el mismo método para permitir comparaciones significativas. Las lesiones pancreáticas con tiempo de duplicación lento y tamaño inferior a 3 cm en pacientes que no tienen variantes patogénica en el exón 3 exhiben los desenlaces más favorables.[
Intervenciones quirúrgicas para las manifestaciones pancreáticas
Los quistes pancreáticos rara vez necesitan intervención quirúrgica, excepto cuando ejercen un efecto de masa. En estos casos raros es posible considerar una aspiración o decorticación. Las indicaciones quirúrgicas en los tumores neuroendocrinos de páncreas varían, pero las intervenciones se ofrecen para reducir el riesgo de diseminación. En una revisión de la historia natural de los tumores neuroendocrinos de páncreas se registró que estos tumores a veces presentan características de crecimiento no lineal.[
Si se encuentran ganglios linfáticos comprometidos durante la cirugía, se deben extirpar. En las personas con tumores neuroendocrinos de páncreas localmente avanzados o metastásicos, es posible considerar la cirugía cuando sea posible hacer una citorreducción significativa. Además, las lesiones hepáticas metastásicas a menudo se tratan con procedimientos de ablación local o resección en algunos pacientes con enfermedad de VHL.
Tratamiento de los hemangioblastomas de retina
Intervenciones para los hemangioblastomas de retina
El tratamiento de los hemangioblastomas de retina incluye láser, terapia fotodinámica y vitrectomía. También se han probado terapias sistémicas y locales.
Fotocoagulación con láser.
La fotocoagulación con láser se usa de manera generalizada para tratar los hemangioblastomas de retina en pacientes con enfermedad de VHL. En una revisión retrospectiva de 304 hemangioblastomas de retina tratados en 100 ojos, se observó que la fotocoagulación con láser tuvo una tasa de control superior al 90 % y fue más eficaz en lesiones más pequeñas de hasta 1 disco de diámetro.[
Vitrectomía y retinectomía
En 21 pacientes con desprendimiento de retina grave se conservó la visión en grados variables cuando el tratamiento se hizo con vitrectomía a través de la parte plana con desprendimiento hialoideo posterior, disección de la membrana epirretiniana, e inyección de aceite de silicona o gas con retinectomía, fotocoagulación o crioterapia para extirpar el hemangioblastoma de retina.[
Terapia fotodinámica
La terapia fotodinámica redujo el edema macular en una serie de casos de 2 pacientes con hemangioblastomas bilaterales de retina.[
Tratamiento intravítreo
El tratamiento intravítreo con bevacizumab produjo estabilización de los hemangioblastomas capilares de retina durante más de 2 años en un informe de casos [
Terapia de protones
En un estudio de casos donde se usó la terapia de protones en 8 ojos de 8 pacientes, se observó resolución del edema macular en 7 de 8 pacientes. Todos los ojos tratados conservaron la visión después de una mediana de seguimiento de 84 meses.[
Tratamiento de los hemangioblastomas del sistema nervioso central
Vigilancia de los hemangioblastomas del sistema nervioso central
Muchas lesiones pequeñas se encuentran de manera fortuita durante la detección sistemática y es posible que los pacientes permanezcan asintomáticos durante un período largo. En un estudio de seguimiento por un corto plazo, del 35,5 % al 51 % de los hemangioblastomas del SNC permanecieron estables.[
En una serie de los Institutos Nacionales de la Salud, los investigadores observaron que el modelo de crecimiento de los hemangioblastomas del sistema nervioso central (SNC) varía, pero el más frecuente es el crecimiento saltatorio (72 %).[
Otra serie pequeña (n = 52) tuvo como objetivo evaluar las tasas de crecimiento de los hemangioblastomas del SNC bajo vigilancia. Los investigadores encontraron que la presencia de síntomas era el único predictor independiente del crecimiento.[
Intervenciones quirúrgicas para los hemangioblastomas del sistema nervioso central
El abordaje de tratamiento estándar ha sido la resección quirúrgica de los hemangioblastomas de cerebelo o de médula espinal. Si bien la resección quirúrgica de los tumores por lo general se realiza antes de la aparición de los síntomas neurológicos,[
Radioterapia para los hemangioblastomas del sistema nervioso central
Debido a que los pacientes a veces tienen tumores múltiples y requieren varios procedimientos quirúrgicos, la radioterapia externa se ha convertido en una alternativa cuando no es factible la cirugía de resección. La radiocirugía estereotáctica es un abordaje de uso generalizado para el tratamiento del hemangioblastoma.[
Tratamiento de los tumores de saco endolinfático
Hay pocos datos sobre el tratamiento de los tumores de saco endolinfático, que en su mayoría provienen de series de casos en donde se describe el tratamiento quirúrgico de tumores esporádicos y tumores asociados a la enfermedad de VHL. Debido a que el compromiso audiovestibular no depende del tamaño del tumor y se puede presentar con tumores pequeños, por lo general se prefiere la intervención temprana. Es posible que la intervención temprana también reduzca al mínimo el riesgo de invasión de las estructuras circundantes y aumente la probabilidad de una resección completa. En un metaanálisis se evaluaron los desenlaces en 82 estudios donde se trataron 252 tumores.[
Terapia sistémica específica para la enfermedad de Von Hippel-Lindau localizada
Los pacientes con enfermedad de VHL a menudo requieren múltiples tratamientos locales para las manifestaciones de la enfermedad. Las intervenciones quirúrgicas repetidas contribuyen a la morbilidad y, a menudo, pueden causar daños irreversibles en los órganos afectados. Se puede presentar la pérdida permanente de funcionamiento en los siguientes órganos:
- Deterioro visual (retinas).
- Enfermedad renal crónica (riñones).
- Insuficiencia suprarrenal (glándulas suprarrenales).
- Diabetes y deficiencia exocrina pancreática (páncreas).
- Complicaciones neurológicas como alteraciones motoras o sensoriales (encéfalo y columna vertebral).
Los investigadores han buscado una terapia sistémica que reduzca o elimine la necesidad de intervenciones locales. La comprensión de las características biológicas de la enfermedad de VHL ha llevado al desarrollo de terapias dirigidas que interfieren con la cascada de señalización resultante asociada con la tumorogénesis.[
En la investigación inicial sobre el tratamiento con tanespimicina (17-AAG), se destacó que la administración intravenosa de medicamentos tal vez no sea la preferida por algunos pacientes. La toxicidad modesta y la tolerabilidad deficiente relacionadas con 17-AAG pueden disuadir a los pacientes sanos (con otras opciones quirúrgicas) de usar este tratamiento.[
Si bien la terapia anti-VEGF se administra de manera sistémica para la mayoría de las neoplasias relacionadas con la enfermedad de VHL, se puede administrar directamente en el ojo en casos de tumores de retina relacionados con esta enfermedad. Se evaluó la administración intravítrea del pegaptanib (terapia anti-VEGF) en 5 pacientes con hemangioblastomas de retina relacionados con la enfermedad de VHL.[
La investigación dirigida a las consecuencias del aumento regulado de HIF (debido a la inactivación del gen VHL) solo tuvo un éxito moderado. Por lo tanto, los esfuerzos recientes se han centrado en abordar las consecuencias directas de la pérdida de actividad del gen VHL. En muchos estudios se demostró que múltiples moléculas de HIF regulan de manera diferenciada la carcinogénesis, y que HIF2 es el mediador más crítico.[
Tratamiento de la enfermedad de Von Hippel-Lindau durante el embarazo
En 2 estudios se examinó el efecto del embarazo en la progresión del hemangioblastoma en pacientes con enfermedad de Von Hippel-Lindau (VHL).[
Referencias:
- Goldfarb DA, Neumann HP, Penn I, et al.: Results of renal transplantation in patients with renal cell carcinoma and von Hippel-Lindau disease. Transplantation 64 (12): 1726-9, 1997.
- Fetner CD, Barilla DE, Scott T, et al.: Bilateral renal cell carcinoma in von Hippel-Lindau syndrome: treatment with staged bilateral nephrectomy and hemodialysis. J Urol 117 (4): 534-6, 1977.
- Antony MB, Rompré-Brodeur A, Chaurasia A, et al.: Outcomes of and indications for renal transplantation in patients with von Hippel Lindau disease. Urol Oncol 41 (12): 487.e1-487.e6, 2023.
- Pearson JC, Weiss J, Tanagho EA: A plea for conservation of kidney in renal adenocarcinoma associated with von Hippel-Lindau disease. J Urol 124 (6): 910-2, 1980.
- Loughlin KR, Gittes RF: Urological management of patients with von Hippel-Lindau's disease. J Urol 136 (4): 789-91, 1986.
- Steinbach F, Novick AC, Zincke H, et al.: Treatment of renal cell carcinoma in von Hippel-Lindau disease: a multicenter study. J Urol 153 (6): 1812-6, 1995.
- Walther MM, Thompson N, Linehan W: Enucleation procedures in patients with multiple hereditary renal tumors. World J Urol 13 (4): 248-50, 1995.
- Walther MM, Choyke PL, Glenn G, et al.: Renal cancer in families with hereditary renal cancer: prospective analysis of a tumor size threshold for renal parenchymal sparing surgery. J Urol 161 (5): 1475-9, 1999.
- Duffey BG, Choyke PL, Glenn G, et al.: The relationship between renal tumor size and metastases in patients with von Hippel-Lindau disease. J Urol 172 (1): 63-5, 2004.
- Peng X, Chen J, Wang J, et al.: Natural history of renal tumours in von Hippel-Lindau disease: a large retrospective study of Chinese patients. J Med Genet 56 (6): 380-387, 2019.
- Zhang J, Pan JH, Dong BJ, et al.: Active surveillance of renal masses in von Hippel-Lindau disease: growth rates and clinical outcome over a median follow-up period of 56 months. Fam Cancer 11 (2): 209-14, 2012.
- Jilg CA, Neumann HP, Gläsker S, et al.: Growth kinetics in von Hippel-Lindau-associated renal cell carcinoma. Urol Int 88 (1): 71-8, 2012.
- Neumann HP, Bender BU, Berger DP, et al.: Prevalence, morphology and biology of renal cell carcinoma in von Hippel-Lindau disease compared to sporadic renal cell carcinoma. J Urol 160 (4): 1248-54, 1998.
- Fadahunsi AT, Sanford T, Linehan WM, et al.: Feasibility and outcomes of partial nephrectomy for resection of at least 20 tumors in a single renal unit. J Urol 185 (1): 49-53, 2011.
- Choyke PL, Pavlovich CP, Daryanani KD, et al.: Intraoperative ultrasound during renal parenchymal sparing surgery for hereditary renal cancers: a 10-year experience. J Urol 165 (2): 397-400, 2001.
- Bratslavsky G, Liu JJ, Johnson AD, et al.: Salvage partial nephrectomy for hereditary renal cancer: feasibility and outcomes. J Urol 179 (1): 67-70, 2008.
- Johnson A, Sudarshan S, Liu J, et al.: Feasibility and outcomes of repeat partial nephrectomy. J Urol 180 (1): 89-93; discussion 93, 2008.
- Shuch B, Linehan WM, Bratslavsky G: Repeat partial nephrectomy: surgical, functional and oncological outcomes. Curr Opin Urol 21 (5): 368-75, 2011.
- Gill IS, Novick AC, Soble JJ, et al.: Laparoscopic renal cryoablation: initial clinical series. Urology 52 (4): 543-51, 1998.
- McGovern FJ, Wood BJ, Goldberg SN, et al.: Radio frequency ablation of renal cell carcinoma via image guided needle electrodes. J Urol 161 (2): 599-600, 1999.
- Campbell SC, Novick AC, Belldegrun A, et al.: Guideline for management of the clinical T1 renal mass. J Urol 182 (4): 1271-9, 2009.
- Walther MC, Shawker TH, Libutti SK, et al.: A phase 2 study of radio frequency interstitial tissue ablation of localized renal tumors. J Urol 163 (5): 1424-7, 2000.
- Shingleton WB, Sewell PE: Percutaneous renal cryoablation of renal tumors in patients with von Hippel-Lindau disease. J Urol 167 (3): 1268-70, 2002.
- Park BK, Kim CK: Percutaneous radio frequency ablation of renal tumors in patients with von Hippel-Lindau disease: preliminary results. J Urol 183 (5): 1703-7, 2010.
- Chan VW, Lenton J, Smith J, et al.: Multimodal image-guided ablation on management of renal cancer in Von-Hippel-Lindau syndrome patients from 2004 to 2021 at a specialist centre: A longitudinal observational study. Eur J Surg Oncol 48 (3): 672-679, 2022.
- Joly D, Méjean A, Corréas JM, et al.: Progress in nephron sparing therapy for renal cell carcinoma and von Hippel-Lindau disease. J Urol 185 (6): 2056-60, 2011.
- Yang B, Autorino R, Remer EM, et al.: Probe ablation as salvage therapy for renal tumors in von Hippel-Lindau patients: the Cleveland Clinic experience with 3 years follow-up. Urol Oncol 31 (5): 686-92, 2013.
- Nguyen CT, Lane BR, Kaouk JH, et al.: Surgical salvage of renal cell carcinoma recurrence after thermal ablative therapy. J Urol 180 (1): 104-9; discussion 109, 2008.
- Karam JA, Wood CG, Compton ZR, et al.: Salvage surgery after energy ablation for renal masses. BJU Int 115 (1): 74-80, 2015.
- Kowalczyk KJ, Hooper HB, Linehan WM, et al.: Partial nephrectomy after previous radio frequency ablation: the National Cancer Institute experience. J Urol 182 (5): 2158-63, 2009.
- Shuch B, Singer EA, Bratslavsky G: The surgical approach to multifocal renal cancers: hereditary syndromes, ipsilateral multifocality, and bilateral tumors. Urol Clin North Am 39 (2): 133-48, v, 2012.
- Dominguez-Escrig JL, Sahadevan K, Johnson P: Cryoablation for small renal masses. Adv Urol : 479495, 2008.
- Aron M, Gill IS: Minimally invasive nephron-sparing surgery (MINSS) for renal tumours. Part II: probe ablative therapy. Eur Urol 51 (2): 348-57, 2007.
- Sanford T, Gomella PT, Siddiqui R, et al.: Long term outcomes for patients with von Hippel-Lindau and Pheochromocytoma: defining the role of active surveillance. Urol Oncol 39 (2): 134.e1-134.e8, 2021.
- Benhammou JN, Boris RS, Pacak K, et al.: Functional and oncologic outcomes of partial adrenalectomy for pheochromocytoma in patients with von Hippel-Lindau syndrome after at least 5 years of followup. J Urol 184 (5): 1855-9, 2010.
- Baghai M, Thompson GB, Young WF, et al.: Pheochromocytomas and paragangliomas in von Hippel-Lindau disease: a role for laparoscopic and cortical-sparing surgery. Arch Surg 137 (6): 682-8; discussion 688-9, 2002.
- Brauckhoff M, Gimm O, Thanh PN, et al.: Critical size of residual adrenal tissue and recovery from impaired early postoperative adrenocortical function after subtotal bilateral adrenalectomy. Surgery 134 (6): 1020-7; discussion 1027-8, 2003.
- Walther MM, Keiser HR, Choyke PL, et al.: Management of hereditary pheochromocytoma in von Hippel-Lindau kindreds with partial adrenalectomy. J Urol 161 (2): 395-8, 1999.
- Fallon SC, Feig D, Lopez ME, et al.: The utility of cortical-sparing adrenalectomy in pheochromocytomas associated with genetic syndromes. J Pediatr Surg 48 (6): 1422-5, 2013.
- Roukounakis N, Dimas S, Kafetzis I, et al.: Is preservation of the adrenal vein mandatory in laparoscopic adrenal-sparing surgery? JSLS 11 (2): 215-8, 2007 Apr-Jun.
- Timmers HJ, Gimenez-Roqueplo AP, Mannelli M, et al.: Clinical aspects of SDHx-related pheochromocytoma and paraganglioma. Endocr Relat Cancer 16 (2): 391-400, 2009.
- Vargas HI, Kavoussi LR, Bartlett DL, et al.: Laparoscopic adrenalectomy: a new standard of care. Urology 49 (5): 673-8, 1997.
- Perrier ND, Kennamer DL, Bao R, et al.: Posterior retroperitoneoscopic adrenalectomy: preferred technique for removal of benign tumors and isolated metastases. Ann Surg 248 (4): 666-74, 2008.
- Dickson PV, Jimenez C, Chisholm GB, et al.: Posterior retroperitoneoscopic adrenalectomy: a contemporary American experience. J Am Coll Surg 212 (4): 659-65; discussion 665-7, 2011.
- Binderup ML, Bisgaard ML, Harbud V, et al.: Von Hippel-Lindau disease (vHL). National clinical guideline for diagnosis and surveillance in Denmark. 3rd edition. Dan Med J 60 (12): B4763, 2013.
- Kruizinga RC, Sluiter WJ, de Vries EG, et al.: Calculating optimal surveillance for detection of von Hippel-Lindau-related manifestations. Endocr Relat Cancer 21 (1): 63-71, 2014.
- Keutgen XM, Hammel P, Choyke PL, et al.: Evaluation and management of pancreatic lesions in patients with von Hippel-Lindau disease. Nat Rev Clin Oncol 13 (9): 537-49, 2016.
- Shell J, Tirosh A, Millo C, et al.: The utility of 68Gallium-DOTATATE PET/CT in the detection of von Hippel-Lindau disease associated tumors. Eur J Radiol 112: 130-135, 2019.
- Sadowski SM, Weisbrod AB, Ellis R, et al.: Prospective evaluation of the clinical utility of 18-fluorodeoxyglucose PET CT scanning in patients with von hippel-lindau-associated pancreatic lesions. J Am Coll Surg 218 (5): 997-1003, 2014.
- Blansfield JA, Choyke L, Morita SY, et al.: Clinical, genetic and radiographic analysis of 108 patients with von Hippel-Lindau disease (VHL) manifested by pancreatic neuroendocrine neoplasms (PNETs). Surgery 142 (6): 814-8; discussion 818.e1-2, 2007.
- Tirosh A, Sadowski SM, Linehan WM, et al.: Association of VHL Genotype With Pancreatic Neuroendocrine Tumor Phenotype in Patients With von Hippel-Lindau Disease. JAMA Oncol 4 (1): 124-126, 2018.
- Weisbrod AB, Kitano M, Thomas F, et al.: Assessment of tumor growth in pancreatic neuroendocrine tumors in von Hippel Lindau syndrome. J Am Coll Surg 218 (2): 163-9, 2014.
- Libutti SK, Choyke PL, Bartlett DL, et al.: Pancreatic neuroendocrine tumors associated with von Hippel Lindau disease: diagnostic and management recommendations. Surgery 124 (6): 1153-9, 1998.
- Krivosic V, Kamami-Levy C, Jacob J, et al.: Laser photocoagulation for peripheral retinal capillary hemangioblastoma in von Hippel-Lindau disease. Ophthalmol Retina 1 (1): 59-67, 2017.
Also available online . Last accessed October 22, 2024. - Gaudric A, Krivosic V, Duguid G, et al.: Vitreoretinal surgery for severe retinal capillary hemangiomas in von hippel-lindau disease. Ophthalmology 118 (1): 142-9, 2011.
- Krzystolik K, Stopa M, Kuprjanowicz L, et al.: PARS PLANA VITRECTOMY IN ADVANCED CASES OF VON HIPPEL-LINDAU EYE DISEASE. Retina 36 (2): 325-34, 2016.
- Papastefanou VP, Pilli S, Stinghe A, et al.: Photodynamic therapy for retinal capillary hemangioma. Eye (Lond) 27 (3): 438-42, 2013.
- Sachdeva R, Dadgostar H, Kaiser PK, et al.: Verteporfin photodynamic therapy of six eyes with retinal capillary haemangioma. Acta Ophthalmol 88 (8): e334-40, 2010.
- Ach T, Thiemeyer D, Hoeh AE, et al.: Intravitreal bevacizumab for retinal capillary haemangioma: longterm results. Acta Ophthalmol 88 (4): e137-8, 2010.
- Slim E, Antoun J, Kourie HR, et al.: Intravitreal bevacizumab for retinal capillary hemangioblastoma: A case series and literature review. Can J Ophthalmol 49 (5): 450-7, 2014.
- Wong WT, Liang KJ, Hammel K, et al.: Intravitreal ranibizumab therapy for retinal capillary hemangioblastoma related to von Hippel-Lindau disease. Ophthalmology 115 (11): 1957-64, 2008.
- von Buelow M, Pape S, Hoerauf H: Systemic bevacizumab treatment of a juxtapapillary retinal haemangioma. Acta Ophthalmol Scand 85 (1): 114-6, 2007.
- Wackernagel W, Lackner EM, Pilz S, et al.: von Hippel-Lindau disease: treatment of retinal haemangioblastomas by targeted therapy with systemic bevacizumab. Acta Ophthalmol 88 (7): e271-2, 2010.
- Knickelbein JE, Jacobs-El N, Wong WT, et al.: Systemic Sunitinib Malate Treatment for Advanced Juxtapapillary Retinal Hemangioblastomas Associated with von Hippel-Lindau Disease. Ophthalmol Retina 1 (3): 181-187, 2017 May-Jun.
- Seibel I, Cordini D, Hager A, et al.: Long-term results after proton beam therapy for retinal papillary capillary hemangioma. Am J Ophthalmol 158 (2): 381-6, 2014.
- Byun J, Yoo HJ, Kim JH, et al.: Growth rate and fate of untreated hemangioblastomas: clinical assessment of the experience of a single institution. J Neurooncol 144 (1): 147-154, 2019.
- Lonser RR, Butman JA, Huntoon K, et al.: Prospective natural history study of central nervous system hemangioblastomas in von Hippel-Lindau disease. J Neurosurg 120 (5): 1055-62, 2014.
- Harati A, Satopää J, Mahler L, et al.: Early microsurgical treatment for spinal hemangioblastomas improves outcome in patients with von Hippel-Lindau disease. Surg Neurol Int 3: 6, 2012.
- Asthagiri AR, Mehta GU, Butman JA, et al.: Long-term stability after multilevel cervical laminectomy for spinal cord tumor resection in von Hippel-Lindau disease. J Neurosurg Spine 14 (4): 444-52, 2011.
- Das JM, Kesavapisharady K, Sadasivam S, et al.: Microsurgical Treatment of Sporadic and von Hippel-Lindau Disease Associated Spinal Hemangioblastomas: A Single-Institution Experience. Asian Spine J 11 (4): 548-555, 2017.
- Kano H, Shuto T, Iwai Y, et al.: Stereotactic radiosurgery for intracranial hemangioblastomas: a retrospective international outcome study. J Neurosurg 122 (6): 1469-78, 2015.
- Asthagiri AR, Mehta GU, Zach L, et al.: Prospective evaluation of radiosurgery for hemangioblastomas in von Hippel-Lindau disease. Neuro Oncol 12 (1): 80-6, 2010.
- Liebenow B, Tatter A, Dezarn WA, et al.: Gamma Knife Stereotactic Radiosurgery favorably changes the clinical course of hemangioblastoma growth in von Hippel-Lindau and sporadic patients. J Neurooncol 142 (3): 471-478, 2019.
- Tang JD, Grady AJ, Nickel CJ, et al.: Systematic Review of Endolymphatic Sac Tumor Treatment and Outcomes. Otolaryngol Head Neck Surg 168 (3): 282-290, 2023.
- Linehan WM, Pinto PA, Bratslavsky G, et al.: Hereditary kidney cancer: unique opportunity for disease-based therapy. Cancer 115 (10 Suppl): 2252-61, 2009.
- Shuch B: HIF2 Inhibition for von-Hippel Lindau Associated Kidney Cancer: Will Urology Lead or Follow? Urol Oncol 39 (5): 277-280, 2021.
- Jonasch E, McCutcheon IE, Waguespack SG, et al.: Pilot trial of sunitinib therapy in patients with von Hippel-Lindau disease. Ann Oncol 22 (12): 2661-6, 2011.
- Roma A, Maruzzo M, Basso U, et al.: First-Line sunitinib in patients with renal cell carcinoma (RCC) in von Hippel-Lindau (VHL) disease: clinical outcome and patterns of radiological response. Fam Cancer 14 (2): 309-16, 2015.
- Stamatakis L, Shuch B, Singer EA, et al.: Phase II trial of vandetanib in Von Hippel-Lindau-associated renal cell carcinoma. J Clin Oncol 31 (15 Suppl): 4584, 2013.
Also available online . Last accessed October 22, 2024. - Jonasch E, McCutcheon IE, Gombos DS, et al.: Pazopanib in patients with von Hippel-Lindau disease: a single-arm, single-centre, phase 2 trial. Lancet Oncol 19 (10): 1351-1359, 2018.
- Dahr SS, Cusick M, Rodriguez-Coleman H, et al.: Intravitreal anti-vascular endothelial growth factor therapy with pegaptanib for advanced von Hippel-Lindau disease of the retina. Retina 27 (2): 150-8, 2007.
- Kondo K, Kim WY, Lechpammer M, et al.: Inhibition of HIF2alpha is sufficient to suppress pVHL-defective tumor growth. PLoS Biol 1 (3): E83, 2003.
- Courtney KD, Infante JR, Lam ET, et al.: Phase I Dose-Escalation Trial of PT2385, a First-in-Class Hypoxia-Inducible Factor-2α Antagonist in Patients With Previously Treated Advanced Clear Cell Renal Cell Carcinoma. J Clin Oncol 36 (9): 867-874, 2018.
- Jonasch E, Donskov F, Iliopoulos O, et al.: Belzutifan for Renal Cell Carcinoma in von Hippel-Lindau Disease. N Engl J Med 385 (22): 2036-2046, 2021.
- Frantzen C, Kruizinga RC, van Asselt SJ, et al.: Pregnancy-related hemangioblastoma progression and complications in von Hippel-Lindau disease. Neurology 79 (8): 793-6, 2012.
- Ye DY, Bakhtian KD, Asthagiri AR, et al.: Effect of pregnancy on hemangioblastoma development and progression in von Hippel-Lindau disease. J Neurosurg 117 (5): 818-24, 2012.
Pronóstico
Tradicionalmente, la supervivencia de los pacientes con enfermedad de Von Hippel-Lindau (VHL) ha sido más precaria cuando se compara con la población general, debido a la morbilidad y mortalidad de las diversas manifestaciones de la enfermedad y el tratamiento correspondiente.[
En el pasado, el carcinoma de células renales (RCC) metastásico produjo cerca de un tercio de las muertes en pacientes con enfermedad de VHL y, en algunos informes, fue la principal causa de muerte en los pacientes con enfermedad de VHL.[
La morbilidad y la mortalidad de la enfermedad de VHL varían y cambian según el fenotipo individual y familiar de la enfermedad de VHL (por ejemplo, tipo 1, 2A, 2B o 2C). Para obtener más información, consultar la sección
Referencias:
- Maher ER, Yates JR, Harries R, et al.: Clinical features and natural history of von Hippel-Lindau disease. Q J Med 77 (283): 1151-63, 1990.
- Binderup ML, Jensen AM, Budtz-Jørgensen E, et al.: Survival and causes of death in patients with von Hippel-Lindau disease. J Med Genet 54 (1): 11-18, 2017.
- Wang JY, Peng SH, Li T, et al.: Risk factors for survival in patients with von Hippel-Lindau disease. J Med Genet 55 (5): 322-328, 2018.
- Lamiell JM, Salazar FG, Hsia YE: von Hippel-Lindau disease affecting 43 members of a single kindred. Medicine (Baltimore) 68 (1): 1-29, 1989.
- Horton WA, Wong V, Eldridge R: Von Hippel-Lindau disease: clinical and pathological manifestations in nine families with 50 affected members. Arch Intern Med 136 (7): 769-77, 1976.
- Neumann HP: Basic criteria for clinical diagnosis and genetic counselling in von Hippel-Lindau syndrome. Vasa 16 (3): 220-6, 1987.
Indicaciones futuras
En la actualidad, las manifestaciones renales de la enfermedad de Von Hippel-Lindau (VHL) por lo general se tratan con un procedimiento quirúrgico o de ablación térmica. Está claro que es necesario mejorar las estrategias de atención y desarrollar un tratamiento sistémico dirigido. Esto incluirá precisar los aspectos moleculares y genéticos de la formación del cáncer de riñón, lo que puede conducir al desarrollo de estrategias para una prevención eficaz o tratamientos de intervención temprana. Además, el avance de la comprensión de las características moleculares de los cánceres de riñón establecidos puede brindar oportunidades para normalizar fenotípicamente el cáncer mediante la modulación de la función residual del gen VHL, la identificación de nuevas dianas terapéuticas y el descubrimiento de estrategias sintéticas letales que permitan erradicar de manera eficaz el carcinoma de células renales.
Actualizaciones más recientes a este resumen (01 / 10 / 2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Este resumen fue objeto de revisión integral.
El
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre la genética de la enfermedad de Von Hippel-Lindau. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Enfermedad de Von Hippel-Lindau son:
- Alexandra Perez Lebensohn, MS, CGC (National Cancer Institute)
- Brian Matthew Shuch, MD (UCLA Health)
- Ramaprasad Srinivasan, MD, PhD (National Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como "En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]".
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre la genética del cáncer. PDQ Enfermedad de Von Hippel-Lindau. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del
Última revisión: 2025-01-10
Esta información no reemplaza el consejo de un médico. Ignite Healthwise, LLC, niega toda garantía y responsabilidad por el uso de esta información. El uso que usted haga de esta información implica que usted acepta los
Healthwise, Healthwise para cada decisión de la salud, y el logo de Healthwise son marcas de fábrica de Ignite Healthwise, LLC.
Page Footer
Quiero...
Audiencia
Sitios seguros para miembros
Información sobre The Cigna Group
Aviso legal
Los planes individuales y familiares de seguro médico y dental están asegurados por Cigna Health and Life Insurance Company (CHLIC), Cigna HealthCare of Arizona, Inc., Cigna HealthCare of Illinois, Inc., Cigna HealthCare of Georgia, Inc., Cigna HealthCare of North Carolina, Inc., Cigna HealthCare of South Carolina, Inc. y Cigna HealthCare of Texas, Inc. Los planes de beneficios de salud y de seguro de salud de grupo están asegurados o administrados por CHLIC, Connecticut General Life Insurance Company (CGLIC) o sus afiliadas (puedes ver
Todas las pólizas de seguros y los planes de beneficios de grupo contienen exclusiones y limitaciones. Para conocer la disponibilidad, los costos y detalles completos de la cobertura, comunícate con un agente autorizado o con un representante de ventas de Cigna. Este sitio web no está dirigido a los residentes de New Mexico.