Comprar planes
Comprar tu propia cobertura
Planes a través de tu empleador
Conoce sobre los beneficios médicos, dentales, de farmacia y voluntarios que tu empleador puede ofrecer.
Aprender
¿Vives o trabajas fuera del país?
Evaluación del riesgo de cáncer y asesoramiento genético (PDQ®) información para profesionales de salud [NCI]
Esta información es producida y suministrada por el Instituto Nacional del Cáncer (NCI, por sus siglas en inglés). La información en este tema puede haber cambiado desde que se escribió. Para la información más actual, comuníquese con el Instituto Nacional del Cáncer a través del Internet en la página web http://cancer.gov o llame al 1-800-4-CANCER.
Resumen
Esta sección es una síntesis de los temas tratados en este resumen del PDQ sobre la evaluación y el asesoramiento del riesgo genético de cáncer; incluye enlaces a las secciones específicas que tratan la evidencia de cada tema.
- Identificación de las personas que reúnen las condiciones para la evaluación y el asesoramiento del riesgo genético de cáncer
Una persona reúne las condiciones para someterse a una evaluación del riesgo de cáncer cuando tiene antecedentes personales o familiares (maternos o paternos) o manifestaciones clínicas compatibles con
características indicativas de un cáncer hereditario . Estas características varían según el tipo de cáncer y síndrome hereditario específico. Se publicaron criterios para ayudar a identificar a las personas que podrían beneficiarse del asesoramiento genético. Es importante que las personas que reúnen las condiciones para someterse a pruebas genéticas reciban educación y asesoramiento genético antes de las pruebas con el fin de facilitar la toma de decisiones fundamentadas y la adaptación al riesgo o la afección. Laeducación y el asesoramiento genético permiten a las personas comprender los riesgos, beneficios y limitaciones de las pruebas genéticas. También les permite considerar las posibles incertidumbres médicas, los diagnósticos de cáncer o el plan de tratamiento médico que acompaña determinados resultados de las pruebas genéticas. - Componentes de la evaluación y el asesoramiento del riesgo genético de cáncer
La
evaluación y el asesoramiento integral del riesgo de cáncer corresponden a un servicio de consulta que abarca la evaluación clínica, las pruebas genéticas indicadas y las recomendaciones de control del riesgo que se proporcionan durante una o más citas de consultas de asesoramiento genético. El asesoramiento genético previo a las pruebas es un componente importante del proceso de evaluación del riesgo y ayuda a los pacientes a comprender las opciones respecto a las pruebas genéticas y los posibles resultados. El asesoramiento genético posterior a las pruebas ayuda a los pacientes a comprender los resultados de sus pruebas, incluso las repercusiones médicas para ellos mismos y sus familiares.La prestación idónea del servicio de evaluación del riesgo de cáncer exige la participación de proveedores de múltiples disciplinas, entre ellos, asesores o consejeros genéticos; profesionales en enfermería de práctica avanzada en genética; genetistas o médicos especialistas (oncólogos, cirujanos o internistas); además, es posible que el paciente se derive a otros especialistas, como profesionales de la salud mental, endocrinólogos y especialistas en reproducción.
Tradicionalmente los
servicios de asesoramiento genético se han prestado en entornos de consultas presenciales personalizadas. No obstante, se están explorando cada vez más otros métodos, como las sesiones grupales, las consultas telefónicas y las consultas de telemedicina por videoconferencia. - Consideraciones sobre las pruebas genéticas
Muchos
factores afectan la decisión personal de someterse a pruebas genéticas y el tipo de prueba a realizar, entre otros, la presencia de unavariante patogénica conocida en la familia , la distribución de los casos de cáncer en la familia, lacobertura del seguro médico , lasconsideraciones de planificación familiar , y las repercusiones psicológicas del resultado de una prueba. En el pasado, la mayoría de las pruebas genéticas de la línea germinal se ofrecían para un gen único por prueba; sin embargo, los avances técnicos recientes han ampliado la disponibilidad deanálisis o paneles multigénicos que permiten examinar de manera simultánea la presencia de variantes patogénicas de muchos genes, a menudo con un costo comparable al de la prueba de gen único.En investigaciones se ha examinado el uso y los resultados de los análisis multigénicos .Algunas de las pruebas genéticas empleadas en oncología también se consiguen como
pruebas dirigidas al consumidor . Si bien estas pruebas quizás promuevan el acceso y la autonomía del paciente, el proceso no siempre incluye asesoramiento genético ni la interpretación de los resultados por parte de un profesional especializado en genética. Además, en ocasiones estas pruebas son incompletas o exigen confirmación con una segunda muestra de DNA que se envía a otro laboratorio clínico.La estrategia de
pruebas genéticas en cascada a veces es eficaz para identificar a los portadores de una variante patogénica antes de que aparezca un cáncer, lo que brinda oportunidades para la prevención del cáncer, la detección temprana, la reducción del riesgo y, en última instancia, para mejorar los desenlaces de salud.Se están utilizando distintos abordajes para la
prestación del servicio de genética del cáncer con el fin de aumentar el acceso al asesoramiento y las pruebas genéticas. Estos abordajes se han utilizado para perfeccionar el proceso por el cual se identifican personas con riesgo alto de cáncer o personas ya afectadas por la enfermedad que se remiten a los servicios especializados de genética para evaluación complementaria. Estos modelos de prestación de servicios varían en cuanto a los procesos que utilizan para la educación, el asesoramiento y las pruebas genéticas. - Implicaciones éticas, legales y sociales
Comprender las
implicaciones éticas, legales y sociales de las pruebas genéticas del cáncer quizás influya en las respuestas del profesional clínico a las preguntas y temas complejos que podrían surgir durante el proceso de evaluación y asesoramiento del riesgo. Hay varios aspectos éticos y legales que afectan las decisiones sobre la responsabilidad de los proveedores de informar de manera directa a los familiares que están en riesgo sobre su riesgo de cáncer hereditario. En esta sección se aborda eldeber de advertir , incluso el marco legal y las directrices de las sociedades profesionales. En ciertas situaciones de comunicación de información, quizás sea necesario consultar con un especialista en ética, un comité de ética, un asesor legal, un funcionario responsable de la privacidad y, cuando corresponda, con un consejo de revisión institucional.La
discriminación laboral y durante el aseguramiento son preocupaciones frecuentes de las personas que piensan someterse a pruebas genéticas. LaLey Antidiscriminatoria sobre Información Genética de 2008 (GINA), una ley federal aprobada en 2008, protege a la mayoría de las personas contra la discriminación basada en la información genética en entornos laborales y de aseguramiento médico; sin embargo, no rige para los miembros de las fuerzas militares ni para las disposiciones de los seguros de atención médica a largo plazo, incapacidad o vida.
Introducción
Este resumen incluye una descripción de los abordajes vigentes para evaluar y asesorar a las personas sobre la posibilidades de que tengan una susceptibilidad hereditaria al cáncer. La
Una persona reúne las condiciones para someterse a una evaluación del riesgo de cáncer cuando tiene antecedentes personales o familiares (en los linajes materno o paterno) y características indicativas de un cáncer hereditario. Estas características varían según el tipo de cáncer y síndrome hereditario específico. Se han publicado recursos prácticos para ayudar a los profesionales clínicos a identificar a las personas que pueden beneficiarse de una evaluación o asesoramiento genéticos. Instituciones, como la National Comprehensive Cancer Network, a menudo actualizan las directrices relacionadas con el asesoramiento genético y las pruebas genéticas.[
Las siguientes características son indicadoras de un cáncer hereditario:[
- Inicio del cáncer a una edad temprana atípica (por ejemplo, cáncer de mama premenopáusico).
- Múltiples cánceres primarios en una persona (por ejemplo, cáncer colorrectal y endometrial).
- Cáncer bilateral en órganos pares o enfermedad multifocal (por ejemplo, cáncer de mama bilateral o cáncer de riñón multifocal).
- Agrupamiento del mismo tipo de cáncer en familiares cercanos (por ejemplo, madre, hija y hermanas afectadas por cáncer de mama).
- Cánceres en varias generaciones de una familia (es decir, herencia autosómica dominante).
- Tumores raros (por ejemplo, retinoblastoma, carcinoma de corteza suprarrenal, tumor de células de la granulosa del ovario, melanoma ocular o cáncer duodenal).
- Cáncer epitelial de ovario, de trompas de Falopio o primario de peritoneo.
- Cáncer con cuadro clínico atípico (por ejemplo, cáncer de mama masculino).
- Tumores de tipos histológicos infrecuentes (por ejemplo, carcinoma medular de tiroides).
- Cánceres raros relacionados con anomalías congénitas (por ejemplo, tumor de Wilms y defectos genitourinarios).
- Poblaciones con un origen geográfico o étnico que se relaciona con un riesgo alto de cánceres hereditarios. Es posible identificar a personas que reúnen las condiciones para someterse a pruebas genéticas solo por su etnia cuando hay un marcado efecto fundador en una población determinada (por ejemplo, ascendencia asquenazí y variantes patogénicas de BRCA1 o BRCA2).
Un componente del proceso de educación y asesoramiento genético es el análisis de la necesidad de pruebas genéticas cuando se cumplen los siguientes requisitos:[
- Antecedentes personales (incluso la etnia) o historia familiar compatibles con una predisposición genética al cáncer.
- Sensibilidad y especificidad de la prueba genética adecuadas para la interpretación.
- Prueba que afectará el diagnóstico, el tratamiento del cáncer o el control del riesgo de cáncer en el paciente, o ayudará a aclarar el riesgo en los familiares del paciente.
Es importante que las personas que reúnen las condiciones para someterse a pruebas genéticas reciban educación y asesoramiento genético antes de las pruebas. Este proceso permite comprender mejor el riesgo de enfermedad y facilita la toma de decisiones fundamentadas.[
Referencias:
- Berliner JL, Cummings SA, Boldt Burnett B, et al.: Risk assessment and genetic counseling for hereditary breast and ovarian cancer syndromes-Practice resource of the National Society of Genetic Counselors. J Genet Couns 30 (2): 342-360, 2021.
- Holter S, Hall MJ, Hampel H, et al.: Risk assessment and genetic counseling for Lynch syndrome - Practice resource of the National Society of Genetic Counselors and the Collaborative Group of the Americas on Inherited Gastrointestinal Cancer. J Genet Couns 31 (3): 568-583, 2022.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 2.2024. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023.
Available online with free registration. Last accessed September 18, 2024. - National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Colorectal. Version 1.2023. Plymouth Meeting, PA: National Comprehensive Cancer Network, 2023.
Available with free registration. Last accessed June 28, 2023. - Hampel H, Bennett RL, Buchanan A, et al.: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 17 (1): 70-87, 2015.
- Bashford MT, Kohlman W, Everett J, et al.: Addendum: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 21 (12): 2844, 2019.
- Tobias DH, Eng C, McCurdy LD, et al.: Founder BRCA 1 and 2 mutations among a consecutive series of Ashkenazi Jewish ovarian cancer patients. Gynecol Oncol 78 (2): 148-51, 2000.
- Beller U, Halle D, Catane R, et al.: High frequency of BRCA1 and BRCA2 germline mutations in Ashkenazi Jewish ovarian cancer patients, regardless of family history. Gynecol Oncol 67 (2): 123-6, 1997.
- Gabai-Kapara E, Lahad A, Kaufman B, et al.: Population-based screening for breast and ovarian cancer risk due to BRCA1 and BRCA2. Proc Natl Acad Sci U S A 111 (39): 14205-10, 2014.
- Randall LM, Pothuri B, Swisher EM, et al.: Multi-disciplinary summit on genetics services for women with gynecologic cancers: A Society of Gynecologic Oncology White Paper. Gynecol Oncol 146 (2): 217-224, 2017.
- Committee on Practice Bulletins–Gynecology, Committee on Genetics, Society of Gynecologic Oncology: Practice Bulletin No 182: Hereditary Breast and Ovarian Cancer Syndrome. Obstet Gynecol 130 (3): e110-e126, 2017.
- Robson ME, Storm CD, Weitzel J, et al.: American Society of Clinical Oncology policy statement update: genetic and genomic testing for cancer susceptibility. J Clin Oncol 28 (5): 893-901, 2010.
- Lancaster JM, Powell CB, Chen LM, et al.: Society of Gynecologic Oncology statement on risk assessment for inherited gynecologic cancer predispositions. Gynecol Oncol 136 (1): 3-7, 2015.
- Robson ME, Bradbury AR, Arun B, et al.: American Society of Clinical Oncology Policy Statement Update: Genetic and Genomic Testing for Cancer Susceptibility. J Clin Oncol 33 (31): 3660-7, 2015.
Identificación de pacientes para derivarlos al asesoramiento genético
Después de recopilar los antecedentes personales y la historia familiar, varios factores podrían justificar la derivación a consulta con un profesional especializado en genética para la evaluación de los síndromes de cáncer hereditario. El American College of Medical Genetics and Genomics (ACMG) y la National Society of Genetic Counselors (NSGC) publicaron en inglés un conjunto exhaustivo de criterios personales y de la historia familiar
Recursos para identificar a los pacientes que se beneficiarían del asesoramiento genético y las pruebas genéticas
Las principales sociedades médicas recomiendan la derivación a los servicios de genética para los pacientes con riesgo moderado o alto de un síndrome de cáncer hereditario. Además de las directrices publicadas por las organizaciones profesionales,[
Muchos de estos instrumentos evalúan características comunes que indican un cáncer hereditario, pero tienen limitaciones. Por ejemplo, la capacidad de los instrumentos para indicar qué personas están en riesgo según criterios amplios es variable, como se describe en las directrices actuales de las sociedades médicas (como, NCCN). Por lo tanto, algunas personas que reúnen las condiciones para recibir asesoramiento genético y someterse a las pruebas genéticas no se detectarán con estos instrumentos. Como por ejemplo personas que, según estos instrumentos de detección, se consideran de riesgo bajo. Debido a la posible utilidad clínica de las pruebas genéticas en estas personas, quizás aún se necesite un juicio clínico para determinar la idoneidad del asesoramiento y las pruebas genéticas. Por lo tanto, todavía se justifica la revisión clínica de la información de los formularios de detección.
Hay otros instrumentos útiles para evaluar el riesgo de ser portador de una variante patogénica específica en un gen de susceptibilidad al cáncer. Para obtener más información en inglés, consultar la sección
Referencias:
- Hampel H, Bennett RL, Buchanan A, et al.: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 17 (1): 70-87, 2015.
- Bashford MT, Kohlman W, Everett J, et al.: Addendum: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 21 (12): 2844, 2019.
- Lancaster JM, Powell CB, Chen LM, et al.: Society of Gynecologic Oncology statement on risk assessment for inherited gynecologic cancer predispositions. Gynecol Oncol 136 (1): 3-7, 2015.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 2.2024. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023.
Available online with free registration. Last accessed September 18, 2024. - National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Colorectal. Version 1.2023. Plymouth Meeting, PA: National Comprehensive Cancer Network, 2023.
Available with free registration. Last accessed June 28, 2023.
Evaluación y asesoramiento del riesgo genético de cáncer
La evaluación integral del riesgo de cáncer es un servicio de consulta que abarca la evaluación clínica, las pruebas genéticas indicadas y las recomendaciones de control del riesgo que se proporcionan durante una o más sesiones de asesoramiento genético. El asesoramiento genético previo a las pruebas es un componente importante del proceso de evaluación del riesgo y ayuda a los pacientes a comprender las opciones respecto a las pruebas genéticas y los posibles resultados. El asesoramiento genético posterior a las pruebas ayuda a los pacientes a comprender los resultados de las pruebas, incluso las repercusiones médicas para ellos mismos y sus familiares.
Las siguientes organizaciones profesionales destacan la importancia del asesoramiento genético como parte de la evaluación del riesgo de cáncer y el proceso de toma de las pruebas genéticas:
- American College of Medical Genetics and Genomics.[
1 ,2 ] - American College of Obstetrics and Gynecology.[
3 ] - American Society of Clinical Oncology.[
4 ] - International Society of Nurses in Genetics.[
5 ,6 ] - National Society of Genetic Counselors.[
7 ,8 ] - National Comprehensive Cancer Network.[
9 ,10 ] - Oncology Nursing Society.[
11 ] - Society of Gynecologic Oncologists.[
12 ,13 ] - U.S. Preventive Services Task Force.[
14 ]
Para obtener una lista en inglés de las organizaciones que han publicado guías de práctica clínica sobre el asesoramiento genético, la evaluación del riesgo, las pruebas genéticas y el tratamiento de los cánceres ginecológicos y el cáncer de mama de origen hereditario, consultar la sección
El asesoramiento genético orienta al consultante sobre el riesgo de cáncer y los posibles beneficios y limitaciones de las pruebas genéticas, además ofrece la oportunidad de analizar las eventuales repercusiones médicas, psicológicas, familiares y sociales de la información genética.[
Asesoramiento genético
La National Society of Genetic Counselors define el asesoramiento genético, o la consejería genética, como el proceso de ayudar a las personas a entender y adaptarse a las repercusiones médicas, psicológicas y familiares del componente genético de una enfermedad, que abarca los siguientes aspectos:[
- La forma en que las enfermedades o afecciones hereditarias podrían afectar a pacientes o familiares del paciente.
- La manera en que la historia familiar y los antecedentes médicos personales podrían repercutir sobre la posibilidad de que aparezca o recidive una enfermedad.
- Cuáles son las pruebas genéticas indicadas para el paciente y cuáles no lo son, además del alcance y las limitaciones de los resultados de estas pruebas.
- Cómo tomar las decisiones mejor fundamentadas sobre las afecciones y el riesgo.
Los elementos centrales de la filosofía y la práctica del asesoramiento genético son los principios de utilización voluntaria de los servicios, toma de decisiones fundamentadas, interés en las dimensiones psicosociales y emocionales del afrontamiento del riesgo genético, y la protección de la confidencialidad y privacidad del paciente. Estos elementos se incorporan al combinar varios aspectos como el fomento de la relación con el paciente y la recopilación de información; la determinación o verificación diagnóstica; la evaluación del riesgo y el cálculo cuantitativo de los riesgos de incidencia o recidiva; los procesos de educación y consentimiento informado; la evaluación psicosocial, el apoyo y el asesoramiento adaptado a la cultura y etnia de la familia; así como otras características relevantes.[
Información previa a las pruebas genéticas y resultados del asesoramiento
El asesoramiento sobre la evaluación del riesgo de cáncer surgió como una práctica especializada que exige conocimiento de genética y oncología, además de habilidades para proporcionar orientación personal y familiar de manera que el servicio puede estar a cargo de profesionales de atención de la salud con formación interdisciplinaria.[
Referencias:
- Hampel H, Bennett RL, Buchanan A, et al.: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 17 (1): 70-87, 2015.
- Bashford MT, Kohlman W, Everett J, et al.: Addendum: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 21 (12): 2844, 2019.
- Committee on Practice Bulletins–Gynecology, Committee on Genetics, Society of Gynecologic Oncology: Practice Bulletin No 182: Hereditary Breast and Ovarian Cancer Syndrome. Obstet Gynecol 130 (3): e110-e126, 2017.
- Robson ME, Bradbury AR, Arun B, et al.: American Society of Clinical Oncology Policy Statement Update: Genetic and Genomic Testing for Cancer Susceptibility. J Clin Oncol 33 (31): 3660-7, 2015.
- International Society of Nurses in Genetics: Provision of Quality Genetic Services and Care: Building a Multidisciplinary, Collaborative Approach among Genetic Nurses and Genetic Counselors. Pittsburgh, Pa: International Society of Nurses in Genetics, 2006.
Available online . Last accessed December 9, 2024. - International Society of Nurses in Genetics: Genetic Counseling for Vulnerable Populations: The Role of Nursing. Pittsburgh, Pa: International Society of Nurses in Genetics, 2010.
Available online . Last accessed December 9, 2024. - Resta R, Biesecker BB, Bennett RL, et al.: A new definition of Genetic Counseling: National Society of Genetic Counselors' Task Force report. J Genet Couns 15 (2): 77-83, 2006.
- Berliner JL, Cummings SA, Boldt Burnett B, et al.: Risk assessment and genetic counseling for hereditary breast and ovarian cancer syndromes-Practice resource of the National Society of Genetic Counselors. J Genet Couns 30 (2): 342-360, 2021.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 2.2024. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023.
Available online with free registration. Last accessed September 18, 2024. - National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Colorectal. Version 1.2023. Plymouth Meeting, PA: National Comprehensive Cancer Network, 2023.
Available with free registration. Last accessed June 28, 2023. - Oncology nursing: the application of cancer genetics and genomics throughout the oncology care continuum. Oncol Nurs Forum 40 (1): 10-1, 2013.
- Lancaster JM, Powell CB, Chen LM, et al.: Society of Gynecologic Oncology statement on risk assessment for inherited gynecologic cancer predispositions. Gynecol Oncol 136 (1): 3-7, 2015.
- Randall LM, Pothuri B, Swisher EM, et al.: Multi-disciplinary summit on genetics services for women with gynecologic cancers: A Society of Gynecologic Oncology White Paper. Gynecol Oncol 146 (2): 217-224, 2017.
- Owens DK, Davidson KW, Krist AH, et al.: Risk Assessment, Genetic Counseling, and Genetic Testing for BRCA-Related Cancer: US Preventive Services Task Force Recommendation Statement. JAMA 322 (7): 652-665, 2019.
- Resta RG: Defining and redefining the scope and goals of genetic counseling. Am J Med Genet C Semin Med Genet 142C (4): 269-75, 2006.
- Accreditation Council for Genetic Counseling: Practice-Based Competencies for Genetic Counselors. Accreditation Council for Genetic Counseling, 2023.
Available online . Last accessed December 9, 2024. - Hirschberg AM, Chan-Smutko G, Pirl WF: Psychiatric implications of cancer genetic testing. Cancer 121 (3): 341-60, 2015.
- Riley BD, Culver JO, Skrzynia C, et al.: Essential elements of genetic cancer risk assessment, counseling, and testing: updated recommendations of the National Society of Genetic Counselors. J Genet Couns 21 (2): 151-61, 2012.
- Burke W, Pinsky LE, Press NA: Categorizing genetic tests to identify their ethical, legal, and social implications. Am J Med Genet 106 (3): 233-40, 2001 Fall.
- Rahm AK, Sukhanova A, Ellis J, et al.: Increasing utilization of cancer genetic counseling services using a patient navigator model. J Genet Couns 16 (2): 171-7, 2007.
- Kentwell M, Dow E, Antill Y, et al.: Mainstreaming cancer genetics: A model integrating germline BRCA testing into routine ovarian cancer clinics. Gynecol Oncol 145 (1): 130-136, 2017.
- Kishan AU, Gomez CL, Dawson NA, et al.: Increasing Appropriate BRCA1/2 Mutation Testing: The Role of Family History Documentation and Genetic Counseling in a Multidisciplinary Clinic. Ann Surg Oncol 23 (Suppl 5): 634-641, 2016.
- Walker AP: The practice of genetic counseling. In: Baker DL, Schuette JL, Uhlmann WR, eds.: A Guide to Genetic Counseling. Wiley-Liss, 1998, pp 1-26.
- Bartels DM, LeRoy BS, Caplan AL, eds.: Prescribing Our Future: Ethical Challenges in Genetic Counseling. Aldine De Gruyter, 1993.
- Kenen RH: Genetic counseling: the development of a new interdisciplinary occupational field. Soc Sci Med 18 (7): 541-9, 1984.
- Kenen RH, Smith AC: Genetic counseling for the next 25 years: models for the future. J Genet Couns 4 (2): 115-24, 1995.
- Biesecker BB: Goals of genetic counseling. Clin Genet 60 (5): 323-30, 2001.
- Weil Jon: Psychosocial Genetic Counseling. Oxford University Press, 2000.
- Freedman AN, Wideroff L, Olson L, et al.: US physicians' attitudes toward genetic testing for cancer susceptibility. Am J Med Genet A 120A (1): 63-71, 2003.
Componentes del proceso de evaluación del riesgo
Esta sección proporciona información general sobre los elementos fundamentales del proceso de evaluación del riesgo de cáncer.
Se han publicado varias guías para profesionales sobre los elementos de la evaluación del riesgo genético de cáncer y el asesoramiento genético correspondiente.[
El proceso de evaluación del riesgo de cáncer y asesoramiento genético comprende una o más consultas y por lo general, abarca los aspectos que se detallan a continuación:
- Evaluación multidimensional detallada de los antecedentes médicos y psicosociales, además de la historia familiar.
- Determinación del riesgo de cáncer o la indicación para realizar las pruebas genéticas a partir de los indicios de un síndrome de cáncer hereditario.
- Educación y asesoramiento sobre el riesgo de cáncer familiar o hereditario.
- De ser apropiado, revisión de las opciones de pruebas genéticas, además de sus limitaciones, riesgos y beneficios.
- Creación de un plan para el control del riesgo de cáncer.
- Análisis del plan de seguimiento, entrega de órdenes de derivación médica y materiales educativos, etc.
Evaluación
En la fase inicial de la primera consulta se deben indagar las percepciones y preocupaciones del consultante sobre el tema del cáncer, además de sus expectativas durante el proceso de evaluación del riesgo de manera que se fomente su participación. Esto permite que el proveedor del servicio esté informado sobre aspectos prácticos o psicosociales y va guiando el asesoramiento y las estrategias de evaluación del riesgo.
Evaluación psicosocial
El proceso de asesoramiento genético que se lleva a cabo durante una evaluación del riesgo de cáncer permite identificar factores que afectan la percepción del consultante sobre el riesgo de cáncer, además de las motivaciones para solicitar la evaluación del riesgo y las pruebas genéticas. También sirve para identificar eventuales problemas psicológicos que quizás deban atenderse durante la consulta o después, en especial, al completar las pruebas genéticas. La información recopilada antes o durante la consulta incluye los siguientes aspectos:
- Motivaciones para solicitar la evaluación del riesgo de cáncer.
- Creencias sobre las causas del cáncer.
- Experiencias con el cáncer y los sentimientos, percepciones, preocupaciones o miedos correspondientes.
- La influencia de las experiencias y percepciones del cáncer en los comportamientos respecto a la salud y en las prácticas de detección sistemática del cáncer.
- Antecedentes culturales, religiosos y socioeconómicos.
- Antecedentes psicológicos generales, como antecedentes de depresión o ansiedad, consumo de medicamentos y tratamientos en curso para enfermedades psiquiátricas.
- Mecanismos de afrontamiento.
- Sistemas de apoyo.
- Las deficiencias cognitivas del consultante quizás limiten la comprensión de la información genética y obstaculicen la capacidad de obtener el consentimiento informado.
- Los patrones de comunicación dentro de la familia, como la cohesión o cercanía de los miembros de la familia (o la falta de ello), y las creencias o valores familiares que afectan los comportamientos de salud. Los factores étnicos y culturales también desempeñan una función importante en dirigir el comportamiento en algunas familias.
- La salud de los familiares (es decir, nuevos diagnósticos de cáncer o muertes por cáncer) y el estado marital (divorciados, casados, en duelo) tal vez indiquen al proveedor el momento oportuno para que la persona participe en el asesoramiento o se haga las pruebas genéticas. Es posible que estos factores también revelen posibles contraindicaciones para las pruebas genéticas en el momento de la consulta de asesoramiento genético del paciente.
Los proveedores de atención de la salud que ofrecen servicios de asesoría sobre el riesgo de cáncer intentan evaluar (solos o mediante interconsulta con un profesional de salud mental) si estos factores son indicadores de un riesgo de resultados psicológicos adversos después de comunicar el riesgo o el estado genético.
Percepción del riesgo
El riesgo percibido cumple una función importante en la decisión personal de participar en el asesoramiento,[
Evaluación clínica
Antecedentes médicos personales
El análisis de los antecedentes médicos del consultante es fundamental durante la evaluación del riesgo de cáncer, sin importar si hay antecedentes personales de cáncer. La información relevante que se obtiene sobre los antecedentes médicos del consultante incluye los siguientes aspectos:[
- Edad.
- Raza, ascendencia y etnia.
- Antecedentes de tumores o pólipos benignos o precancerosos, cirugías, biopsias, enfermedades graves, medicamentos, antecedentes reproductivos (en las mujeres, abarca menarquia, paridad, edad en el momento del nacimiento del primer hijo vivo, edad de la menopausia y de consumo de hormonas exógenas).
- La práctica de detección sistemática hasta el momento y la fecha de los últimos exámenes de detección, entre ellos, imágenes o exámenes físicos.
- Exposiciones ambientales.
- Consumo pasado y actual de bebidas alcohólicas y de tabaco.
- A veces, también se evalúa la alimentación, el ejercicio y el uso de prácticas de la medicina complementaria y alternativa.
En los consultantes que tienen antecedentes de cáncer, también se recaba información sobre los siguientes aspectos:
- Sitio o tipo de la neoplasia maligna primaria y todas las metástasis o recidivas.
- Edad en el momento del diagnóstico.
- Hallazgos patológicos y estadificación.
- Resultados anteriores de pruebas genéticas germinales.
- Resultados anteriores de pruebas tumorales (como un perfil genómico).[
10 ,11 ] Para obtener más información sobre las implicaciones de las pruebas tumorales, consultar la secciónSecuenciación clínica en Aspectos generales de la genética del cáncer. - Tratamientos (por ejemplo, cirugía, quimioterapia, radioterapia y terapia dirigida), y se determina si la evaluación del riesgo genético podría afectar el tratamiento.
- Bilateralidad de la enfermedad, cuando corresponda.
- Plan de vigilancia actual.
- Exposiciones carcinogénicas (por ejemplo, consumo de bebidas alcohólicas y tabaco, exposición solar, exposición a radiación, exposición al amianto) y otros factores de riesgo específicos del sitio del cáncer.
- En ocasiones, se evalúa el método de detección del cáncer (por ejemplo, autoexamen, prueba de detección, sintomatología inicial).
Examen físico
En algunos casos, un examen físico por parte de un profesional médico competente sirve para determinar si el paciente exhibe hallazgos físicos indicadores de un síndrome hereditario de predisposición al cáncer, o para descartar la presencia de una neoplasia maligna actual. Por ejemplo, el profesional médico quizás busque los adenomas sebáceos propios del síndrome de Muir-Torre, mida la circunferencia de la cabeza o examine la piel para identificar características cutáneas benignas asociadas con el síndrome de Cowden. Es posible que también conduzca una exploración clínica de las mamas y los ganglios linfáticos axilares en una mujer que se somete a una evaluación del riesgo de cáncer de mama.
Historia familiar
Registro de la historia familiar
La historia familiar es un instrumento esencial para la evaluación del riesgo de cáncer. Se puede recopilar antes o durante una evaluación clínica o en una entrevista con un profesional clínico. Los instrumentos de recopilación de la historia familiar autoadministrados son una alternativa y pueden mejorar la eficiencia. En un metanálisis de 28 estudios en los que se investigaron 27 instrumentos electrónicos para recabar la historia familiar, se notificó que los pacientes consideraron que estos instrumentos eran adecuados y eficaces (tiempo promedio de cumplimentación, 31 minutos). En este metanálisis también se observó que las tasas de cumplimentación de estos instrumentos eran altas (tasa promedio de cumplimentación, 86 %) y eran más detalladas en comparación con las encuestas en papel y las entrevistas con los profesionales clínicos.[
Los detalles de la historia médica familiar se resumen mejor mediante el uso de un árbol genealógico o genograma. El árbol genealógico es una representación gráfica estandarizada de las relaciones familiares que facilita la identificación de los tipos de transmisión de la enfermedad, el reconocimiento de las características clínicas relacionadas con síndromes de cáncer hereditarios específicos y la determinación de las mejores estrategias e instrumentos para la evaluación del riesgo.[
La National Society of Genetic Counselors (NSGC) publicó los estándares actuales de nomenclatura de árboles genealógicos, que a su vez adoptó la National Comprehensive Cancer Network. Para obtener explicaciones detalladas, análisis y ejemplos de los símbolos de los árboles genealógicos, consultar estas fuentes bibliográficas.[
La documentación completa de la historia familiar de cáncer, por lo general abarca los siguientes aspectos:
- Un árbol genealógico de 3 generaciones con información de por lo menos los familiares de primer y segundo grado del lado materno y paterno. La información de varias generaciones ayuda a corroborar los tipos de herencia. El cáncer hereditario se puede heredar del lado materno o paterno de la familia, incluso en los fenotipos limitados por el sexo (por ejemplo, cáncer de próstata) y aquellos en los que influye el sexo (por ejemplo, cáncer de mama).[
17 ] - Raza, ascendencia y etnia de los abuelos y las abuelas por línea materna y paterna. Esta información quizás afecte las decisiones sobre las pruebas genéticas porque se conocen variantes patogénicas específicas de algunos genes que son más frecuentes en determinadas poblaciones (efecto fundador).[
17 ] - La información de afecciones aparentemente no relacionadas, como anomalías congénitas, tumores cutáneos atípicos y otras afecciones benignas en niños y adultos, a veces facilita el diagnóstico de un síndrome de susceptibilidad al cáncer.
- Anotación de aspectos como una adopción, ausencia de paternidad biológica (en el árbol genealógico se debe incluir la información del padre biológico), consanguinidad y uso de técnicas de reproducción asistida (por ejemplo, donante de óvulos o espermatozoides).
- Distinción entre el género y el sexo en el árbol genealógico si hay discordancia.[
16 ]
Una historia familiar de 3 generaciones abarca los siguientes aspectos:
- Familiares de primer grado (por ejemplo, hijos e hijas; hermanos y hermanas; y progenitores).
- Familiares de segundo grado (por ejemplo, abuelos y abuelas; tíos y tías; sobrinos y sobrinas, nietos y nietas; hermanastros y hermanastras).
- Familiares de tercer grado (por ejemplo, primos hermanos de ambos sexos, tías abuelas y tíos abuelos).
- Se incluye información de otros familiares lejanos, si está disponible, en especial cuando hay antecedentes conocidos de cáncer.
De cada uno de los familiares afectados por cáncer se obtiene la siguiente información:[
- Sitio primario de cada cáncer. Documentación médica de los casos de cáncer más relevantes (por ejemplo, informes patológicos, documentos clínicos y certificados de defunción); esta información es muy importante para la evaluación del riesgo y las recomendaciones de tratamiento.
- Edad en el momento del diagnóstico de cada cáncer primario.
- Lugar donde el familiar recibió el diagnóstico o el tratamiento.
- Antecedentes de cirugía o tratamientos que tal vez redujeron el riesgo de cáncer. Por ejemplo, la salpingooforectomía bilateral en una mujer premenopáusica disminuye de manera significativa el riesgo de cáncer de ovario y de mama. Es posible que esto oculte una predisposición hereditaria subyacente a estos tipos de cáncer.
- Edad actual (si el familiar esta vivo).
- Edad de fallecimiento y causa de muerte (si el familiar ya murió).
- Exposiciones carcinogénicas (por ejemplo, consumo de bebidas alcohólicas y tabaco, exposición solar, exposición a radiación, exposición al amianto) y otros factores de riesgo específicos del sitio del cáncer.
- Resultados anteriores de pruebas genéticas de la línea germinal.
- Otros problemas de salud importantes.
- Para obtener más información, consultar la sección
Exactitud de la historia familiar .
De cada uno de los familiares no afectados por cáncer, se obtiene la siguiente información:
- Edad actual o edad de fallecimiento.
- Causa de muerte (si el familiar falleció).
- Antecedentes de cirugías o tratamientos que tal vez redujeron el riesgo de cáncer.
- Práctica de detección sistemática del cáncer.
- Cualquier característica benigna relacionada con el síndrome en estudio.
- Exposiciones carcinogénicas (por ejemplo, consumo de bebidas alcohólicas y tabaco, exposición solar, exposición a radiación, exposición al amianto) y otros factores de riesgo específicos del sitio del cáncer.
- Resultados anteriores de pruebas genéticas de la línea germinal.
- Resultados anteriores de pruebas tumorales (como un perfil genómico).
- Otros problemas de salud importantes.
Exactitud de la historia familiar
La exactitud de la historia familiar afecta de manera directa el diagnóstico diferencial, la selección de las pruebas pertinentes, la interpretación de los resultados de las pruebas genéticas, el ajuste de las estimaciones individuales del riesgo de cáncer y las recomendaciones para la detección sistemática y la reducción del riesgo. A menudo, las personas tienen información incompleta o inexacta sobre los antecedentes de cáncer en su familias.[
Las historias familiares obtenidas por autonotificación a veces contienen errores y en escasas ocasiones, son falsas.[
Determinación del riesgo de cáncer
Análisis de la historia familiar
El análisis del árbol genealógico es un aspecto esencial de la evaluación del riesgo de cáncer, debido a que la historia familiar de cáncer es uno de los predictores más importantes de este riesgo. Este análisis se plantea mediante una serie de preguntas como las que siguen:
-
¿Cuál es la evidencia que indica la presencia de un síndrome de susceptibilidad al cáncer en esta familia? -
Si se sospecha la presencia de un síndrome, ¿cuál es el diagnóstico diferencial? -
¿Qué aspectos dificultan la interpretación de la historia familiar? -
¿Cuál es el modo de herencia más probable del síndrome de cáncer hereditario? -
¿Cuál es el riesgo de presentar cáncer en cada miembro de la familia cuando hay una susceptibilidad hereditaria? -
Si no se identifica un síndrome de cáncer hereditario, ¿cuál es el riesgo individual de cáncer a partir de otros factores de riesgo epidemiológicos?
- ¿Cuál es la evidencia que indica la presencia de un síndrome de susceptibilidad al cáncer en esta familia?
Los síndromes de cáncer hereditario se identifican mediante el análisis del árbol genealógico y los hallazgos físicos. El índice de sospecha aumenta cuando se presentan las siguientes características:[
17 ]- Múltiples casos de cáncer en familiares cercanos, en especial, en varias generaciones.
- Inicio del cáncer a una edad temprana (menores de 40 a 50 años para los cánceres de inicio en la edad adulta).
- Múltiples cánceres primarios en la misma persona.
- Cánceres bilaterales.
- Identificación de asociaciones conocidas entre tipos de cáncer con vínculo etiológico dentro de la familia (por ejemplo, cáncer de mama y de ovario; cáncer de colon y de endometrio).
- Presencia de anomalías congénitas o lesiones precursoras que se sabe acarrean aumento del riesgo de cáncer (por ejemplo, presencia de nevos atípicos y riesgo de melanoma maligno).
- Modo de herencia mendeliano reconocible.
- Tipos específicos de tumores o enfermedades asociadas con variantes patogénicas germinales en genes de susceptibilidad al cáncer, con independencia de la historia familiar (por ejemplo, cáncer de ovario, cáncer medular de tiroides, cáncer de mama triple negativo y tumores de cordón sexual en el cáncer de ovario). Para obtener más información en inglés sobre estos tipos de tumores, consultar
Genetics of Breast and Gynecologic Cancers yGenetics of Endocrine and Neuroendocrine Neoplasias . - Los resultados anormales de las pruebas tumorales de colon o endometrio que notifican inestabilidad microsatelital o resultados anormales de inmunohistoquímica son indicadores de síndrome de Lynch. Para obtener más información en inglés, consultar la sección
Genetics of Lynch syndrome en Genetics of Colorectal Cancer. - Variantes somáticas identificadas mediante perfil genómico tumoral que quizás también estén en la línea germinal.
Las características clínicas asociadas con los diferentes síndromes genéticos de cáncer se resumen en el conjunto exhaustivo de criterios personales y de la historia familiar publicado en inglés
A practice guidelines: referral indications for cancer predisposition assessment por el American College of Medical Genetics and Genomics (ACMG) y la National Society of Genetic Counselors (NSGC).[32 ] Esta guía práctica incluye los tipos de tumor, además de otras características y criterios relacionados que justifican la derivación a una consulta de genética. El ACMG y la NSGC señalan que la guía pretende optimizar la derivación a consultas de genética oncológica para las personas en riesgo alto, pero no incluye recomendaciones sobre las pruebas genéticas ni el tratamiento. Sin embargo, estas instituciones también señalan la importancia de consultar otras guías que se actualizan con más frecuencia, como la de la National Comprehensive Cancer Network.[33 ] - Si se sospecha la presencia de un síndrome, ¿cuál es el diagnóstico diferencial?
La indicación más frecuente para someterse al asesoramiento genético u obtener pruebas genéticas es la sospecha de síndromes hereditarios de cáncer de mama o de cáncer de colon.
Para el cáncer de mama hereditario, el asesoramiento genético y los criterios para las pruebas son amplios.[
10 ,32 ] Los análisis multigénicos han revelado variantes patogénicas en muchos otros genes de penetrancia moderada o alta, diferentes a los genes BRCA1 y BRCA2, que también producen este fenotipo, como PALB2, CHEK2 y ATM.El diagnóstico diferencial de los síndromes de cáncer de colon hereditario se fundamenta en varios factores, como el número de pólipos colorrectales, el tipo de pólipos, las características histopatológicas de las neoplasias malignas gastrointestinales y otros tipos histológicos de neoplasias malignas.[
34 ,35 ] Sin embargo, cuando no hay poliposis ni resultados patológicos infrecuentes, el síndrome de Lynch a menudo figura en la lista de diagnóstico diferencial. A veces también se incluye en la lista de diagnóstico diferencial cuando hay casos de cáncer de mama o de ovario en la familia que no son compatibles con el cáncer de mama y de ovario hereditarios.[36 ,37 ] Para obtener más información en inglés, consultar la secciónLynch syndrome en Genetics of Colorectal Cancer.Están disponibles criterios y pruebas diagnósticas para varios síndromes raros. Para obtener más información en inglés, consultar
Li-Fraumeni syndrome ,[38 ]Cowden syndrome ,[39 ,40 ]multiple endocrine neoplasias [41 ] yfamilial adenomatous polyposis .[10 ,34 ] En algunos casos, las características patognomónicas son indicadores de síndromes de cáncer poco frecuentes.[39 ,40 ]A partir de estas consideraciones, las opciones de pruebas genéticas abarcan pruebas dirigidas a las variantes patogénicas en uno o varios genes, o en un grupo de genes más amplio.
- ¿Qué aspectos dificultan la interpretación de la historia familiar?
Otros factores pueden complicar la identificación de los patrones de herencia básicos o expliquen diferentes tipos de causas de enfermedad.[
42 ,43 ,44 ]A continuación se describen ejemplos comunes de factores que complican la estructura de la historia familiar:
- Familia pequeña.
- Información incompleta por desconocimiento de la historia familiar (por ejemplo, adopción o falta de información sobre los casos de cáncer en familiares).
- Desequilibrio por sexo (por ejemplo, pocas mujeres en una familia con presunto cáncer de mama hereditario).
- Muertes a edades muy tempranas.
- Extracción del órgano de riesgo, ya sea por reducción del riesgo o por una afección (por ejemplo, una histerectomía por antecedentes de fibromas uterinos o endometriosis quizás dificulte la identificación del síndrome de Lynch).
- Parentesco erróneo.
- Consanguinidad.
A continuación se describen factores genéticos que tal vez afecten la interpretación de la historia familiar:
- Inicio variable o tardío de la enfermedad.
- Ausencia de penetrancia.
- Expresión variable.
- Heterogeneidad genética.
- Variantes patogénicas de novo (nueva).
- Mosaicismo (somático o de la línea germinal).
- ¿Cuál es el modo de herencia más probable del síndrome de cáncer hereditario?
El modo de herencia se refiere a la manera en que se transmiten los rasgos genéticos en una familia.
El modo de herencia por lo general se identifica cuando se determina el diagnóstico clínico de un paciente y se encuentra una distribución compatible en el árbol genealógico, aunque esta no siempre es concluyente.[
45 ] Los síndromes hereditarios de cáncer más conocidos presentan herencia autosómica dominante o autosómica recesiva. Los indicios que permiten reconocer esta distribución en un árbol genealógico se describen a continuación.Herencia autosómica dominante
- La herencia autosómica dominante se refiere a los trastornos que se expresan en personas heterocigotas (por ejemplo, la persona afectada tiene una copia de una variante patogénica y una copia normal del gen. Los principales síndromes hereditarios de cáncer de mama o cáncer ginecológico y cáncer de colon se heredan de modo autosómico dominante. Estos incluyen los síndromes de BRCA1 y BRCA2, Li-Fraumeni, Cowden y Lynch. Para obtener más información sobre estos síndromes en inglés, consultar
BRCA1- and BRCA2-associated hereditary breast and gynecologic cancers ,Li-Fraumeni syndrome ,Cowden syndrome yLynch syndrome . La herencia autosómica dominante se caracteriza por los siguientes aspectos:- Incidencia vertical (por ejemplo, presencia de tipos de cáncer asociados con síndromes en generaciones sucesivas).
- Tipos de cáncer asociados con síndromes identificados solo en un lado de la familia (es decir, monoparental, de origen materno o paterno).
- Las personas de ambos sexos pueden heredar el trastorno y transmitirlo a su descendencia.
- En ocasiones, se observa transmisión de hombre a hombre.
- La descendencia tiene una probabilidad del 50 % de heredar la variante patogénica y una probabilidad del 50 % de heredar la copia normal del gen.
- La afección a veces parece que salta una generación por varios motivos, entre otros: penetrancia incompleta, muerte temprana, inicio de la enfermedad a una edad tardía, o pocos casos de hombres o mujeres afectados cuando el órgano de riesgo es específico según el sexo (por ejemplo, próstata u ovario).
- Es posible que una persona tenga una variante patogénica nueva. Esta persona sería el primer miembro de su familia afectado y podría transmitir esta variante patogénica a su descendencia de una manera autosómica dominante.
- Una persona puede presentar variantes patogénicas en más de un gen asociado con síndromes de predisposición al cáncer de herencia autosómica dominante. En las familias con fenotipos indicadores de más de un tipo de síndrome de cáncer hereditario, la identificación de múltiples variantes patogénicas ayuda a explicar de mejor manera antecedentes personales o familiares complejos de cáncer. Además, es útil cuando se quiere determinar la estrategia más adecuada para obtener pruebas en otros familiares.[
46 ]
Herencia autosómica recesiva
- En la herencia autosómica recesiva, una persona afectada debe ser homocigota (es decir, debe portar 2 copias de una variante patogénica porque hereda 1 copia de la variante patogénica de cada progenitor). Los síndromes de susceptibilidad al cáncer bien definidos con patrones de herencia autosómica recesiva son el
síndrome de Bloom , la ataxia-telangiectasia, la poliposis asociada a MUTYH y la anemia de Fanconi. Para obtener información en inglés sobre estos síndromes, consultarataxia telangiectasia ,MUTYH-associated polyposis yFanconi anemia . La herencia autosómica recesiva se caracteriza por los siguientes aspectos:- Incidencia horizontal (es decir, los tipos de cáncer asociados a síndromes solo afectan una generación; se encuentran casos en hermanos o hermanas, y los progenitores no están afectados. Por lo general no se observan casos en generaciones sucesivas.
- Las variantes patogénicas se heredan de ambos lados de la familia (es decir, herencia biparental).
- Los progenitores son portadores heterocigotos; cada progenitor porta una variante patogénica y una copia funcional del gen.
- Los progenitores por lo general no expresan las características asociadas con la variante patogénica que portan; en algunos casos, los progenitores manifiestan una versión leve o algunas de las características, pero no todas.
- Cuando los 2 progenitores son heterocigotos, hay un riesgo del 25 % de que los descendientes estén afectados.
Herencia compleja
- La mayoría de los cánceres, y la mayoría de los cánceres familiares tienen un origen complejo. En el entorno clínico es común que se obtengan resultados negativos o no informativos de las pruebas genéticas. Múltiples factores contribuyen a la formación de los casos de cáncer, y es difícil delimitar dichos factores.
- La herencia compleja o multifactorial de enfermedades se usa para describir las afecciones causadas por una combinación de factores genéticos y ambientales. Al contrario de las enfermedades mendelianas en las que el hecho de portar una variante patogénica se relaciona con una probabilidad alta de aparición de la enfermedad, la causa de las enfermedades complejas o multifactoriales se debe a la interacción entre los factores génicos y ambientales. Por lo tanto, un único locus genético no explica la afección. En la mayoría de los casos, los efectos combinados de los factores genéticos, de estilo de vida y ambientales determinan la probabilidad de que una persona presente una afección, como el cáncer.
El agrupamiento de los casos de cáncer en familiares es común. Sin embargo, es difícil separar las causas subyacentes del agrupamiento de casos cuando no se observa un patrón de distribución específico para el cáncer en una familia. Es posible que personas con neoplasias malignas comunes, como el cáncer de pulmón, tengan muchos familiares afectados por cáncer. Se cree que estas agregaciones familiares se deben a una combinación de los siguientes factores: exposiciones a carcinógenos conocidos (como el humo del tabaco), variantes patogénicas en genes de penetrancia alta que conllevan riesgo alto de cáncer y alteraciones en genes de penetrancia baja que afectan el metabolismo de los carcinógenos.[
47 ]Es probable que el médico general se encuentre con algunas familias que tienen una predisposición genética fuerte al cáncer. Reconocer esta susceptibilidad individual podría conllevar repercusiones drásticas en la atención médica de cada persona. Aunque se conocen algunas variantes patogénicas de riesgo alto en los principales genes de susceptibilidad al cáncer que son congruentes con modelos de herencia mendeliana reconocibles, estos síndromes son raros.
- La herencia autosómica dominante se refiere a los trastornos que se expresan en personas heterocigotas (por ejemplo, la persona afectada tiene una copia de una variante patogénica y una copia normal del gen. Los principales síndromes hereditarios de cáncer de mama o cáncer ginecológico y cáncer de colon se heredan de modo autosómico dominante. Estos incluyen los síndromes de BRCA1 y BRCA2, Li-Fraumeni, Cowden y Lynch. Para obtener más información sobre estos síndromes en inglés, consultar
- ¿Cuál es el riesgo de presentar cáncer en cada miembro de la familia cuando hay una susceptibilidad hereditaria?
La probabilidad varía según el síndrome, la familia, el gen y la variante patogénica. Diferentes variantes patogénicas del mismo gen confieren distintos riesgos de cáncer, o la misma variante patogénica se asocia con manifestaciones clínicas distintas en familias diferentes. Muchos de estos escenarios se atribuyen a factores como la penetrancia y la expresividad. Para obtener más información en inglés, consultar la sección
Penetrance of Inherited Susceptibility to Hereditary Breast and/or Gynecologic Cancers en Genetics of Breast and Gynecologic Cancers. - Si no se identifica un síndrome de cáncer hereditario, ¿cuál es el riesgo individual de cáncer a partir de otros factores de riesgo epidemiológicos?
Los antecedentes de cáncer en la historia familiar a veces brindan información sobre el riesgo de cáncer aunque no se identifique un síndrome de cáncer hereditario. Por ejemplo, el riesgo de tener un familiar afectado por cáncer de mama o cáncer colorrectal se puede calcular a partir de información epidemiológica y estudios familiares. Para obtener más información en inglés, consultar
Genetics of Breast and Gynecologic Cancers yGenetics of Colorectal Cancer .
Métodos de cuantificación del riesgo de cáncer
El objetivo general de la evaluación del riesgo de cáncer es personalizar las recomendaciones de control del riesgo de cáncer a partir del riesgo individual. Los métodos para calcular el riesgo emplean la información de los antecedentes médicos, los factores de riesgo y la historia familiar, a menudo en combinación con la evidencia emergente sobre los aspectos biológicos, genéticos y genómicos, de manera que se emiten predicciones.[
Riesgo de albergar una variante patogénica de un gen de susceptibilidad al cáncer
La decisión de ofrecer pruebas genéticas para determinar la susceptibilidad al cáncer es compleja y es posible respaldarla, por lo menos en parte, por la evaluación objetiva de la probabilidad individual o familiar de albergar una variante patogénica.[
Si se sospecha la presencia de un gen o síndrome de cáncer hereditario, es posible emplear modelos específicos para el síndrome con el fin de determinar si se necesitan pruebas genéticas. Los modelos específicos y los datos de prevalencia son más efectivos cuando se aplican a las poblaciones más idóneas. Por ejemplo, el uso de un modelo o de datos de prevalencia de un estudio poblacional de personas mayores de 35 años quizás no resulte exacto para una población de 35 años o menos. Se debe tener precaución al interpretar los datos obtenidos de varios modelos de riesgo porque difieren en relación con la estimación específica. Algunos modelos permiten estimar el riesgo de que una variante patogénica esté presente en una familia; otros modelos permiten estimar el riesgo de que una variante patogénica esté presente en la persona que recibe el asesoramiento. Algunos modelos permiten estimar el riesgo de formación de tipos específicos de cáncer en una persona, mientras que otros modelos permiten estimar el riesgo de más de uno de los aspectos mencionados. Otras consideraciones importantes incluyen configuraciones familiares críticas, que a veces afectan de manera significativa la confiabilidad del modelo, como es una familia pequeña, familias en las que predominan los varones cuando el riesgo de cáncer tiene un origen predominantemente femenino, adopción o muertes tempranas por otras causas.[
Para obtener más información sobre los modelos específicos para síndromes, consultar los resúmenes que se indican a continuación:
-
Genética del cáncer de piel
Los siguientes resúmenes solo están disponibles en inglés:
-
Genetics of Breast and Gynecologic Cancers
-
Genetics of Colorectal Cancer
Cuando se identifica una variante patogénica en una familia y el informe de una prueba permite documentar ese hallazgo, las probabilidades previas se pueden constatar con un mayor grado de confiabilidad. En este contexto, las probabilidades se calculan a partir del modelo de herencia asociado con el gen en donde se identificó la variante patogénica. Además, otro aspecto crítico para la aplicación de la herencia mendeliana es la consideración de la integración del teorema de Bayes, que incluye otras variables, como la edad actual, en el cálculo de una probabilidad posterior más exacta.[
Incluso cuando se ha documentado una variante patogénica en un lado de la familia, es esencial analizar muy bien los antecedentes personales y la historia familiar de cáncer con el fin de descartar un riesgo de cáncer o la sospecha de una variante patogénica en un gen de susceptibilidad al cáncer en el otro lado de la familia (materna o paterna, si corresponde).[
Riesgo de cáncer
A diferencia de los modelos de probabilidad para una variante patogénica que predicen la probabilidad de que un antecedente de cáncer personal o de la historia familiar esté asociado con una variante patogénica en uno o varios genes específicos, se usan otros métodos y modelos para estimar el riesgo de presentar cáncer con el tiempo. De manera similar a la evaluación de la probabilidad de una variante patogénica, el cálculo del riesgo de cáncer también es complejo y exige antecedentes médicos completos y una historia familiar detallada. Cuando se documenta la presencia de una variante patogénica, las estimaciones del riesgo de cáncer se pueden obtener usando datos de penetrancia revisados por expertos. Los datos de penetrancia se están refinando constantemente, además muchas variantes genéticas exhiben una penetrancia desigual porque hay otras variables que afectan el riesgo absoluto de cáncer en un determinado paciente. Los modificadores del riesgo de cáncer en portadores de variantes patogénicas incluyen el efecto de la variante en la función de la proteína o el gen (por ejemplo, tipo de variante y posición), la contribución de los genes modificadores, y los factores personales y ambientales (por ejemplo, efecto de una salpingooforectomía bilateral por otra indicación en una mujer portadora de una variante patogénica de BRCA).[
Hay varios métodos para estimar el riesgo de cáncer cuando no hay indicios de un síndrome de cáncer hereditario. La información del riesgo relativo que se obtiene de los estudios sobre factores de riesgo específicos proporciona cocientes de los casos observados versus los casos previstos vinculados con un factor de riesgo determinado. Sin embargo, el uso de información de riesgo relativo para la evaluación del riesgo personalizada acarrea limitaciones importantes: el cálculo del riesgo relativo cambia según el tipo de grupo de control y otros sesgos del estudio, además, la comparabilidad entre estudios varía mucho.[
A pesar de estas limitaciones, las estimaciones del riesgo acumulado específico por enfermedad son las más usadas en el ámbito clínico. Estas estimaciones por lo general proporcionan un riesgo para un intervalo de tiempo dado y se pueden presentar con el riesgo acumulado de otras afecciones en una población determinada (por ejemplo, el riesgo a 5 años según el modelo de Gail).[
Las estimaciones del riesgo acumulado son más útiles cuando se ha descartado la presencia subyacente de otros factores de riesgo significativos. La evaluación minuciosa de los antecedentes personales y la historia familiar permite identificar otros factores de riesgo que producen confusión y que a veces pesan más que la estimación del riesgo obtenida con los modelos de riesgo acumulado. Por ejemplo, una mujer con antecedente de una biopsia que indicó un carcinoma lobulillar in situ (CLIS) y cuya madre recibió un diagnóstico de cáncer de mama a los 65 años, tiene un riesgo de por vida más alto debido al antecedente de CLIS en comparación con el riesgo de por vida de cáncer de mama calculado a partir del antecedente en un familiar de primer grado.[
En resumen, la verificación y revisión minuciosas de los antecedentes médicos personales y la historia familiar de cáncer son complementos fundamentales de los ya mencionados modelos de probabilidad y de evaluación del riesgo de cáncer, con el fin de asegurar que se incluyan los elementos críticos que afectan el cálculo del riesgo.[
- Diagnóstico diferencial compatible con los antecedentes personales y la historia familiar de cáncer.
- Consideración de los factores que afectan la calidad de la información obtenida de la historia familiar.
- Población más idónea para emplear el modelo.
- Características específicas del tumor que a veces generan sospecha de una predisposición hereditaria o modifican las predicciones individuales del riesgo de cáncer.
- Limitaciones específicas del modelo que subestiman o sobrestiman el cálculo.[
43 ]
Varios investigadores están creando herramientas para facilitar la toma de decisiones dirigidas a proveedores de atención de la salud como la Genetic Risk Assessment on the Internet with Decision Support (GRAIDS),[
Referencias:
- Robson ME, Bradbury AR, Arun B, et al.: American Society of Clinical Oncology Policy Statement Update: Genetic and Genomic Testing for Cancer Susceptibility. J Clin Oncol 33 (31): 3660-7, 2015.
- Berliner JL, Cummings SA, Boldt Burnett B, et al.: Risk assessment and genetic counseling for hereditary breast and ovarian cancer syndromes-Practice resource of the National Society of Genetic Counselors. J Genet Couns 30 (2): 342-360, 2021.
- Holter S, Hall MJ, Hampel H, et al.: Risk assessment and genetic counseling for Lynch syndrome - Practice resource of the National Society of Genetic Counselors and the Collaborative Group of the Americas on Inherited Gastrointestinal Cancer. J Genet Couns 31 (3): 568-583, 2022.
- Lancaster JM, Powell CB, Chen LM, et al.: Society of Gynecologic Oncology statement on risk assessment for inherited gynecologic cancer predispositions. Gynecol Oncol 136 (1): 3-7, 2015.
- Committee on Practice Bulletins–Gynecology, Committee on Genetics, Society of Gynecologic Oncology: Practice Bulletin No 182: Hereditary Breast and Ovarian Cancer Syndrome. Obstet Gynecol 130 (3): e110-e126, 2017.
- Rimer BK, Schildkraut JM, Lerman C, et al.: Participation in a women's breast cancer risk counseling trial. Who participates? Who declines? High Risk Breast Cancer Consortium. Cancer 77 (11): 2348-55, 1996.
- Evans DG, Burnell LD, Hopwood P, et al.: Perception of risk in women with a family history of breast cancer. Br J Cancer 67 (3): 612-4, 1993.
- Kash KM, Holland JC, Halper MS, et al.: Psychological distress and surveillance behaviors of women with a family history of breast cancer. J Natl Cancer Inst 84 (1): 24-30, 1992.
- Davis S, Stewart S, Bloom J: Increasing the accuracy of perceived breast cancer risk: results from a randomized trial with Cancer Information Service callers. Prev Med 39 (1): 64-73, 2004.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 2.2024. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023.
Available online with free registration. Last accessed September 18, 2024. - Kuzbari Z, Bandlamudi C, Loveday C, et al.: Germline-focused analysis of tumour-detected variants in 49,264 cancer patients: ESMO Precision Medicine Working Group recommendations. Ann Oncol 34 (3): 215-227, 2023.
- Li X, Kahn RM, Wing N, et al.: Leveraging Health Information Technology to Collect Family Cancer History: A Systematic Review and Meta-Analysis. JCO Clin Cancer Inform 5: 775-788, 2021.
- Tehranifar P, Wu HC, Shriver T, et al.: Validation of family cancer history data in high-risk families: the influence of cancer site, ethnicity, kinship degree, and multiple family reporters. Am J Epidemiol 181 (3): 204-12, 2015.
- Bennett RL, Steinhaus KA, Uhrich SB, et al.: Recommendations for standardized human pedigree nomenclature. Pedigree Standardization Task Force of the National Society of Genetic Counselors. Am J Hum Genet 56 (3): 745-52, 1995.
- Bennett RL, French KS, Resta RG, et al.: Standardized human pedigree nomenclature: update and assessment of the recommendations of the National Society of Genetic Counselors. J Genet Couns 17 (5): 424-33, 2008.
- Bennett RL, French KS, Resta RG, et al.: Practice resource-focused revision: Standardized pedigree nomenclature update centered on sex and gender inclusivity: A practice resource of the National Society of Genetic Counselors. J Genet Couns 31 (6): 1238-1248, 2022.
- Lu KH, Wood ME, Daniels M, et al.: American Society of Clinical Oncology Expert Statement: collection and use of a cancer family history for oncology providers. J Clin Oncol 32 (8): 833-40, 2014.
- Schneider K: Collection and interpretation of cancer histories. In: Schneider KA: Counseling About Cancer: Strategies for Genetic Counseling. 2nd ed. Wiley-Liss, 2002, pp 129-166.
- Mitchell RJ, Brewster D, Campbell H, et al.: Accuracy of reporting of family history of colorectal cancer. Gut 53 (2): 291-5, 2004.
- Schneider KA, DiGianni LM, Patenaude AF, et al.: Accuracy of cancer family histories: comparison of two breast cancer syndromes. Genet Test 8 (3): 222-8, 2004.
- Douglas FS, O'Dair LC, Robinson M, et al.: The accuracy of diagnoses as reported in families with cancer: a retrospective study. J Med Genet 36 (4): 309-12, 1999.
- Sijmons RH, Boonstra AE, Reefhuis J, et al.: Accuracy of family history of cancer: clinical genetic implications. Eur J Hum Genet 8 (3): 181-6, 2000.
- Mai PL, Garceau AO, Graubard BI, et al.: Confirmation of family cancer history reported in a population-based survey. J Natl Cancer Inst 103 (10): 788-97, 2011.
- Ozanne EM, O'Connell A, Bouzan C, et al.: Bias in the reporting of family history: implications for clinical care. J Genet Couns 21 (4): 547-56, 2012.
- Brennan P, Claber O, Brennan T: Cancer family history triage: a key step in the decision to offer screening and genetic testing. Fam Cancer 12 (3): 497-502, 2013.
- Krakow M, Rising CJ, Trivedi N, et al.: Prevalence and Correlates of Family Cancer History Knowledge and Communication Among US Adults. Prev Chronic Dis 17: E146, 2020.
- Qureshi N, Wilson B, Santaguida P, et al.: Collection and Use of Cancer Family History in Primary Care. Evidence Report/Technology Assessment No. 159. Agency for Healthcare Research and Quality, 2007. AHRQ Pub No. 08-E001.
- Murff HJ, Spigel DR, Syngal S: Does this patient have a family history of cancer? An evidence-based analysis of the accuracy of family cancer history. JAMA 292 (12): 1480-9, 2004.
- John EM, Canchola AJ, Sangaramoorthy M, et al.: Race/Ethnicity and Accuracy of Self-Reported Female First-Degree Family History of Breast and Other Cancers in the Northern California Breast Cancer Family Registry. Cancer Epidemiol Biomarkers Prev 28 (11): 1792-1801, 2019.
- Evans DG, Kerr B, Cade D, et al.: Fictitious breast cancer family history. Lancet 348 (9033): 1034, 1996.
- Beadles CA, Ryanne Wu R, Himmel T, et al.: Providing patient education: impact on quantity and quality of family health history collection. Fam Cancer 13 (2): 325-32, 2014.
- Hampel H, Bennett RL, Buchanan A, et al.: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 17 (1): 70-87, 2015.
- Bashford MT, Kohlman W, Everett J, et al.: Addendum: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 21 (12): 2844, 2019.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Colorectal. Version 1.2023. Plymouth Meeting, PA: National Comprehensive Cancer Network, 2023.
Available with free registration. Last accessed June 28, 2023. - Spoto CPE, Gullo I, Carneiro F, et al.: Hereditary gastrointestinal carcinomas and their precursors: An algorithm for genetic testing. Semin Diagn Pathol 35 (3): 170-183, 2018.
- Roberts ME, Jackson SA, Susswein LR, et al.: MSH6 and PMS2 germ-line pathogenic variants implicated in Lynch syndrome are associated with breast cancer. Genet Med 20 (10): 1167-1174, 2018.
- Espenschied CR, LaDuca H, Li S, et al.: Multigene Panel Testing Provides a New Perspective on Lynch Syndrome. J Clin Oncol 35 (22): 2568-2575, 2017.
- Bougeard G, Renaux-Petel M, Flaman JM, et al.: Revisiting Li-Fraumeni Syndrome From TP53 Mutation Carriers. J Clin Oncol 33 (21): 2345-52, 2015.
- Pilarski R, Eng C: Will the real Cowden syndrome please stand up (again)? Expanding mutational and clinical spectra of the PTEN hamartoma tumour syndrome. J Med Genet 41 (5): 323-6, 2004.
- Eng C: PTEN Hamartoma Tumor Syndrome (PHTS). In: Adam MP, Feldman J, Mirzaa GM, et al., eds.: GeneReviews. University of Washington, Seattle, 1993-2024, pp.
Available online . Last accessed November 13, 2024. - Brandi ML, Gagel RF, Angeli A, et al.: Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab 86 (12): 5658-71, 2001.
- Weitzel JN, Lagos VI, Cullinane CA, et al.: Limited family structure and BRCA gene mutation status in single cases of breast cancer. JAMA 297 (23): 2587-95, 2007.
- Kauff ND, Offit K: Modeling genetic risk of breast cancer. JAMA 297 (23): 2637-9, 2007.
- Kramer JL, Velazquez IA, Chen BE, et al.: Prophylactic oophorectomy reduces breast cancer penetrance during prospective, long-term follow-up of BRCA1 mutation carriers. J Clin Oncol 23 (34): 8629-35, 2005.
- Harper PS: Practical Genetic Counselling. 3rd ed. Wright, 1988.
- Whitworth J, Skytte AB, Sunde L, et al.: Multilocus Inherited Neoplasia Alleles Syndrome: A Case Series and Review. JAMA Oncol 2 (3): 373-9, 2016.
- Stratton MR: Exploring the genomes of cancer cells: progress and promise. Science 331 (6024): 1553-8, 2011.
- Freedman AN, Seminara D, Gail MH, et al.: Cancer risk prediction models: a workshop on development, evaluation, and application. J Natl Cancer Inst 97 (10): 715-23, 2005.
- Lindor NM, Lindor RA, Apicella C, et al.: Predicting BRCA1 and BRCA2 gene mutation carriers: comparison of LAMBDA, BRCAPRO, Myriad II, and modified Couch models. Fam Cancer 6 (4): 473-82, 2007.
- Domchek SM, Eisen A, Calzone K, et al.: Application of breast cancer risk prediction models in clinical practice. J Clin Oncol 21 (4): 593-601, 2003.
- Riley BD, Culver JO, Skrzynia C, et al.: Essential elements of genetic cancer risk assessment, counseling, and testing: updated recommendations of the National Society of Genetic Counselors. J Genet Couns 21 (2): 151-61, 2012.
- Offit K, Brown K: Quantitating familial cancer risk: a resource for clinical oncologists. J Clin Oncol 12 (8): 1724-36, 1994.
- Apicella C, Andrews L, Hodgson SV, et al.: Log odds of carrying an Ancestral Mutation in BRCA1 or BRCA2 for a Defined personal and family history in an Ashkenazi Jewish woman (LAMBDA). Breast Cancer Res 5 (6): R206-16, 2003.
- Chenevix-Trench G, Milne RL, Antoniou AC, et al.: An international initiative to identify genetic modifiers of cancer risk in BRCA1 and BRCA2 mutation carriers: the Consortium of Investigators of Modifiers of BRCA1 and BRCA2 (CIMBA). Breast Cancer Res 9 (2): 104, 2007.
- Hoskins KF, Stopfer JE, Calzone KA, et al.: Assessment and counseling for women with a family history of breast cancer. A guide for clinicians. JAMA 273 (7): 577-85, 1995.
- Adams-Campbell LL, Makambi KH, Palmer JR, et al.: Diagnostic accuracy of the Gail model in the Black Women's Health Study. Breast J 13 (4): 332-6, 2007 Jul-Aug.
- Fisher ER, Land SR, Fisher B, et al.: Pathologic findings from the National Surgical Adjuvant Breast and Bowel Project: twelve-year observations concerning lobular carcinoma in situ. Cancer 100 (2): 238-44, 2004.
- Chuba PJ, Hamre MR, Yap J, et al.: Bilateral risk for subsequent breast cancer after lobular carcinoma-in-situ: analysis of surveillance, epidemiology, and end results data. J Clin Oncol 23 (24): 5534-41, 2005.
- Emery J, Morris H, Goodchild R, et al.: The GRAIDS Trial: a cluster randomised controlled trial of computer decision support for the management of familial cancer risk in primary care. Br J Cancer 97 (4): 486-93, 2007.
Pruebas genéticas
Factores a considerar al ofrecer pruebas genéticas
Indicaciones para las pruebas
Los expertos recomiendan ofrecer pruebas genéticas cuando la evaluación del riesgo indica un presunto síndrome de cáncer hereditario para el que se han identificado genes específicos. En la declaración de política de la American Society of Clinical Oncology (ASCO) sobre pruebas genéticas para la susceptibilidad al cáncer se recomienda ofrecer las pruebas genéticas cuando se cumplen las siguientes condiciones:[
- Persona con antecedentes personales o familiares indicadores de un síndrome de susceptibilidad genética al cáncer.
- Resultados de las pruebas que son interpretables.
- Resultados de las pruebas que repercutirán en la atención médica.
Las características que se usan para tomar esta decisión se analizan en los resúmenes del PDQ sobre las características genéticas de tipos específicos de cáncer. Incluso cuando las características individuales y familiares indican un presunto síndrome de cáncer hereditario, es posible que las personas decidan rechazar las pruebas después de analizar los riesgos, beneficios y limitaciones descritas antes. Por el contrario, las personas con un árbol genealógico incompleto o no informativo debido a una familia muy pequeña, muertes tempranas o falta de información de familiares clave, quizás decidan someterse a pruebas genéticas con el fin de definir mejor su riesgo. En estos casos, es muy importante que durante el asesoramiento previo a las pruebas se analicen todas las limitaciones del proceso de las pruebas.
En las declaraciones de política de la ASCO en 2010 y 2015, se abordó el tema de las pruebas de genes de penetrancia baja a moderada y de las pruebas dirigidas al consumidor.[
La posición de la ASCO es que, cuando un profesional de la salud ordena una prueba, con independencia de la utilidad clínica, el profesional es responsable de planificar el seguimiento según los resultados. En el caso de las pruebas que obtiene un consumidor sin intervención de un profesional de la salud, las decisiones de atención se fundamentan en la evidencia de utilidad clínica. Para las pruebas con utilidad clínica aceptada, la atención de seguimiento se puede orientar a partir de la evidencia para el riesgo de cáncer asociado con el resultado de la prueba genética. Sin embargo, cuando las pruebas obtenidas por un consumidor tienen utilidad clínica dudosa, la ASCO recomienda que la atención de seguimiento incluya educación acerca de la falta de evidencia de la utilidad clínica de la prueba, y que las decisiones sobre el control del riesgo de cáncer se deben guiar por factores de riesgo de cáncer ya establecidos.[
En 2015, la ASCO actualizó su política para incluir los problemas derivados del uso de las nuevas técnicas en la genética del cáncer, entre ellas los análisis o paneles multigénicos de susceptibilidad genética al cáncer, además de los hallazgos imprevistos en la línea germinal derivados de un perfil de mutaciones somáticas.[
Los abordajes de educación y asesoramiento genético (incluso la interpretación de los resultados de las pruebas genéticas), serán diferentes si se han obtenido antes pruebas genéticas. Para obtener más información, consultar la
- Familias con indicios de una susceptibilidad hereditaria que no se han sometido a pruebas genéticas o en donde no se ha identificado una variante patogénica en las pruebas.
- Familias con una variante patogénica documentada.
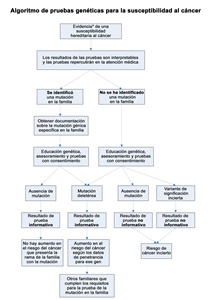
La importancia de iniciar las pruebas en un familiar afectado
Las pruebas de susceptibilidad genética por lo general proveen la información más útil cuando primero se hace la prueba en un miembro de la familia que tiene el cáncer en estudio antes que en otros familiares; esto sirve para determinar si hay un origen genético del cáncer. Si las pruebas se aplazan mientras está pendiente el seguimiento de un familiar afectado, se debe ofrecer una orientación provisional para el control del riesgo de cáncer en el probando no afectado.[
- Se detecta una variante patogénica.
- No se detecta una variante.
- Se detecta una variante de significación incierta (VSI).
Si se identifica una variante patogénica documentada (asociada al riesgo de cáncer), el riesgo se basa en los datos de penetrancia para las variantes patogénicas de ese gen específico. Además, es posible obtener pruebas en otros familiares para determinar la presencia o la ausencia de la variante patogénica específica. Si no se encuentra una variante en el familiar afectado, la prueba se considera no informativa y no hay fundamento para hacer pruebas a los familiares no afectados. El fracaso del laboratorio para detectar una variante patogénica en el familiar afectado no descarta la presencia de una base hereditaria del cáncer en esa familia. Los motivos por los que las pruebas a veces no son informativas incluyen los siguientes:
- El cáncer en la familia quizás se relacione con un gen de susceptibilidad al cáncer diferente al que se buscó con la prueba.
- Es posible que el cáncer en la familia se asocie con una variante patogénica, pero el tipo específico de cáncer en el familiar afectado que se hizo la prueba no se asocia con esa variante. Esto a veces ocurre, en especial, para tipos de cáncer que son comunes en la población general, por ejemplo el cáncer de mama o de próstata. Se considera que el familiar afectado por la enfermedad pero que no es portador de una variante patogénica asociada con la predisposición al cáncer en la familia presenta una fenocopia.
- Quizás no sea posible identificar una variante genética debido a la baja sensibilidad de las técnicas de laboratorio usadas para detectar las variantes genéticas. Es posible que existan otras pruebas disponibles para detectar ciertos tipos de variantes omitidas en la prueba genética inicial.
- La función del gen quizás está alterada por una variante patogénica de otro gen.
Por último, la prueba quizás indique la presencia de una VSI. Este resultado indica que se encontró una variante genética de la que no se conoce el grado de aumento del riesgo de cáncer o es dudoso su vínculo con la historia de cáncer en la familia. En estos casos, es posible obtener indicios del significado de una variante a partir de los siguientes aspectos:
- Ubicación de la variante en relación con las regiones y funciones de un gen.
- El cambio específico; muchas variantes son variantes de cambio de sentido de manera que no todas las sustituciones de aminoácidos son tan significativas.
- Si la variante se encontró al mismo tiempo que una variante patogénica documentada.
- Si la variante se relaciona con la rama de la familia afectada por cáncer o si la variante se alinea con los cánceres de la familia.
Desafortunadamente, incluso con esta información, a menudo la evidencia es insuficiente para documentar la importancia de una variante específica y se necesita más investigación para aclarar este aspecto.
Si no hay un familiar vivo cercano afectado que pueda someterse a pruebas, o si el familiar afectado rehúsa someterse a las pruebas, tal vez se analicen otras opciones con el paciente y el laboratorio. En escasas ocasiones, siempre y cuando se obtenga la autorización de la familia, es posible hacer pruebas en el tejido almacenado de un familiar fallecido. Sin embargo, las pruebas en tejido almacenado son más difíciles desde el punto de vista técnico y quizás no produzcan resultados definitivos. Por lo tanto, a veces se obtienen las primeras pruebas en una persona no afectada antes de hacer las pruebas en el familiar afectado. En estos casos, el asesoramiento incluye la explicación de que un resultado negativo en una prueba no descarta la presencia de un gen de susceptibilidad al cáncer en la familia ni en el paciente, y que quizás la prueba no sea informativa.
Pruebas en familias con una variante patogénica documentada
Las pruebas genéticas para una variante patogénica familiar documentada pueden ser informativas y producirán uno de los siguientes resultados (para obtener más información, consultar la
- Resultado positivo para la variante patogénica familiar.
- Resultado negativo para la variante patogénica familiar.
Si la variante patogénica familiar se detecta en un familiar del paciente, el riesgo de cáncer se basa en los datos de penetrancia de las variantes patogénicas en ese gen específico. Si la variante patogénica documentada no se encuentra en un familiar, el riesgo de cáncer en esa persona es equivalente al riesgo de cáncer en la población general. Sin embargo, otros factores de riesgo y la historia familiar del lado de la familia no asociada con la variante patogénica documentada quizás aumenten el riesgo de cáncer por encima del nivel de la población general.
En resumen, la educación genética y el asesoramiento incluyen la identificación de la persona más informativa en la familia con el fin de someterla a pruebas. Esta persona quizás sea un familiar afectado en lugar de la persona que solicitó la consulta genética. Además, el asesoramiento incluye una conversación sobre las limitaciones de las pruebas, los posibles resultados de las pruebas y las consecuencias de identificar una VSI.[
Cobertura del seguro médico
La cobertura del seguro varía para las pruebas de susceptibilidad al cáncer, entre ellas, los análisis multigénicos. En general, la mayoría de las personas que cumplen con los criterios específicos (por ejemplo, registrados en la guías de la National Comprehensive Cancer Network [NCCN] para las pruebas de BRCA1 o BRCA2 o del síndrome de Lynch) logran obtener la cobertura del seguro para los análisis multigénicos.[
La Ley del Cuidado de Salud a Bajo Precio (ACA) exige que las compañías aseguradoras privadas cubran —sin costo directo para el asegurado— el asesoramiento genético y las pruebas de BRCA1 o BRCA2 en mujeres no afectadas que cumplan con los criterios de las guías de la United States Preventive Services Task Force.[
Pruebas genéticas y técnicas de reproducción asistida
Hay riesgo de que los portadores de variantes patogénicas asociadas con cáncer la transmitan a su descendencia. Cuando una persona obtiene un resultado positivo para una variante patogénica en un gen de susceptibilidad al cáncer, el asesoramiento sobre las implicaciones reproductivas aborda no solo el riesgo relacionado con la herencia autosómica dominante, sino también el riesgo de tener un hijo con 2 variantes patogénicas en el mismo gen (bialélico) lo que conllevaría una afección grave.
Hay técnicas de reproducción asistida que se pueden usar para las pruebas genéticas preimplantacionales y para obtener muestras prenatales (muestreo de vellosidades coriónicas y amniocentesis), con el fin de hacer pruebas genéticas de predisposición al cáncer.[
En algunos casos (por ejemplo, portadores de variantes germinales patogénicas en ATM o BLM), se indica que cada miembro de la pareja se someta a evaluación del riesgo de ser portador de una variante patogénica asociada con un síndrome de herencia dominante o recesiva (es decir, antecedentes personales, historia familia y etnia). En el caso improbable de que ambos progenitores sean heterocigotos para variantes patogénicas específicas, hay un 25 % de riesgo de que un hijo o hija sea homocigoto y manifieste un fenotipo grave. A la luz de esta información, es posible que las parejas consideren realizar pruebas genéticas preimplantacionales o prenatales.
Un marco analítico propuesto para el asesoramiento de los portadores sobre las opciones de reproducción incluye la consideración de los siguientes aspectos:[
- ¿El síndrome de cáncer incluye neoplasias malignas infantiles, causa morbilidad significativa o mortalidad a edad temprana?
- ¿Cuál es la penetrancia de la variante genética?
- ¿Qué tan grave es el fenotipo del síndrome?
- ¿Hay intervenciones para disminuir el riesgo de cáncer asociado con la variante patogénica, o intervenciones de utilidad comprobada para la detección temprana de un cáncer cuando es tratable?
- ¿Hay alguna evidencia de diferencias en el fenotipo si una persona es portadora heterocigota u homocigota?[
12 ,13 ]
En un estudio de 320 pacientes con diferentes síndromes de cáncer hereditario, la mayoría desconocía la posibilidad de obtener pruebas genéticas preimplantacionales; sin embargo, la mayoría expresó interés en aprender más sobre la disponibilidad de estas pruebas.[
Determinación de la prueba a utilizar
Las pruebas genéticas son muy especializadas. Hay varios métodos para obtener pruebas moleculares, cada uno con sus propias indicaciones, costos, fortalezas y debilidades. Según el método usado y la extensión del análisis, diferentes pruebas para el mismo gen producen grados variables de sensibilidad y especificidad. Incluso cuando se asume una validez analítica alta, la heterogeneidad genética dificulta la selección. Es posible que diferentes síndromes genéticos den origen a un tipo de cáncer en particular. Por ejemplo, la causa del cáncer colorrectal hereditario puede ser una poliposis adenomatosa familiar (PAF), el síndrome de Lynch, el síndrome de Peutz-Jeghers, el síndrome de poliposis juvenil y otros síndromes. Cada uno tiene un origen genético diferente. Además, es posible que genes diferentes causen la misma afección (por ejemplo, la causa del síndrome de Lynch son variantes patogénicas en uno de varios genes de reparación de los errores de emparejamiento [MMR]).
En algunos genes, la misma variante patogénica se ha encontrado en múltiples familias aparentemente no relacionadas entre sí. Esta observación es congruente con un efecto fundador, donde una variante patogénica identificada en una población contemporánea se puede rastrear hasta localizar un grupo pequeño de fundadores agrupados en un área geográfica, cultural o por otros factores. Por ejemplo, se ha notificado que 2 variantes patogénicas específicas de BRCA1 (68_69delAG y 5266dup, que también se conocen como 185delAG y 5382insC) y una variante patogénica de BRCA2 (5946delT, que también se conoce como 6174delT) son frecuentes en Ashkenazi Jews. También se han notificado otros genes con variantes patogénicas con efecto fundador. La presencia de variantes patogénicas con efecto fundador tiene implicaciones prácticas para las pruebas genéticas. Muchos laboratorios ofrecen pruebas diseñadas de manera específica para detectar alelos relacionados con una etnia determinada. Esto simplifica mucho los aspectos técnicos de las pruebas pero no está exento de limitaciones. Por ejemplo, cerca del 15 % de las variantes patogénicas de BRCA1 y BRCA2 que se presentan en personas asquenazíes son variantes patogénicas sin efecto fundador.[
La heterogeneidad alélica (es decir, variantes diferentes en el mismo gen) puede conferir diferentes grados de riesgo o asociarse con fenotipos diferentes. Por ejemplo, aunque la regla general es que las variantes patogénicas del gen APC se asocien con cientos a miles de pólipos colónicos y cáncer de colon en el síndrome de PAF clásico, algunas variantes patogénicas del gen APC causan un cuadro clínico más leve, con menos pólipos y menor riesgo de cáncer colorrectal.[
Debido a que los síndromes de cáncer hereditario exhiben diversas presentaciones clínicas y fenotipos que se superponen, la selección de las pruebas genéticas adecuadas exige conocimiento de los siguientes aspectos:
- Síndromes genéticos.
- Métodos diagnósticos para la identificación de variantes patogénicas.
- Correlaciones entre los hallazgos clínicos y de las pruebas moleculares.
- Información sobre las opciones de pruebas genéticas que evolucionan con rapidez.
Para obtener más información, consultar los resúmenes que se indican a continuación:
-
Genética del cáncer de piel -
Genética del carcinoma de células renales
Los siguientes resúmenes solo están disponibles en inglés:
-
Genetics of Breast and Gynecologic Cancers -
Genetics of Colorectal Cancer -
Genetics of Endocrine and Neuroendocrine Neoplasias -
Genetics of Prostate Cancer
Análisis multigénicos
La secuenciación de última generación (NGS) y la eliminación de la mayoría de las barreras de patente para el diagnóstico mediante secuenciación del DNA[
Información y asesoramiento genético para los análisis multigénicos
La ASCO ha destacado la importancia del asesoramiento genético para garantizar que los pacientes obtengan suficiente información sobre las implicaciones de este tipo de pruebas y recomienda que sean profesionales expertos en genética del cáncer quienes ordenen las pruebas.[
| Tema | Pruebas genéticas tradicionales para el cáncer en la línea germinal | Análisis multigénico para el cáncer en la línea germinal |
|---|---|---|
| a Adaptación de Robson et al.[ |
||
| Información del gen | Genes o variantes de genes específicos que se están analizando. | A veces es necesario hacer una revisión agrupada de los genes incluidos en el análisis multigénico porque no es posible cubrir cada gen de forma independiente. |
| Riesgo de cada gen o variante, y sus implicaciones para la atención de la salud. | Explicar cuáles son los genes de penetrancia alta y los síndromes incluidos en el análisis multigénico (por ejemplo, síndrome de cáncer de mama y ovario hereditario, síndrome de Lynch, cáncer gástrico difuso hereditario, síndrome de Li-Fraumeni). También se debe explicar a los pacientes la posible detección de mutaciones que no se sospechan por la historia familiar y los antecedentes personales, además de las implicaciones generales para la atención de la salud. | |
| Descripción general sobre los genes de utilidad clínica indeterminada. | ||
| Posibles resultados de las pruebas | • Se detecta una variante patogénica. | |
| • No se detecta una variante. | ||
| • Se detecta una variante de significado incierto. | ||
| Variante en un gen que se corresponde con alguna de las siguientes opciones: | ||
| • Evidencia limitada de penetrancia. | ||
| • Hallazgos discordantes (variante patogénica identificada en un gen que no es compatible con la historia familiar o los antecedentes del paciente). | ||
| Tasa elevada de variante de significado incierto. | ||
| Riesgos, beneficios y limitaciones de las pruebas genéticas | Implicaciones psicosociales de los resultados de las pruebas. | |
| Consideraciones de confidencialidad, como la privacidad, la seguridad de los datos y la ubicación de los resultados (por ejemplo, historia clínica digital). | ||
| Uso de muestras deDNApara futuras investigaciones. | ||
| Riesgos y protecciones contra la discriminación laboral y durante el aseguramiento. | ||
| Costos de las pruebas y alcance de la cobertura del seguro, si corresponde. | ||
| Si el profesional de la salud experto en genética es empleado por la compañía que hace las pruebas. | ||
| Implicaciones de las pruebas genéticas para los familiares | Modo de transmisión de la variante y riesgo de herencia en la descendencia y en otros familiares. | |
| Importancia de compartir los resultados de las pruebas con los familiares. | ||
| Posibles implicaciones reproductivas relacionadas con variantes patogénicas en genes vinculados con afecciones de herencia recesiva (por ejemplo,ATM, anemia de Fanconi [BRCA2,PALB2],NBN,BLM). | ||
| Uso de los resultados de las pruebas genéticas | Implicaciones de los resultados de las pruebas genéticas en la atención de la salud. | |
Investigación de los análisis multigénicos
Está surgiendo una variedad de resultados de los análisis multigénicos de NGS a partir de los datos de series clínicas y de laboratorio. Varios de los estudios son colaboraciones que abarcan series clínicas y de laboratorio. A continuación, se registran algunas advertencias importantes de la investigación sobre los análisis multigénicos que se ha llevado a cabo hasta ahora:
- Los estudios difieren en sus objetivos, abordajes, determinación de los participantes y análisis utilizados.
- Es probable que los estudios clínicos y de laboratorio difieran respecto al muestreo (población estudiada y sus características). Por ejemplo, algunos estudios abarcan pruebas solicitadas por una amplia variedad de profesionales de la salud, algunos de ellos con menos experiencia en la selección, análisis y orientación de pacientes con riesgo alto.[
22 ] - Las metodologías de prueba también difieren entre los laboratorios en cuanto a la cobertura de exones e intrones, la profundidad de lectura, la confirmación de la secuenciación de Sanger y la interpretación de la variante.[
23 ] - Los genes que se examinan en los análisis multigénicos cambian constantemente. En algunos estudios, la composición de los análisis multigénicos cambió durante el curso del estudio, por lo general para incluir más genes.[
24 ] - Algunas poblaciones abarcaron una mezcla de pacientes que ya se habían sometido a pruebas con los métodos tradicionales de un solo gen, y otros que se sometieron a pruebas por primera vez, lo que dificultó el cálculo del rendimiento diagnóstico verdadero.[
25 ,26 ] - En los estudios en los que se usó el análisis multigénico para repetir pruebas de BRCA anteriores, la validez analítica del análisis multigénico de NGS fue equivalente a las pruebas de un solo gen; se obtuvo casi el 100 % de concordancia en los pacientes que se sometieron a ambas pruebas de BRCA, monogénicas y multigénicas.[
25 ,26 ]
En personas de riesgo alto que cumplen los criterios para someterse a pruebas genéticas de cáncer hereditario, pero en las que no se identificaron variantes patogénicas en las pruebas de un solo gen, es posible que se identifiquen otras variantes con aplicabilidad clínica en el análisis multigénico.[
En algunos informes de 2014 a 2018 con 1000 a 10 000 personas sometidas a pruebas, se observó un cambio en las tasas de variantes patógenas y VSI.[
En un gran estudio publicado por un laboratorio comercial participaron más de 252 000 personas que se sometieron a pruebas con un análisis de 25 genes entre 2013 y 2016.[
Resultados de los análisis multigénicos
Los resultados de los análisis multigénicos tienen varios desenlaces posibles, como se explica a continuación:[
- No se detectan variantes.
- Se detecta una VSI.
- Se detecta una variante patogénica en un gen de penetrancia alta concordante con los antecedentes personales o familiares (por ejemplo, una variante patogénica germinal en MSH2 en una persona que cumple con los criterios de Ámsterdam para síndrome de Lynch. Para obtener más información en inglés, consultar
MSH2 ). - Se detecta una variante patogénica en un gen de penetrancia alta discordante con los antecedentes personales o familiares (por ejemplo, una variante patogénica germinal en CDH1 en una persona sin antecedentes personales ni familiares de cáncer gástrico. Para obtener más información en inglés, consultar
CDH1 ). - Se detecta una variante patogénica en un gen de penetrancia moderada (por ejemplo CHEK2 o ATM. Para obtener más información en inglés, consultar
CHEK2 oATM ). - Se detecta una variante patogénica en un gen para el que no se ha determinado el riesgo o asociación con cáncer.
A veces, los resultados revelan más de un hallazgo debido a que se analizan múltiples genes al mismo tiempo y la tasa de VSI es alta.[
Consideraciones al realizar análisis multigénicos
El empleo de análisis multigénicos es complejo. No obstante, este abordaje ofrece ventajas con respecto a las estrategias de pruebas secuenciales. Por ejemplo, en algunos tipos de cáncer, varios genes se relacionan con fenotipos específicos; por lo tanto, las pruebas simultáneas en todos los genes vinculados con un fenotipo determinado ahorran tiempo y dinero.[
Sin embargo, a veces hay dificultades cuando se usa esta estrategia de análisis. Los laboratorios clínicos ahora ofrecen una diversidad de análisis de genes de susceptibilidad al cáncer.[
Los proveedores que determinan la estrategia para las pruebas genéticas de un paciente quizás también deban considerar los siguientes desafíos: el costo a cargo del paciente y el costo general, el reembolso del seguro por la prueba genética, el tiempo promedio que toma la prueba, la conveniencia del laboratorio para ordenar la prueba, la probabilidad de identificar una VSI y el abordaje de estos resultados (el proceso para reclasificar la VSI y el acceso a otra información sobre la variante), las diferencias técnicas entre pruebas genéticas (como la determinación de la presencia de una deleción o duplicación), la preferencia del paciente y los antecedentes clínicos del paciente.[
Las guías prácticas para el uso clínico óptimo de las pruebas multigénicas siguen evolucionando.[
Otra consideración importante es que los análisis multigénicos a veces incluyen genes que presentan variantes patogénicas con penetrancia moderada o incierta. La atención de las personas con variantes patogénicas en estos genes quizás acarree otras dificultades, en particular cuando no hay recomendaciones de consenso de expertos ni basadas en la evidencia. Para obtener más información sobre la penetrancia moderada y baja, consultar la
Regulación de las pruebas genéticas
La regulación gubernamental de las pruebas genéticas hasta la fecha sigue siendo muy limitada en términos de validez analítica y clínica, con poca coordinación entre las instituciones.[
En cuanto a la validez analítica, las pruebas genéticas se clasifican en 2 categorías principales; los kits de pruebas y las pruebas desarrolladas en el laboratorio (conocidas también como, home brews). Los kits de pruebas se fabrican para su uso en los laboratorios que ofrecen la prueba e incluyen todos los reactivos necesarios para completar el análisis, las instrucciones, los resultados de rendimiento y la información sobre las variantes genéticas que detectan. La Administración de Alimentos y Medicamentos (FDA) regula los kits de pruebas como dispositivos médicos; sin embargo, a pesar de que hay más de 1000 pruebas genéticas, la FDA ha aprobado menos de 10 kits de pruebas.[
Además de la regulación de las pruebas genéticas clásicas del ámbito clínico, hay supervisión reglamentaria de las pruebas genéticas para investigación. Los laboratorios que realizan pruebas genéticas con fines de investigación están exentos de la supervisión de las CLIA si el laboratorio no notifica resultados específicos de pacientes que se usen para el diagnóstico, la prevención o el tratamiento de enfermedades, y si tampoco notifican la alteración o el estado de salud de pacientes individuales.[
La evidencia sobre las implicaciones de esta escasa supervisión reglamentaria de las pruebas genéticas es limitada y se ha obtenido en su mayor parte de las respuestas de los directores de laboratorio a encuestas de garantía de calidad. En una encuesta a 133 directores de laboratorios de pruebas genéticas, se encontró que el 88 % de los laboratorios empleaban a uno o más genetistas profesionales certificados por la American Board of Medical Genetics (ABMG) o aptos según la ABMG, y un 23 % tenían una afiliación con por lo menos un genetista con formación de doctorado. El 8 % de los laboratorios no empleaban ni tenían afiliación con profesionales expertos en genética con formación de doctorado. El 70 % de los laboratorios realizaban pruebas desarrolladas en el laboratorio. El 63 % de los laboratorios proporcionaban una interpretación del resultado de la prueba como parte del informe.[
La razón más frecuente citada para la falta de participación en la verificación de competencias fue la falta de disponibilidad de este tipo de programas. Los directores de laboratorio calcularon que en los 2 años previos, un 37 % emitió 3 o menos informes incorrectos, y un 35 % emitió al menos 4 informes incorrectos. Los errores analíticos, como el uso de un reactivo defectuoso, un fallo del equipo o un error humano, aumentaron en un 40 % con cada disminución en el nivel de capacitación de competencias completado.[
El Department of Health and Human Services Secretary's Advisory Committee on Genetics, Health, and Society de los EE. UU. publicó un informe detallado sobre la idoneidad y transparencia del sistema de supervisión actual de pruebas genéticas en los Estados Unidos.[
- Normativa que rija la calidad de los laboratorios clínicos.
- Supervisión de la validez clínica de las pruebas genéticas.
- Número e identificación de los laboratorios que realizan pruebas genéticas y las pruebas genéticas específicas que ofrecen.
- Grado de conocimiento actual sobre la utilidad de las pruebas genéticas en el ámbito clínico.
- Formación en genética para los proveedores de atención de la salud, la comunidad del ámbito de la salud pública, los pacientes y los consumidores.
En octubre de 2014, la FDA anunció planes para elaborar un documento de orientación sobre la regulación de las pruebas desarrolladas en el laboratorio.[
Pruebas genéticas dirigidas al consumidor
La mayoría de las pruebas genéticas para determinar el riesgo de cáncer y de otros riesgos para la salud las solicita un proveedor de atención de la salud como parte de la atención en función de los antecedentes personales, la historia familiar o la etnia del paciente. Sin embargo, cada vez es más frecuente que las personas puedan ordenar pruebas genéticas de manera directa a las empresas que ofrecen pruebas dirigidas al consumidor sin la intervención de proveedores de atención médica. Las pruebas dirigidas al consumidor a veces proporcionan información sobre la ascendencia, la paternidad, la propensión a ciertos rasgos físicos, el riesgo de reacciones farmacológicas adversas y el riesgo de enfermedad.
Genotipado para definir el estado de portador y el riesgo de enfermedad
En 2015, la FDA autorizó a una gran empresa de pruebas dirigidas al consumidor (23andMe) a comercializar un examen de detección para portadores de síndrome de Bloom, que se vincula con aumento del riesgo de cáncer en homocigotos, así como otras características fenotípicas. Para obtener más información en inglés, consultar la siguiente
Genotipado de variantes patogénicas deBRCA1yBRCA2
En 2023, la FDA autorizó que 23andMe empezara a vender una prueba que incluyó 44 variantes patogénicas en BRCA1 y BRCA2, incluso las 3 variantes patogénicas fundadoras de BRCA1 y BRCA2 que se identifican generalmente en personas de ascendencia judía asquenazí.[
Es crucial que las personas que obtienen un resultado positivo para BRCA1 o BRCA2 (o cualquier otro resultado afín) en las pruebas dirigidas al consumidor busquen confirmación clínica de dicho resultado. La confirmación clínica implica repetir la prueba en un laboratorio certificado según las
Una ventaja potencial de las pruebas dirigidas al consumidor para estas variantes patogénicas de BRCA1 o BRCA2 es que identificará a las personas que de otra manera no se hubieran percatado del aumento del riesgo de cáncer correspondiente, por ejemplo, si no tienen historia familiar de cáncer de mama, ovario o próstata. Este es uno de los principales argumentos para plantear la detección sistemática poblacional de las variantes patogénicas de BRCA1 o BRCA2.
Sin embargo, un resultado negativo no excluye otros factores hereditarios ni explica otros indicadores clínicos, genéticos y de otro tipo, que acarrean un aumento del riesgo de cáncer. Por lo tanto, para la mayoría de las personas que obtienen un resultado negativo en las pruebas para las 3 variantes de BRCA1 o BRCA2, los resultados no proporcionan tranquilidad sobre su riesgo de cáncer. En las personas de riesgo alto, en especial (aquellos con antecedentes indicativos de cáncer de mama y ovario hereditario), el resultado negativo de esta prueba limitada es incompleto, porque no evalúa la presencia o ausencia de otras variantes patogénicas en BRCA1 o BRCA2, ni en muchos otros genes relacionados con el cáncer.
Pruebas clínicas dirigidas al consumidor
El término pruebas clínicas directas o dirigidas al consumidor se usa para describir un abordaje híbrido de pruebas genéticas, en el que un consumidor selecciona y solicita una prueba genética propia del ámbito clínico; sin embargo, es necesario que un proveedor autorizado (por ejemplo, proveedor de atención primaria, profesional de enfermería de práctica avanzada o asesor genético) ordene la prueba.[
Con respecto a las pruebas genéticas del cáncer, hay laboratorios clínicos certificados según las CLIA que ofrecen análisis multigénicos como un servicio dirigido al consumidor. Los factores a considerar cuando se ordena una prueba genética de esta manera son los siguientes:
- ¿Es la misma prueba que habría ordenado el proveedor de atención de la salud después de la revisión de la historia familiar y los antecedentes personales?
Es posible que los análisis multigénicos no incluyan todos los genes de riesgo alto a moderado del diagnóstico diferencial, ni genes más nuevos o que apenas cuentan con evidencia preliminar.
- ¿Se notifican al consumidor las variantes de significado incierto y se vuelve a contactar a la persona si se reclasifican las variantes?
Esta es una pregunta importante que se debe formular antes de obtener la prueba.
- ¿Cuál es el costo de las pruebas?
Es posible que el seguro pague por las pruebas, sobre todo, de las personas que cumplen los criterios para obtenerlas, mientras que el consumidor es responsable del costo de las pruebas dirigidas al consumidor. Sin embargo, en el caso de personas que no cumplen con los criterios para las pruebas o cuando el seguro no las cubre, el costo de las pruebas dirigidas al consumidor tal vez no sea más alto que el costo directo de las pruebas solicitadas a raíz del asesoramiento genético previo a las pruebas.
Algunas compañías de seguros exigen que los pacientes se sometan a un asesoramiento genético previo a las pruebas por parte de un proveedor especializado en genética autorizado (y que cumplan con unos criterios de selección específicos) para que se cubra el costo de la prueba. Por lo tanto, este requisito no aplica a las pruebas dirigidas al consumidor.
Pruebas para variantes de un solo nucleótido
Las empresas de pruebas dirigidas al consumidor ofrecen pruebas de variantes de un solo nucleótido (SNV) para brindar información sobre los riesgos para la salud, incluso los riesgos de cáncer. La selección de las SNV se basa en datos de los estudios de asociación del genoma completo (GWAS). Sin embargo, no hay un algoritmo validado en el que se indique cómo calcular el riesgo de cáncer a partir de diferentes SNV, que por lo general de manera individual producen un aumento moderado del riesgo de enfermedad (a menudo, cocientes de probabilidades <2,0) o una disminución moderada del riesgo de enfermedad.[
En múltiples estudios se encontró que las pruebas de SNV no se validaron como un instrumento exacto para la evaluación del riesgo. Por lo tanto, las SNV no reemplazan la recopilación, integración e interpretación de la información sobre factores de riesgo a partir de la historia familiar y los antecedentes personales por parte de profesionales de atención de la salud competentes.[
Secuenciación del genoma completo o del exoma completo dirigida al consumidor e interpretación
Las empresas de pruebas dirigidas al consumidor ofrecen secuenciación del genoma completo (WGS) o secuenciación del exoma completo (WES), que incluye datos de SNV. Para obtener una descripción de los estudios WGS y WES, consultar la sección
Los factores que se deben considerar al determinar la exactitud de las pruebas dirigidas al consumidor y la utilidad de los datos de su secuencia para la evaluación del riesgo de cáncer (u otra enfermedad) son la profundidad de secuenciación de los genes de interés, si se detectan reordenamientos o deleciones génicas grandes, y cómo se confirman (o no) los resultados positivos (por ejemplo, mediante secuenciación de Sanger). Por ejemplo, si la profundidad de secuenciación es baja o no se detectan variantes raras, los resultados negativos falsos pueden ser una preocupación. Las pruebas dirigidas al consumidor también puede que notifiquen como patogénicos los cambios de secuencia del DNA que las pruebas confirmatorias identificarían como variantes benignas (resultado positivo falso). Cuando se obtienen WES o WGS, es probable que también se encuentren VSI,[
Consideraciones
Es posible que las pruebas dirigidas al consumidor conlleven otros beneficios. La comercialización de las pruebas dirigidas al consumidor y el suministro de pruebas genéticas quizás promuevan la autonomía del paciente.[
Dada la complejidad de las pruebas genómicas, varias organizaciones profesionales han publicado declaraciones de posición sobre las pruebas genéticas dirigidas al consumidor. Por ejemplo, la ASCO publicó en 2010 una declaración de posición con varias consideraciones relacionadas con las pruebas genómicas de cáncer dirigidas al consumidor, entre ellas las mencionadas antes.[
En 2016, una declaración del American College of Medical Genetics and Genomics sobre las pruebas genéticas dirigidas al consumidor también respaldó la participación de profesionales de genética competentes en los procesos de solicitud e interpretación de las pruebas.[
Consentimiento informado
El consentimiento informado puede mejorar la preparación para las pruebas, al incluir una evaluación cuidadosa de los beneficios y las limitaciones de las pruebas, control de los desenlaces psicosociales adversos, uso apropiado de opciones médicas y una relación fortalecida entre el proveedor y el paciente basada en honestidad, apoyo y confianza.
Hay consenso entre los expertos en el sentido de que el proceso de consentimiento informado debe ser parte integral del proceso de orientación previo a la prueba.[
La inclusión de un proceso de consentimiento informado durante la orientación promueve la autonomía del paciente.[
Algunos programas usan un segundo proceso de consentimiento informado antes de revelar a la persona los resultados de la prueba genética. Este proceso permite que una persona cambie de opinión sobre si desea recibir los resultados de las pruebas. Después de revelar el resultado de la prueba, a menudo se hace una tercera sesión de consentimiento informado. Esta sesión se enfoca en temas relacionados con la comunicación del resultado de la prueba genética con participación de proveedores de la salud o familiares interesados, en ese momento o en el futuro. El hecho de obtener autorización por escrito para compartir el resultado de la prueba a otros familiares en riesgo quizás evite problemas en el futuro si la persona no está disponible para comunicar el resultado.
Elementos fundamentales del consentimiento informado
En la sección anterior se destacan los elementos principales de una sesión de consentimiento informado. A continuación, se enumeran los elementos críticos, como se describen en la bibliografía[
- Prueba específica solicitada.
- Conversación sobre las expectativas, creencias, metas y motivaciones de la persona.
- Explicación de cómo la herencia de factores genéticos puede afectar la susceptibilidad al cáncer.
- Aclaración del aumento del riesgo de una persona.
- Análisis de los posibles beneficios, riesgos y limitaciones de las pruebas.
- Descripción de los costos y la logística de las pruebas y el seguimiento.
- Planteamiento de los posibles resultados de las pruebas (por ejemplo, positivo verdadero, negativo verdadero, VSI, no concluyente, positivo falso, negativo falso y hallazgos secundarios).
- Consideración de las opciones de tratamiento médico de acuerdo con la evaluación del riesgo y los resultados de las pruebas para las personas que deciden o no someterse a pruebas. También para las personas que obtienen resultados positivos, negativos o no concluyentes.
- Datos sobre la eficacia de los métodos de prevención y detección temprana del cáncer.
- Explicación de las posibles consecuencias psicológicas, sociales, económicas y sobre la dinámica familiar de someterse a pruebas o no hacerlo.
- Conversación sobre las implicaciones para los familiares de los resultados de la prueba genética. Es posible que se le pida a los pacientes que comuniquen a sus familiares los resultados de las pruebas genéticas.[
88 ] - Aclaración de las alternativas a las pruebas genéticas (por ejemplo, almacenaje de tejido, evaluación del riesgo sin pruebas genéticas).
- Obtención de consentimiento informado verbal y por escrito, o aclaración de la decisión de rechazar las pruebas.
Se debe informar a todas las personas que sopesan la decisión de someterse a pruebas genéticas, que cuentan con diversas opciones incluso después de completar la prueba genética. Es posible que decidan recibir los resultados en la consulta posterior a la prueba, retrasar la notificación de los resultados o, con menos frecuencia, que decidan no recibir los resultados de las pruebas. Se debe explicar a los consultantes que el interés en recibir los resultados se abordará al comienzo de la consulta posterior a la prueba y que se dispondrá de tiempo para revisar las preocupaciones y reflexiones sobre la notificación. Es importante que las personas reciban esta información durante la consulta de asesoramiento previo a las pruebas para asegurar que se sienten cómodas con la decisión de rechazar o aplazar la notificación de los resultados, incluso cuando los resultados de la prueba estén disponibles.
Pruebas en niños
Las pruebas genéticas para las variantes patogénicas de los genes de susceptibilidad al cáncer en niños son especialmente complejas. Cuando ambos progenitores [
- Se debe alentar el uso de pruebas a partir de un argumento clínico cuando hay estrategias de detección o prevención aplicables durante la niñez (por ejemplo, NEM y PAF).
- No se deben ofrecer pruebas cuando no hay estrategias de reducción del riesgo en la niñez, y la probabilidad de presentar una neoplasia maligna durante la niñez es muy baja (por ejemplo, síndrome de cáncer de mama y ovario hereditario).
- Es posible que algunos pacientes tengan riesgo de presentar una neoplasia maligna durante la niñez, pero que no hayan estrategias validadas de reducción del riesgo (por ejemplo, para las variantes patogénicas de TP53). En esas circunstancias, la decisión de obtener pruebas es especialmente controvertida.[
1 ]
Se requieren consideraciones especiales cuando se analiza el asesoramiento genético y las pruebas en busca de variantes patogénicas en los genes de susceptibilidad al cáncer en niños. El primer aspecto es la edad del niño. Es posible que los niños pequeños, en especial los menores de 10 años, no participen o que tengan una participación limitada en la decisión de someterse a las pruebas, y quizás algunos no participen en el proceso de asesoramiento genético. En estos casos, los progenitores del niño o su representante legal participarán en el asesoramiento genético y serán quienes decidan, en última instancia, proceder con las pruebas.[
Se han revisado las consecuencias de las pruebas genéticas en los niños.[
En resumen, es posible que las pruebas genéticas en niños se consideren si los resultados tienen el potencial de cambiar el tratamiento médico del niño y repercuten de manera favorable en los desenlaces de salud. Se sugiere diferir las pruebas genéticas cuando el riesgo de neoplasia maligna infantil es bajo o no hay riesgo, o cuando no hay evidencia de que las intervenciones reduzcan el riesgo.[
Para obtener más información en inglés sobre las pruebas para síndromes de cáncer hereditario en niños, consultar los siguientes resúmenes:
-
Genetics of Breast and Gynecologic Cancers -
Genetics of Colorectal Cancer -
Genetics of Endocrine and Neuroendocrine Neoplasias
Pruebas en poblaciones vulnerables
El asesoramiento genético y las pruebas requieren consideraciones especiales cuando se usan en poblaciones vulnerables. En 1995, la American Society of Human Genetics publicó una declaración de posición sobre las implicaciones éticas, legales y psicosociales de las pruebas genéticas en niños y adolescentes como población vulnerable.[
El asesoramiento genético y las pruebas en poblaciones vulnerables plantean consideraciones especiales. El objetivo del asesoramiento genético es ayudar a las personas a comprender y adaptarse a las implicaciones médicas, psicológicas y familiares de las causas genéticas de las enfermedades, lo que en parte implica un gran intercambio de información objetiva.[
Los proveedores deben evaluar en todos los pacientes la capacidad para tomar una decisión no forzada, autónoma y fundamentada antes de proceder con las pruebas genéticas. Las poblaciones que no parecen vulnerables (por ejemplo, universitarios mayores de edad) en realidad quizás sean vulnerables debido a una coacción indebida para obtener las pruebas por parte de sus progenitores o una amenaza de retirar el apoyo financiero si la decisión sobre la prueba es incompatible con los deseos de los progenitores. Tal vez sea necesario modificar el asesoramiento genético y el proceso de toma de las pruebas según la situación, como en el caso de personas con enfermedades terminales que optan someterse a las pruebas en beneficio de sus hijos, sin embargo, debido a su muerte inminente, es posible que los resultados no afecten su propia atención médica o que no estén disponibles antes de la muerte. En resumen, el asesoramiento genético y la toma de pruebas exigen que el proveedor de atención de la salud evalúe a las personas en busca de indicios de vulnerabilidad y, si es así, que sea sensible a estos problemas, modifique el asesoramiento genético en función de las circunstancias específicas y evite causar daños adicionales.
Pruebas genéticas en cascada en los miembros de una familia
Las pruebas genéticas en cascada se refieren al proceso para ofrecer pruebas genéticas a los familiares biológicos que corren el riesgo de heredar la variante patogénica identificada previamente en un familiar. El proceso se repite a medida que se identifican otros portadores de la variante patogénica dentro de una familia. Las pruebas en cascada ayudan a identificar a los portadores de variantes patogénicas antes de la presentación del cáncer, lo que permite la prevención de la enfermedad, la detección temprana, la reducción del riesgo y la mejora de los desenlaces de salud.[
Aceptación de las pruebas genéticas en cascada
La difusión de la información sobre el riesgo genético, desde el probando hasta los familiares en riesgo, es esencial para la adopción de pruebas en cascada. Tradicionalmente, esto ha incluido conversaciones (entre el proveedor de asesoramiento genético y el probando) sobre la importancia de transmitir los resultados a familiares en riesgo según el árbol genealógico del probando. Los proveedores pueden suministrar al probando una carta o materiales educativos para facilitar la divulgación de los resultados de las pruebas genéticas a los familiares.[
La mayoría de los estudios sobre la aceptación de las pruebas en cascada se llevaron a cabo en familias con cáncer de mama y ovario hereditario (HBOC) o con síndrome de Lynch. En una revisión sistemática de la evidencia, se encontró que en las familias con HBOC, el probando notificó a los miembros de la familia sobre la variante patogénica familiar entre un 21 % y un 44 % de las veces. Fue más probable que los familiares de primer grado (FPG), las mujeres y los familiares cercanos recibieran la información sobre la variante familiar. Las tasas de las pruebas de seguimiento variaron según el estudio; en general, entre el 15 % y el 57 % se sometieron a pruebas genéticas en cascada.[
Barreras para las pruebas genéticas en cascada
Barreras de comunicación
Es posible que las barreras emocionales influyan en la comunicación de los resultados de las variantes patogénicas a los familiares. Estas barreras pueden incluir la pérdida de contacto, la falta de una relación emocional estrecha con los familiares,[
Interpretación de la información
En un estudio retrospectivo sobre FPG de probandos con variantes patogénicas o probablemente patogénicas, el 14 % de los FPG que recibieron información sobre los resultados de las pruebas genéticas del probando encontraron que la información era difícil de entender. El recuerdo del resultado de la prueba por parte de los FPG fue congruente con el resultado real de la prueba en el 82 % de los casos. Sin embargo, un 10 % no pudo recordar el resultado de la prueba.[
Estrategias para facilitar las pruebas genéticas en cascada
Se han propuesto varias estrategias para facilitar la comunicación de los resultados de las pruebas genéticas y la aceptación de las pruebas en cascada en los familiares. Estas estrategias se analizaron y se discuten en las siguientes secciones.
Materiales por escrito
En el Finland Lynch syndrome Registry se estudió la comunicación con los familiares en riesgo mediante cartas. En 36 familias, los miembros (N = 446) con un riesgo del 50 % de presentar síndrome de Lynch recibieron una notificación mediante carta, en la que se ofreció asesoramiento y pruebas genéticas para la variante familiar. De los 446 miembros de la familia, 347 se sometieron a asesoramiento genético; el 75 % de la cohorte (n = 334) optó por someterse a las pruebas genéticas.[
Asesoramiento grupal
El Family Information Service de Creighton University estableció un servicio de sesiones grupales de asesoramiento para familiares en riesgo durante sesiones educativas. Los tamaños de los grupos oscilaron entre 15 y 75 personas. Profesionales de enfermería y consejeros especializados en genética llevaron adelante las sesiones en lugares que eran convenientes para los miembros de la familia inscritos. Si bien no se notificó la tasa de aceptación de las pruebas genéticas, estas sesiones redujeron de manera considerable el tiempo de atención médica individual, lo que aumentó la capacidad de la clínica de genética.[
Capacitación del probando
Algunos grupos han estudiado las estrategias de preparación de los probandos para comunicar los resultados de las pruebas genéticas a los familiares en riesgo. En un ensayo aleatorizado controlado, se dio una capacitación a los participantes en el uso de una estrategia de comunicación en 6 pasos. Este abordaje incluyó la identificación de familiares en riesgo, la selección de un método de comunicación, la evaluación del conocimiento de los familiares, el intercambio del resultado de las pruebas genéticas, la respuesta a las reacciones de los familiares y la provisión de recursos de asesoramiento genético. No hubo diferencias significativas en las tasas de comunicación de los resultados de las pruebas genéticas entre los grupos de intervención (n = 137) y de control (n = 112).[
Un grupo de investigación holandés exploró el uso de una intervención de entrevista motivacional telefónica de 2 fases realizada por 5 trabajadores capacitados en aspectos psicosociales. Los consultantes (n = 144) tenían por lo menos un familiar elegible para una prueba genética en cascada o un examen de detección del cáncer. En la fase 1 se determinó la agenda, se confirmó qué miembros de la familia debían ser informados por el consultor y se exploraron los mecanismos de comunicación de los resultados vigentes y proyectados. La fase 2 se centró en compartir información específica, fomentar la motivación y la autoeficacia de los consultantes, así como en idear soluciones para superar las barreras de la difusión. Los consultantes determinaron que esta estrategia era factible y aceptable. En un estudio aleatorizado se evaluará si esta intervención aumenta la comunicación de los resultados de las pruebas genéticas.[
En un ensayo controlado aleatorizado de Australia se evaluó el efecto del asesoramiento genético telefónico en personas que recibieron el diagnóstico de una afección genética, personas con hijos que presentan este tipo de afecciones o personas portadoras de variantes patogénicas. La orientación telefónica se hizo de 2 a 3 veces (en un periodo de 12 meses) en el grupo de intervención (n = 45). Estas personas se compararon con las del grupo de control (n = 50). No hubo diferencias significativas en el número de familiares que consultaron los servicios genéticos.[
Pruebas genéticas de bajo costo o gratuitas
En un estudio se exploró el uso de pruebas genéticas gratuitas para los familiares en riesgo. En una cohorte de portadores de variantes de BRCA1 o BRCA2 (n = 115) que tenían familiares aptos para someterse a las pruebas gratuitas, el 77 % de los participantes reveló los resultados a todos los familiares en riesgo. Solo el 60 % de los FPG y el 47 % de los familiares más lejanos se sometieron a pruebas genéticas.[
Los laboratorios de pruebas genéticas están explorando maneras de reducir las barreras de los familiares para acceder a las pruebas genéticas, dado que la aceptabilidad de las pruebas en cascada es baja.[
En un estudio se realizaron pruebas genéticas de cáncer hereditario sobre la base del diagnóstico de tumores sólidos. Se realizaron pruebas en pacientes no seleccionados para pruebas genéticas específicas por los antecedentes familiares o las directrices nacionales. A los familiares biológicos del probando se les ofreció pruebas genéticas sin costo durante 3 meses después de que se notificaron los resultados. Al menos un familiar se sometió a pruebas genéticas en el 17,6 % de las familias aptas. Se evaluó una mediana de 2 personas por familia (intervalo, 1–14 personas), aunque no se notificó el número total de familiares que cumplían con los requisitos para la prueba.[
Pruebas dirigidas al consumidor en Internet
Un laboratorio de pruebas dirigidas al consumidor que ofrece un panel genético oncológico de 30 genes ofreció la prueba a un costo reducido ($50) a los FPG de personas con un resultado positivo para una variante patogénica. A los probandos se les envió por correo electrónico información sobre el programa de pruebas familiares. Los interesados (n = 1101) identificaron a los FPG en riesgo y brindaron su información de contacto. El laboratorio envió correos electrónicos a los FPG, invitándolos a someterse a pruebas con el mismo panel de 30 genes (que incluía las variantes patogénicas identificadas en sus familiares). Al cabo de 1 año de seguimiento, el 48 % de los FPG se sometieron a pruebas genéticas. Solo el 12 % de los FPG con resultados positivos continuaron con las pruebas en cascada de sus propios FPG. Cabe destacar, que el 5 % de los FPG tenían variantes patogénicas en genes distintos de los que se encontraron en sus familiares. Además, el 16,8 % de los FPG tenían una VSI.[
Pruebas de proveedores dirigidas a familiares
En una revisión sistemática de la evidencia se estudió cómo se notificaron los resultados de las pruebas genéticas a los familiares, utilizando la información de contacto proporcionada por los probandos. Los resultados mostraron que el número de probandos evaluados fue mayor que el número de familiares notificados sobre los resultados. En otros 4 estudios se notificó que los familiares no entendían los resultados de las pruebas genéticas. Sin embargo, cuando los proveedores de atención de la salud informaron adecuadamente a estas personas, la mayoría optó por hacerse la prueba.[
De manera similar, en un estudio de 30 probandos con una variante patogénica, se identificaron 114 familiares en riesgo. En última instancia, los probandos autorizaron a los coordinadores del estudio para que se comunicaran con 102 familiares en riesgo. Un miembro del equipo de genética contactó con éxito al 93 % (95 de 102) de esos familiares, el 97 % (92) aceptaron recibir asesoramiento genético, el 86 % (82) aceptaron someterse a pruebas genéticas y el 70 % (66) se sometieron a pruebas de la variante patogénica familiar.[
Cuando las pruebas genéticas se realizan en un entorno clínico, es posible que haya otros aspectos a considerar antes de contactar a los familiares, como la facturación y las normas de privacidad institucional.
Chatbots
Los chatbots usan inteligencia artificial para crear un avatar en línea que pueda hablar con los usuarios, simulando conversaciones reales a partir de textos de diálogos predeterminados.[
En estos estudios se notificaron limitaciones en la aceptación de pruebas en cascada y la difusión de los resultados de las pruebas genéticas cuando los probandos comunicaron a los familiares los resultados de las pruebas genéticas. No se ha notificado una estrategia óptima de comunicación de resultados.[
Aspectos éticos, legales y sociales
Los aspectos éticos, legales y sociales relacionados con las pruebas genéticas en cascada, como el deber de advertir y la comunicación de los resultados a los familiares en riesgo, se analizan en la sección
Referencias:
- Robson ME, Storm CD, Weitzel J, et al.: American Society of Clinical Oncology policy statement update: genetic and genomic testing for cancer susceptibility. J Clin Oncol 28 (5): 893-901, 2010.
- Robson ME, Bradbury AR, Arun B, et al.: American Society of Clinical Oncology Policy Statement Update: Genetic and Genomic Testing for Cancer Susceptibility. J Clin Oncol 33 (31): 3660-7, 2015.
- Gustafson SL, Raymond VM, Marvin ML, et al.: Outcomes of genetic evaluation for hereditary cancer syndromes in unaffected individuals. Fam Cancer 14 (1): 167-74, 2015.
- Berliner JL, Cummings SA, Boldt Burnett B, et al.: Risk assessment and genetic counseling for hereditary breast and ovarian cancer syndromes-Practice resource of the National Society of Genetic Counselors. J Genet Couns 30 (2): 342-360, 2021.
- Clain E, Trosman JR, Douglas MP, et al.: Availability and payer coverage of BRCA1/2 tests and gene panels. Nat Biotechnol 33 (9): 900-2, 2015.
- Walcott FL, Dunn BK: Legislation in the genomic era: the Affordable Care Act and genetic testing for cancer risk assessment. Genet Med 17 (12): 962-4, 2015.
- The Center for Consumer Information & Insurance Oversight: Affordable Care Act Implementation FAQs - Set 12. Baltimore, Md: Centers for Medicare & Medicaid Services, 2013.
Available online . Last accessed December 9, 2024. - Facing Our Risk of Cancer Empowered (FORCE): Paying for Genetic Services. Tampa, FL: FORCE, 2016.
Available online . Last accessed December 9, 2024. - Offit K, Kohut K, Clagett B, et al.: Cancer genetic testing and assisted reproduction. J Clin Oncol 24 (29): 4775-82, 2006.
- Offit K, Sagi M, Hurley K: Preimplantation genetic diagnosis for cancer syndromes: a new challenge for preventive medicine. JAMA 296 (22): 2727-30, 2006.
- Wang CW, Hui EC: Ethical, legal and social implications of prenatal and preimplantation genetic testing for cancer susceptibility. Reprod Biomed Online 19 (Suppl 2): 23-33, 2009.
- Meyer S, Tischkowitz M, Chandler K, et al.: Fanconi anaemia, BRCA2 mutations and childhood cancer: a developmental perspective from clinical and epidemiological observations with implications for genetic counselling. J Med Genet 51 (2): 71-5, 2014.
- Sawyer SL, Tian L, Kähkönen M, et al.: Biallelic mutations in BRCA1 cause a new Fanconi anemia subtype. Cancer Discov 5 (2): 135-42, 2015.
- Rich TA, Liu M, Etzel CJ, et al.: Comparison of attitudes regarding preimplantation genetic diagnosis among patients with hereditary cancer syndromes. Fam Cancer 13 (2): 291-9, 2014.
- Frank TS, Deffenbaugh AM, Reid JE, et al.: Clinical characteristics of individuals with germline mutations in BRCA1 and BRCA2: analysis of 10,000 individuals. J Clin Oncol 20 (6): 1480-90, 2002.
- Nieuwenhuis MH, Vasen HF: Correlations between mutation site in APC and phenotype of familial adenomatous polyposis (FAP): a review of the literature. Crit Rev Oncol Hematol 61 (2): 153-61, 2007.
- Knudsen AL, Bülow S, Tomlinson I, et al.: Attenuated familial adenomatous polyposis: results from an international collaborative study. Colorectal Dis 12 (10 Online): e243-9, 2010.
- Offit K, Bradbury A, Storm C, et al.: Gene patents and personalized cancer care: impact of the Myriad case on clinical oncology. J Clin Oncol 31 (21): 2743-8, 2013.
- Robson M: Multigene panel testing: planning the next generation of research studies in clinical cancer genetics. J Clin Oncol 32 (19): 1987-9, 2014.
- Domchek SM, Bradbury A, Garber JE, et al.: Multiplex genetic testing for cancer susceptibility: out on the high wire without a net? J Clin Oncol 31 (10): 1267-70, 2013.
- Hiraki S, Rinella ES, Schnabel F, et al.: Cancer risk assessment using genetic panel testing: considerations for clinical application. J Genet Couns 23 (4): 604-17, 2014.
- Cragun D, Radford C, Dolinsky JS, et al.: Panel-based testing for inherited colorectal cancer: a descriptive study of clinical testing performed by a US laboratory. Clin Genet 86 (6): 510-20, 2014.
- Couch FJ, Hart SN, Sharma P, et al.: Inherited mutations in 17 breast cancer susceptibility genes among a large triple-negative breast cancer cohort unselected for family history of breast cancer. J Clin Oncol 33 (4): 304-11, 2015.
- LaDuca H, Stuenkel AJ, Dolinsky JS, et al.: Utilization of multigene panels in hereditary cancer predisposition testing: analysis of more than 2,000 patients. Genet Med 16 (11): 830-7, 2014.
- Kurian AW, Hare EE, Mills MA, et al.: Clinical evaluation of a multiple-gene sequencing panel for hereditary cancer risk assessment. J Clin Oncol 32 (19): 2001-9, 2014.
- Tung N, Battelli C, Allen B, et al.: Frequency of mutations in individuals with breast cancer referred for BRCA1 and BRCA2 testing using next-generation sequencing with a 25-gene panel. Cancer 121 (1): 25-33, 2015.
- Moran O, Nikitina D, Royer R, et al.: Revisiting breast cancer patients who previously tested negative for BRCA mutations using a 12-gene panel. Breast Cancer Res Treat 161 (1): 135-142, 2017.
- Frey MK, Kim SH, Bassett RY, et al.: Rescreening for genetic mutations using multi-gene panel testing in patients who previously underwent non-informative genetic screening. Gynecol Oncol 139 (2): 211-5, 2015.
- Lincoln SE, Kobayashi Y, Anderson MJ, et al.: A Systematic Comparison of Traditional and Multigene Panel Testing for Hereditary Breast and Ovarian Cancer Genes in More Than 1000 Patients. J Mol Diagn 17 (5): 533-44, 2015.
- Desmond A, Kurian AW, Gabree M, et al.: Clinical Actionability of Multigene Panel Testing for Hereditary Breast and Ovarian Cancer Risk Assessment. JAMA Oncol 1 (7): 943-51, 2015.
- Kapoor NS, Curcio LD, Blakemore CA, et al.: Multigene Panel Testing Detects Equal Rates of Pathogenic BRCA1/2 Mutations and has a Higher Diagnostic Yield Compared to Limited BRCA1/2 Analysis Alone in Patients at Risk for Hereditary Breast Cancer. Ann Surg Oncol 22 (10): 3282-8, 2015.
- Ricker C, Culver JO, Lowstuter K, et al.: Increased yield of actionable mutations using multi-gene panels to assess hereditary cancer susceptibility in an ethnically diverse clinical cohort. Cancer Genet 209 (4): 130-7, 2016.
- Hermel DJ, McKinnon WC, Wood ME, et al.: Multi-gene panel testing for hereditary cancer susceptibility in a rural Familial Cancer Program. Fam Cancer 16 (1): 159-166, 2017.
- Eliade M, Skrzypski J, Baurand A, et al.: The transfer of multigene panel testing for hereditary breast and ovarian cancer to healthcare: What are the implications for the management of patients and families? Oncotarget 8 (2): 1957-1971, 2017.
- Yurgelun MB, Allen B, Kaldate RR, et al.: Identification of a Variety of Mutations in Cancer Predisposition Genes in Patients With Suspected Lynch Syndrome. Gastroenterology 149 (3): 604-13.e20, 2015.
- Susswein LR, Marshall ML, Nusbaum R, et al.: Pathogenic and likely pathogenic variant prevalence among the first 10,000 patients referred for next-generation cancer panel testing. Genet Med 18 (8): 823-32, 2016.
- Shirts BH, Casadei S, Jacobson AL, et al.: Improving performance of multigene panels for genomic analysis of cancer predisposition. Genet Med 18 (10): 974-81, 2016.
- Caswell-Jin JL, Gupta T, Hall E, et al.: Racial/ethnic differences in multiple-gene sequencing results for hereditary cancer risk. Genet Med 20 (2): 234-239, 2018.
- Rosenthal ET, Bernhisel R, Brown K, et al.: Clinical testing with a panel of 25 genes associated with increased cancer risk results in a significant increase in clinically significant findings across a broad range of cancer histories. Cancer Genet 218-219: 58-68, 2017.
- Roberts ME, Susswein LR, Janice Cheng W, et al.: Ancestry-specific hereditary cancer panel yields: Moving toward more personalized risk assessment. J Genet Couns 29 (4): 598-606, 2020.
- Fecteau H, Vogel KJ, Hanson K, et al.: The evolution of cancer risk assessment in the era of next generation sequencing. J Genet Couns 23 (4): 633-9, 2014.
- Hall MJ, Forman AD, Pilarski R, et al.: Gene panel testing for inherited cancer risk. J Natl Compr Canc Netw 12 (9): 1339-46, 2014.
- Easton DF, Pharoah PD, Antoniou AC, et al.: Gene-panel sequencing and the prediction of breast-cancer risk. N Engl J Med 372 (23): 2243-57, 2015.
- Eggington JM, Bowles KR, Moyes K, et al.: A comprehensive laboratory-based program for classification of variants of uncertain significance in hereditary cancer genes. Clin Genet 86 (3): 229-37, 2014.
- Wolfe Schneider K, Anguiano A, Axell L, et al.: Collaboration of colorado cancer genetic counselors to integrate next generation sequencing panels into clinical practice. J Genet Couns 23 (4): 640-6, 2014.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 2.2024. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023.
Available online with free registration. Last accessed September 18, 2024. - Tung N, Domchek SM, Stadler Z, et al.: Counselling framework for moderate-penetrance cancer-susceptibility mutations. Nat Rev Clin Oncol 13 (9): 581-8, 2016.
- Hudson KL, Murphy JA, Kaufman DJ, et al.: Oversight of US genetic testing laboratories. Nat Biotechnol 24 (9): 1083-90, 2006.
- Schwartz MK: Genetic testing and the clinical laboratory improvement amendments of 1988: present and future. Clin Chem 45 (5): 739-45, 1999.
- Javitt GH, Hudson K: Federal neglect: regulation of genetic testing. Issues Sci Technol 22: 58-66, 2006.
Also available online . Last accessed December 9, 2024. - McGovern MM, Benach M, Wallenstein S, et al.: Personnel standards and quality assurance practices of biochemical genetic testing laboratories in the United States. Arch Pathol Lab Med 127 (1): 71-6, 2003.
- McGovern MM, Elles R, Beretta I, et al.: Report of an international survey of molecular genetic testing laboratories. Community Genet 10 (3): 123-31, 2007.
- Ferreira-Gonzalez A, Teutsch S, Williams MS, et al.: US system of oversight for genetic testing: a report from the Secretary's Advisory Committee on Genetics, Health and Society. Per Med 5 (5): 521-528, 2008.
- Food and Drug Administration: Notification to Congress: FDA's Laboratory Developed Tests Framework. Silver Spring, Md: Food and Drug Administration, 2014.
Available online . Last accessed December 9, 2024. - U.S. Food and Drug Administration: FDA allows marketing of first direct-to-consumer tests that provide genetic risk information for certain conditions. Silver Spring, Md: U.S. Food and Drug Administration, 2017.
Available online . Last accessed December 9, 2024. - Wanner M: Genomes Versus Exomes Versus Genotypes. Bar Harbor, Me: The Jackson Library, 2016.
Available online . Last accessed December 9, 2024. - U.S. Food and Drug Administration: FDA News Release: FDA Roundup (September 1, 2023). 2023.
Available online . Last accessed December 9, 2024. - U.S. Food and Drug Administration: FDA authorizes, with special controls, direct-to-consumer test that reports three mutations in the BRCA breast cancer genes. Silver Spring, Md: U.S. Food and Drug Administration, 2018.
Available online . Last accessed December 9, 2024. - Ramos E, Weissman SM: The dawn of consumer-directed testing. Am J Med Genet C Semin Med Genet 178 (1): 89-97, 2018.
- Couch FJ, Nathanson KL, Offit K: Two decades after BRCA: setting paradigms in personalized cancer care and prevention. Science 343 (6178): 1466-70, 2014.
- Bellcross CA, Page PZ, Meaney-Delman D: Direct-to-consumer personal genome testing and cancer risk prediction. Cancer J 18 (4): 293-302, 2012 Jul-Aug.
- Swan M: Multigenic condition risk assessment in direct-to-consumer genomic services. Genet Med 12 (5): 279-88, 2010.
- Kalf RR, Mihaescu R, Kundu S, et al.: Variations in predicted risks in personal genome testing for common complex diseases. Genet Med 16 (1): 85-91, 2014.
- Aiyar L, Shuman C, Hayeems R, et al.: Risk estimates for complex disorders: comparing personal genome testing and family history. Genet Med 16 (3): 231-7, 2014.
- Heald B, Edelman E, Eng C: Prospective comparison of family medical history with personal genome screening for risk assessment of common cancers. Eur J Hum Genet 20 (5): 547-51, 2012.
- Bloss CS, Topol EJ, Schork NJ: Association of direct-to-consumer genome-wide disease risk estimates and self-reported disease. Genet Epidemiol 36 (1): 66-70, 2012.
- Gail MH, Brinton LA, Byar DP, et al.: Projecting individualized probabilities of developing breast cancer for white females who are being examined annually. J Natl Cancer Inst 81 (24): 1879-86, 1989.
- McCarthy AM, Armstrong K, Handorf E, et al.: Incremental impact of breast cancer SNP panel on risk classification in a screening population of white and African American women. Breast Cancer Res Treat 138 (3): 889-98, 2013.
- Mealiffe ME, Stokowski RP, Rhees BK, et al.: Assessment of clinical validity of a breast cancer risk model combining genetic and clinical information. J Natl Cancer Inst 102 (21): 1618-27, 2010.
- Glusman G, Cariaso M, Jimenez R, et al.: Low budget analysis of Direct-To-Consumer genomic testing familial data. F1000Res 1: 3, 2012.
- Cariaso M, Lennon G: SNPedia: a wiki supporting personal genome annotation, interpretation and analysis. Nucleic Acids Res 40 (Database issue): D1308-12, 2012.
- Tandy-Connor S, Guiltinan J, Krempely K, et al.: False-positive results released by direct-to-consumer genetic tests highlight the importance of clinical confirmation testing for appropriate patient care. Genet Med 20 (12): 1515-1521, 2018.
- Berg JS, Khoury MJ, Evans JP: Deploying whole genome sequencing in clinical practice and public health: meeting the challenge one bin at a time. Genet Med 13 (6): 499-504, 2011.
- Richards S, Aziz N, Bale S, et al.: Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med 17 (5): 405-24, 2015.
- McCabe LL, McCabe ER: Direct-to-consumer genetic testing: access and marketing. Genet Med 6 (1): 58-9, 2004 Jan-Feb.
- Bansback N, Sizto S, Guh D, et al.: The effect of direct-to-consumer genetic tests on anticipated affect and health-seeking behaviors: a pilot survey. Genet Test Mol Biomarkers 16 (10): 1165-71, 2012.
- Kaufman DJ, Bollinger JM, Dvoskin RL, et al.: Risky business: risk perception and the use of medical services among customers of DTC personal genetic testing. J Genet Couns 21 (3): 413-22, 2012.
- Bloss CS, Schork NJ, Topol EJ: Effect of direct-to-consumer genomewide profiling to assess disease risk. N Engl J Med 364 (6): 524-34, 2011.
- van der Wouden CH, Carere DA, Maitland-van der Zee AH, et al.: Consumer Perceptions of Interactions With Primary Care Providers After Direct-to-Consumer Personal Genomic Testing. Ann Intern Med 164 (8): 513-22, 2016.
- Carere DA, VanderWeele T, Moreno TA, et al.: The impact of direct-to-consumer personal genomic testing on perceived risk of breast, prostate, colorectal, and lung cancer: findings from the PGen study. BMC Med Genomics 8: 63, 2015.
- Gray SW, Gollust SE, Carere DA, et al.: Personal Genomic Testing for Cancer Risk: Results From the Impact of Personal Genomics Study. J Clin Oncol 35 (6): 636-644, 2017.
- ACMG Board of Directors: Direct-to-consumer genetic testing: a revised position statement of the American College of Medical Genetics and Genomics. Genet Med 18 (2): 207-8, 2016.
- Geller G, Botkin JR, Green MJ, et al.: Genetic testing for susceptibility to adult-onset cancer. The process and content of informed consent. JAMA 277 (18): 1467-74, 1997.
- Hudson KL, Holohan MK, Collins FS: Keeping pace with the times--the Genetic Information Nondiscrimination Act of 2008. N Engl J Med 358 (25): 2661-3, 2008.
- Geller G, Doksum T, Bernhardt BA, et al.: Participation in breast cancer susceptibility testing protocols: influence of recruitment source, altruism, and family involvement on women's decisions. Cancer Epidemiol Biomarkers Prev 8 (4 Pt 2): 377-83, 1999.
- American College of Medical Genetics: Genetic susceptibility to breast and ovarian cancer: assessment, counseling and testing guidelines. New York State Department of Health, American College of Medical Genetics Foundation, 1999.
- McKinnon WC, Baty BJ, Bennett RL, et al.: Predisposition genetic testing for late-onset disorders in adults. A position paper of the National Society of Genetic Counselors. JAMA 278 (15): 1217-20, 1997.
- Phillips A, Niemiec E, Howard HC, et al.: Communicating genetic information to family members: analysis of consent forms for diagnostic genomic sequencing. Eur J Hum Genet 28 (9): 1160-1167, 2020.
- Bradbury AR, Patrick-Miller L, Egleston B, et al.: Parent opinions regarding the genetic testing of minors for BRCA1/2. J Clin Oncol 28 (21): 3498-505, 2010.
- O'Neill SC, Peshkin BN, Luta G, et al.: Primary care providers' willingness to recommend BRCA1/2 testing to adolescents. Fam Cancer 9 (1): 43-50, 2010.
- Nelson RM, Botkjin JR, Kodish ED, et al.: Ethical issues with genetic testing in pediatrics. Pediatrics 107 (6): 1451-5, 2001.
- Points to consider: ethical, legal, and psychosocial implications of genetic testing in children and adolescents. American Society of Human Genetics Board of Directors, American College of Medical Genetics Board of Directors. Am J Hum Genet 57 (5): 1233-41, 1995.
- Wertz DC, Fanos JH, Reilly PR: Genetic testing for children and adolescents. Who decides? JAMA 272 (11): 875-81, 1994.
- Field M, Shanley S, Kirk J: Inherited cancer susceptibility syndromes in paediatric practice. J Paediatr Child Health 43 (4): 219-29, 2007.
- Tischkowitz M, Rosser E: Inherited cancer in children: practical/ethical problems and challenges. Eur J Cancer 40 (16): 2459-70, 2004.
- Fanos JH: Developmental tasks of childhood and adolescence: implications for genetic testing. Am J Med Genet 71 (1): 22-8, 1997.
- Bernhardt BA, Tambor ES, Fraser G, et al.: Parents' and children's attitudes toward the enrollment of minors in genetic susceptibility research: implications for informed consent. Am J Med Genet A 116 (4): 315-23, 2003.
- European Society of Human Genetics: Genetic testing in asymptomatic minors: Recommendations of the European Society of Human Genetics. Eur J Hum Genet 17 (6): 720-1, 2009.
- Borry P, Evers-Kiebooms G, Cornel MC, et al.: Genetic testing in asymptomatic minors: background considerations towards ESHG Recommendations. Eur J Hum Genet 17 (6): 711-9, 2009.
- Resta R, Biesecker BB, Bennett RL, et al.: A new definition of Genetic Counseling: National Society of Genetic Counselors' Task Force report. J Genet Couns 15 (2): 77-83, 2006.
- Frey MK, Kahn RM, Chapman-Davis E, et al.: Prospective Feasibility Trial of a Novel Strategy of Facilitated Cascade Genetic Testing Using Telephone Counseling. J Clin Oncol 38 (13): 1389-1397, 2020.
- Dheensa S, Fenwick A, Shkedi-Rafid S, et al.: Health-care professionals' responsibility to patients' relatives in genetic medicine: a systematic review and synthesis of empirical research. Genet Med 18 (4): 290-301, 2016.
- Weaver M: The Double Helix: Applying an Ethic of Care to the Duty to Warn Genetic Relatives of Genetic Information. Bioethics 30 (3): 181-7, 2016.
- Menko FH, Ter Stege JA, van der Kolk LE, et al.: The uptake of presymptomatic genetic testing in hereditary breast-ovarian cancer and Lynch syndrome: a systematic review of the literature and implications for clinical practice. Fam Cancer 18 (1): 127-135, 2019.
- Griffin NE, Buchanan TR, Smith SH, et al.: Low rates of cascade genetic testing among families with hereditary gynecologic cancer: An opportunity to improve cancer prevention. Gynecol Oncol 156 (1): 140-146, 2020.
- Landsbergen K, Verhaak C, Kraaimaat F, et al.: Genetic uptake in BRCA-mutation families is related to emotional and behavioral communication characteristics of index patients. Fam Cancer 4 (2): 115-9, 2005.
- Lerman C, Croyle RT, Tercyak KP, et al.: Genetic testing: psychological aspects and implications. J Consult Clin Psychol 70 (3): 784-97, 2002.
- Stoffel EM, Ford B, Mercado RC, et al.: Sharing genetic test results in Lynch syndrome: communication with close and distant relatives. Clin Gastroenterol Hepatol 6 (3): 333-8, 2008.
- Claes E, Evers-Kiebooms G, Boogaerts A, et al.: Communication with close and distant relatives in the context of genetic testing for hereditary breast and ovarian cancer in cancer patients. Am J Med Genet 116A (1): 11-9, 2003.
- Hughes C, Lerman C, Schwartz M, et al.: All in the family: evaluation of the process and content of sisters' communication about BRCA1 and BRCA2 genetic test results. Am J Med Genet 107 (2): 143-50, 2002.
- Kenen R, Arden-Jones A, Eeles R: We are talking, but are they listening? Communication patterns in families with a history of breast/ovarian cancer (HBOC). Psychooncology 13 (5): 335-45, 2004.
- MacDonald DJ: Genetic predisposition testing for cancer: effects on families' lives. Holist Nurs Pract 12 (3): 9-19, 1998.
- McGivern B, Everett J, Yager GG, et al.: Family communication about positive BRCA1 and BRCA2 genetic test results. Genet Med 6 (6): 503-9, 2004 Nov-Dec.
- Sermijn E, Goelen G, Teugels E, et al.: The impact of proband mediated information dissemination in families with a BRCA1/2 gene mutation. J Med Genet 41 (3): e23, 2004.
- Fehniger J, Lin F, Beattie MS, et al.: Family communication of BRCA1/2 results and family uptake of BRCA1/2 testing in a diverse population of BRCA1/2 carriers. J Genet Couns 22 (5): 603-12, 2013.
- Daly MB, Montgomery S, Bingler R, et al.: Communicating genetic test results within the family: Is it lost in translation? A survey of relatives in the randomized six-step study. Fam Cancer 15 (4): 697-706, 2016.
- Aktan-Collan K, Mecklin JP, Järvinen H, et al.: Predictive genetic testing for hereditary non-polyposis colorectal cancer: uptake and long-term satisfaction. Int J Cancer 89 (1): 44-50, 2000.
- Lynch HT: Family information service and hereditary cancer. Cancer 91 (4): 625-8, 2001.
- Montgomery SV, Barsevick AM, Egleston BL, et al.: Preparing individuals to communicate genetic test results to their relatives: report of a randomized control trial. Fam Cancer 12 (3): 537-46, 2013.
- de Geus E, Eijzenga W, Menko FH, et al.: Design and Feasibility of an Intervention to Support Cancer Genetic Counselees in Informing their At-Risk Relatives. J Genet Couns 25 (6): 1179-1187, 2016.
- Hodgson J, Metcalfe S, Gaff C, et al.: Outcomes of a randomised controlled trial of a complex genetic counselling intervention to improve family communication. Eur J Hum Genet 24 (3): 356-60, 2016.
- Finlay E, Stopfer JE, Burlingame E, et al.: Factors determining dissemination of results and uptake of genetic testing in families with known BRCA1/2 mutations. Genet Test 12 (1): 81-91, 2008.
- Invitae: Family follow-up testing. 2020.
Available online. Last accessed December 9, 2024. - Color Health, Inc: Color's Family Testing Program. 2021.
Available online . Last accessed December 9, 2024. - Samadder NJ, Riegert-Johnson D, Boardman L, et al.: Comparison of Universal Genetic Testing vs Guideline-Directed Targeted Testing for Patients With Hereditary Cancer Syndrome. JAMA Oncol 7 (2): 230-237, 2021.
- Caswell-Jin JL, Zimmer AD, Stedden W, et al.: Cascade Genetic Testing of Relatives for Hereditary Cancer Risk: Results of an Online Initiative. J Natl Cancer Inst 111 (1): 95-98, 2019.
- Gordon ES, Babu D, Laney DA: The future is now: Technology's impact on the practice of genetic counseling. Am J Med Genet C Semin Med Genet 178 (1): 15-23, 2018.
- Roberts MC, Dotson WD, DeVore CS, et al.: Delivery Of Cascade Screening For Hereditary Conditions: A Scoping Review Of The Literature. Health Aff (Millwood) 37 (5): 801-808, 2018.
Comunicación de la información sobre el riesgo
Es posible que se ofrezcan programas clínicos específicos para el control del riesgo a personas con aumento del riesgo genético de cáncer. A continuación se indican las posibles diferencias entre estos programas y los que se ofrecen a las personas de riesgo promedio: a veces la detección sistemática se inicia a una edad más temprana o se hace a intervalos más cortos. Se ofrecen estrategias de detección que no se usan de manera habitual, por ejemplo, la detección del cáncer de ovario, o se ofrecen intervenciones para reducir el riesgo de cáncer, como la cirugía de reducción del riesgo. Las recomendaciones vigentes se registran en los resúmenes del PDQ sobre las características genéticas de cánceres específicos.
El objetivo de la educación genética y del asesoramiento es ayudar a las personas a comprender el riesgo personal, reconocer las opciones para el control del riesgo de cáncer y explorar sus sentimientos con respecto al riesgo personal. El asesoramiento se centra en obtener y proporcionar información, promover la toma de decisiones autónomas y facilitar el consentimiento informado si se persigue una prueba genética.
Idealmente, la educación y el asesoramiento sobre el riesgo de cáncer incluye la siguiente información:
- Propósito, fortalezas y limitaciones de la evaluación del riesgo de cáncer.
- Fundamentos sobre la genética y los modos de herencia.
- Causas genéticas del cáncer.
- Características clínicas de los síndromes de cáncer hereditario relevantes.
- Datos que indican la presencia de un síndrome de cáncer hereditario según los antecedentes del consultante y la historia familiar.
- Opciones para aclarar el riesgo de cáncer, incluso pruebas genéticas, si se indica.
- Opciones disponibles para el control del riesgo, incluso datos (o falta de datos) sobre la eficacia de diferentes medidas para la detección temprana y la reducción del riesgo.
- Signos y síntomas del cáncer.
Cuando se dispone de una prueba genética con validez clínica, la información para la educación y el asesoramiento sobre la prueba genética suele incluir los siguientes aspectos:
- Riesgo de tener la variante patogénica y tipo de transmisión hereditaria.
- Alternativas a las pruebas genéticas.
- Riesgos, beneficios y limitaciones de las pruebas genéticas, entre ellos, los riesgos psicológicos y de discriminación.
- Posibles resultados de las pruebas, como la probabilidad de resultados no informativos y la identificación de variantes de significado incierto.
- Sensibilidad de la prueba genética, incluso las técnicas utilizadas para realizar la prueba y sus limitaciones.
- Opciones de atención de la salud de acuerdo con los posibles resultados de las pruebas.
- Consecuencias para los niños y otros familiares según el tipo de transmisión hereditaria.
- Comunicación del riesgo y de la información genética a los familiares.
- Costo de las pruebas, el asesoramiento, la atención médica y las opciones de cobertura del seguro.
- Modo en que se registra la información genética y los resultados de las pruebas genéticas en la historia clínica.
- Almacenamiento y reutilización de muestras, si procede.
Si se lleva a cabo una segunda consulta para revelar e interpretar los resultados de las pruebas genéticas, la educación y el asesoramiento se centran en los siguientes aspectos:
- Interpretación de los resultados de las pruebas.
- Explicación de pruebas adicionales para aclarar el riesgo (por ejemplo, pruebas de reordenamientos grandes y pruebas de otros genes según la lista de diagnóstico diferencial de síndromes de cáncer en el paciente).
- Evaluación de las respuestas emocionales y conductuales a los resultados de las pruebas genéticas.
- Recomendaciones de afrontamiento y estrategias de comunicación para abordar aspectos del riesgo de cáncer.
- Recomendaciones sobre el control del riesgo de cáncer.
- Análisis del riesgo y comunicación de los resultados del riesgo a los familiares.
A veces el proceso de asesoramiento conlleva varias consultas para abordar los aspectos médicos, las pruebas genéticas y los temas de apoyo psicosocial. Antes y después de las consultas, se dedica tiempo a la preparación del caso para revisar la información de la historia clínica, completar la documentación del caso, buscar información sobre el diagnóstico diferencial, identificar los laboratorios apropiados para obtener las pruebas genéticas, encontrar grupos de apoyo para el paciente y recursos de investigación, además de comunicarse o solicitar la derivación a otros especialistas.[
La información sobre el riesgo hereditario de cáncer está aumentando rápido. Es posible que a medida que surge nueva información, se deban revisar muchos de los temas tratados durante una consulta de asesoramiento. Al final del proceso de orientación, se suele recordar a las personas sobre la posibilidad de que la investigación futura proporcione opciones novedosas o información nueva sobre el riesgo. Es posible que se indique a las personas que consulten con un proveedor de atención de la salud periódicamente para determinar si hay información nueva que indique otra sesión de asesoramiento. La hay obligación de los proveedores de atención de la salud de comunicarse con las personas cuando se dispone de nuevas opciones de tratamiento o pruebas genéticas es objeto de controversia.[
Métodos de presentación del riesgo
El uso de probabilidad para comunicar el riesgo quizás exagere la certeza del riesgo; esto es especialmente cierto cuando las estimaciones del riesgo tienen intervalos de confianza amplios o cuando el paciente tiene características que difieren mucho de las características de la muestra en la que se basó la estimación del riesgo. Por último, hay grandes variaciones en el grado de comprensión de los conceptos matemáticos. Por las razones anteriores, la comunicación del riesgo de múltiples maneras, con ejemplos numéricos y verbales, y la exposición de advertencias importantes, tal vez sea una estrategia útil para aumentar la comprensión del riesgo. El formato numérico que facilita la comprensión es el de las frecuencias naturales porque incluye información sobre el denominador, el grupo de referencia que alude a la persona. En general, se deben evitar las escalas logarítmicas.[
La comunicación del riesgo puede ser numérica o visual. El uso de múltiples estrategias quizás aumente la comprensión y la retención de la información sobre el riesgo genético de cáncer.[
Estrategias de comunicación
En estudios se han examinado nuevos canales para comunicar la información sobre el riesgo genético de cáncer, administrar apoyo psicosocial y estandarizar el proceso de asesoramiento genético para las personas con un aumento del riesgo de cáncer.[
En un estudio prospectivo se evaluaron los efectos de una ayuda de apoyo para la toma de decisiones presentada en CD-ROM para las pruebas de inestabilidad microsatelital (IMS) del cáncer colorrectal en 239 pacientes con cáncer colorrectal que cumplieron con los criterios de Bethesda revisados, pero no con los criterios de Ámsterdam.[
Otras estrategias innovadoras son los materiales educativos y la tecnología informática interactiva. En un estudio, se desarrolló una ayuda de comunicación de 13 páginas en color con diversos formatos para representar el riesgo, como gráficas y descripciones verbales.[
La videoconferencia es una estrategia innovadora para facilitar las sesiones de asesoramiento genético con los clientes que no pueden viajar a entornos clínicos especializados. En 37 personas en el Reino Unido, se comparó el uso de videoconferencia en tiempo real con las sesiones de asesoramiento presenciales; se encontró que ambos métodos mejoran los conocimientos y reducen los niveles de ansiedad.[
Educación posterior a las pruebas y comunicación de los resultados
El asesoramiento posterior a la prueba a veces abarca la consideración de las implicaciones de los resultados de las pruebas para los familiares. Se ha sugerido que algunas personas afectadas por un trastorno hereditario aceptan las pruebas genéticas para obtener información que puedan compartir con los familiares. Hay evidencia de que la implementación de un programa de seguimiento del asesoramiento con el probando, después de que se revelan los resultados de las pruebas, aumenta de manera significativa la proporción de familiares informados del riesgo genético. El seguimiento del asesoramiento quizás abarque conversaciones telefónicas con el probando para verificar con qué familiares se ha comunicado y el ofrecimiento de ayuda para comunicar la información a los familiares.[
Cuando el resultado de una prueba es negativo, la sesión posterior a la prueba tal vez sea más breve. Sin embargo, es importante analizar las implicaciones genéticas, médicas y psicológicas de un resultado negativo en una familia con una variante patogénica conocida. Por ejemplo, es esencial que la persona entienda que los riesgos poblacionales generales para los tipos de cáncer relevantes todavía aplican; además, el riesgo individual de cáncer sigue modificándose por otros factores de riesgo y por la historia familiar del otro lado de la familia. Además, es posible que las personas exhiban estrés patológico incluso cuando la prueba es negativa. Este resultado se ha documentado en el contexto de las pruebas de variantes patogénicas en BRCA1 o BRCA2[
Muchas personas se benefician del seguimiento del asesoramiento y de una consulta con especialistas médicos después de la comunicación de los resultados de las pruebas genéticas. Esto brinda la oportunidad de analizar más a fondo los sentimientos acerca del riesgo, las opciones para el control del riesgo, incluso los exámenes y procedimientos de detección, además de las implicaciones de los resultados de las pruebas para otros familiares. Por ejemplo, en un ensayo controlado aleatorizado del estándar de atención en 100 mujeres portadoras de variantes de BRCA1 o BRCA2, se encontraron resultados psicológicos positivos y mejora de la calidad del sueño en quienes participaron en la intervención de 12 semanas Inquiry-Based Stress Reduction (IBSR). En este estudio, los desenlaces se midieron 24 a 26 semanas después de la intervención IBSR.[
Referencias:
- Baker DL, Schuette JL, Uhlmann WR, eds.: A Guide to Genetic Counseling. Wiley-Liss, 1998.
- Hirschhorn K, Fleisher LD, Godmilow L, et al.: Duty to re-contact. Genet Med 1 (4): 171-2, 1999 May-Jun.
- Offit K, Thom P: Ethicolegal aspects of cancer genetics. Cancer Treat Res 155: 1-14, 2010.
- Lipkus IM: Numeric, verbal, and visual formats of conveying health risks: suggested best practices and future recommendations. Med Decis Making 27 (5): 696-713, 2007 Sep-Oct.
- Ancker JS, Senathirajah Y, Kukafka R, et al.: Design features of graphs in health risk communication: a systematic review. J Am Med Inform Assoc 13 (6): 608-18, 2006 Nov-Dec.
- Schapira MM, Nattinger AB, McHorney CA: Frequency or probability? A qualitative study of risk communication formats used in health care. Med Decis Making 21 (6): 459-67, 2001 Nov-Dec.
- Ghosh K, Crawford BJ, Pruthi S, et al.: Frequency format diagram and probability chart for breast cancer risk communication: a prospective, randomized trial. BMC Womens Health 8: 18, 2008.
- Green MJ, Peterson SK, Baker MW, et al.: Effect of a computer-based decision aid on knowledge, perceptions, and intentions about genetic testing for breast cancer susceptibility: a randomized controlled trial. JAMA 292 (4): 442-52, 2004.
- Fransen M, Meertens R, Schrander-Stumpel C: Communication and risk presentation in genetic counseling. Development of a checklist. Patient Educ Couns 61 (1): 126-33, 2006.
- Wang C, Gonzalez R, Milliron KJ, et al.: Genetic counseling for BRCA1/2: a randomized controlled trial of two strategies to facilitate the education and counseling process. Am J Med Genet A 134 (1): 66-73, 2005.
- Lobb EA, Butow PN, Moore A, et al.: Development of a communication aid to facilitate risk communication in consultations with unaffected women from high risk breast cancer families: a pilot study. J Genet Couns 15 (5): 393-405, 2006.
- Mackay J, Schulz P, Rubinelli S, et al.: Online patient education and risk assessment: project OPERA from Cancerbackup. Putting inherited breast cancer risk information into context using argumentation theory. Patient Educ Couns 67 (3): 261-6, 2007.
- Green MJ, Peterson SK, Baker MW, et al.: Use of an educational computer program before genetic counseling for breast cancer susceptibility: effects on duration and content of counseling sessions. Genet Med 7 (4): 221-9, 2005.
- Coelho JJ, Arnold A, Nayler J, et al.: An assessment of the efficacy of cancer genetic counselling using real-time videoconferencing technology (telemedicine) compared to face-to-face consultations. Eur J Cancer 41 (15): 2257-61, 2005.
- Lea DH, Johnson JL, Ellingwood S, et al.: Telegenetics in Maine: Successful clinical and educational service delivery model developed from a 3-year pilot project. Genet Med 7 (1): 21-7, 2005.
- Voorwinden JS, Jaspers JP, ter Beest JG, et al.: The introduction of a choice to learn pre-symptomatic DNA test results for BRCA or Lynch syndrome either face-to-face or by letter. Clin Genet 81 (5): 421-9, 2012.
- Hall MJ, Manne SL, Winkel G, et al.: Effects of a decision support intervention on decisional conflict associated with microsatellite instability testing. Cancer Epidemiol Biomarkers Prev 20 (2): 249-54, 2011.
- Zilliacus EM, Meiser B, Lobb EA, et al.: Are videoconferenced consultations as effective as face-to-face consultations for hereditary breast and ovarian cancer genetic counseling? Genet Med 13 (11): 933-41, 2011.
- Forrest LE, Burke J, Bacic S, et al.: Increased genetic counseling support improves communication of genetic information in families. Genet Med 10 (3): 167-72, 2008.
- Hamann HA, Smith TW, Smith KR, et al.: Interpersonal responses among sibling dyads tested for BRCA1/BRCA2 gene mutations. Health Psychol 27 (1): 100-9, 2008.
- Landau C, Novak AM, Ganz AB, et al.: Effect of Inquiry-Based Stress Reduction on Well-being and Views on Risk-Reducing Surgery Among Women With BRCA Variants in Israel: A Randomized Clinical Trial. JAMA Netw Open 4 (12): e2139670, 2021.
Prestación del servicio de genética del cáncer
Modalidades de asesoramiento genético
La evaluación del riesgo de cáncer y el asesoramiento es un proceso de varios pasos que tradicionalmente incluía una consulta de asesoramiento en persona antes y después de la prueba. En un esfuerzo por superar las barreras de acceso, se han implementado otras modalidades, como sesiones grupales, asesoramiento telefónico y asesoramiento genético virtual mediante videoconferencia, que a menudo se conoce como telegenética.[
Asesoramiento genético telefónico
En una revisión sistemática se identificaron 13 estudios publicados en los que se utilizó un diseño de ensayo controlado aleatorizado para comparar los desenlaces, previos y posteriores a la prueba, del asesoramiento genético en persona y telefónico. Se encontró que el desenlace de conocimiento y el desenlace psicosocial (por ejemplo, estrés patológico) no fueron inferiores, fueron equivalentes o las diferencias no fueron estadísticamente significativas entre el asesoramiento telefónico y el asesoramiento en persona. En 2 estudios se demostró una intención de someterse a las pruebas o aceptación de las pruebas más baja entre los participantes que recibieron asesoramiento telefónico. En la mayoría de los estudios tampoco se encontraron diferencias en la satisfacción; sin embargo, en 2 estudios se observó una satisfacción más alta entre las personas que recibieron asesoramiento genético telefónico en comparación con las que participaron del asesoramiento genético en persona.[
Otro grupo notificó los resultados de un estudio en el que todos los participantes (N = 1178) asistieron a una consulta presencial de asesoramiento previo a las pruebas en 1 de 5 centros participantes. Los resultados de los participantes que aceptaron ser aleatorizados se revelaron por teléfono (n = 401) o en persona (n = 418). En particular, un 30 % de los participantes en este estudio se sometieron a análisis multigénico. En este ensayo, la comunicación telefónica no fue inferior a la comunicación en persona cuando se compararon los resultados psicosociales primarios (por ejemplo, ansiedad general y estado de ansiedad). En el análisis primario, el conocimiento no alcanzó el umbral de ausencia de inferioridad sin imputar los datos faltantes. Los resultados secundarios relacionados con el estrés patológico del cáncer, la depresión, la incertidumbre, la satisfacción con las pruebas genéticas y las intenciones conductuales para las estrategias de control del riesgo no fueron estadísticamente significativas entre los grupos.[
Asesoramiento genético por video
En los estudios también se ha examinado el uso del asesoramiento genético virtual mediante videoconferencia (telegenética) como alternativa al asesoramiento genético en persona y se demostró un aumento del conocimiento del paciente, altos niveles de satisfacción y mínimos desenlaces psicosociales negativos.[
Modelos de prestación del servicio de genética
Se han examinado nuevos abordajes para la prestación de servicios de genética clínica con el fin de promover el acceso al asesoramiento genético y las pruebas. Estos abordajes se han utilizado para racionalizar el proceso de identificación de las personas de riesgo alto o afectadas que se derivan a los servicios especializados de genética para evaluación complementaria. Estos modelos de prestación de servicios varían en cuanto a los procesos de educación genética, asesoramiento y obtención de pruebas. Cada vez es más frecuente que el asesoramiento genético se lleve a cabo después de la prueba genética.
Varios factores han contribuido a obtener la prueba genética sin asesoramiento genético previo. Estos factores son los siguientes: 1) ampliación de los criterios para indicar una prueba genética, lo que conlleva mayor demanda; 2) más indicaciones para las pruebas en el momento del diagnóstico de cáncer porque la detección de una variante patogénica a veces repercute en las opciones de tratamiento (por ejemplo, uso de inhibidores de la poli-[ADP-ribosa]–polimerasa [PARP] en pacientes con cáncer de mama, cáncer de ovario o cáncer de páncreas metastásico negativo para el receptor 2 del factor de crecimiento epidérmico humano y positivos para BRCA2 o BRCA1); 3) aumento del número de pacientes que se somete a pruebas genómicas tumorales para guiar el tratamiento, lo que a veces se complementa con pruebas confirmatorias en la línea germinal; 4) aumento de la disponibilidad de pruebas de uso generalizado (por ejemplo, para pacientes con cáncer de ovario, cáncer páncreas y cáncer de próstata), y pruebas genéticas dirigidas al consumidor. Algunas indicaciones han dado lugar a que los proveedores de atención médica ofrezcan pruebas genéticas a pacientes en un entorno que no es el de la especialidad genética (por ejemplo, por parte de proveedores de atención primaria, cirujanos u oncólogos), a lo que a veces le sigue la interpretación del resultado y el asesoramiento por parte de un especialista en genética o del proveedor.
Divulgación dirigida y pruebas a poblaciones de riesgo alto
A las poblaciones de riesgo alto, como las de ascendencia judía asquenazí, se les pueden ofrecer pruebas genéticas a través de la divulgación dirigida y programas de detección poblacional sin asesoramiento previo a las pruebas, o mediante un proceso de educación simplificado que proporcione materiales escritos o de otro tipo.[
En un estudio de los Estados Unidos se implementó la difusión comunitaria y la educación interactiva y virtual previa a las pruebas (a través de un chatbot y videos educativos) para personas con ascendencia judía asquenazí (es decir, que tenían al menos un abuelo o abuela de origen judío asquenazí). Luego, se ofreció a los participantes pruebas genéticas para las 3 variantes patogénicas fundadoras de los judíos asquenazíes en los genes BRCA1 o BRCA2. En el estudio se notificó una tasa de aceptación de las pruebas genéticas del 79 % entre los participantes.[
Abordajes de pruebas genéticas germinales de uso generalizado en oncología
Las pruebas genéticas germinales de uso generalizado ahora son una práctica estándar en los pacientes con ciertos cánceres, como el cáncer epitelial de ovario, el cáncer de páncreas exocrino y el cáncer de próstata metastásico.[
Desde hace tiempo existen directrices de uso generalizado para las pruebas genéticas germinales en los pacientes de cáncer de ovario. En guías nacionales de los Estados Unidos [
En respuesta, se han realizado esfuerzos para implementar pruebas germinales de uso generalizado para las pacientes con cáncer, incluso integrar servicios genéticos en la atención oncológica del paciente.[
Servicios de genética integrados
En algunos estudios se ha examinado el efecto de la inclusión de un asesor genético de cáncer en las clínicas de oncología ginecológica en un esfuerzo por aumentar la derivación y el uso del asesoramiento genético en las mujeres afectadas.[
Modelos de atención convencionales o mediados por oncología
Otros esfuerzos para el uso generalizado de pruebas genéticas se han centrado en modelos de atención convencionales o mediados por oncología en los que los oncólogos proporcionan educación y asesoramiento antes de las pruebas, obtienen el consentimiento informado, realizan pruebas genéticas y entregan los resultados negativos de estas pruebas, con la posibilidad de seleccionar y derivar a asesores genéticos a aquellos pacientes con resultados positivos o con variantes de significación incierta.[
En una revisión sistemática se describieron los resultados de 11 estudios de pruebas genéticas de la línea germinal para el cáncer dirigidas por proveedores de oncología.[
Modelos convencionales en la atención primaria
También se están implementando abordajes convencionales en las prácticas no oncológicas. Por ejemplo, en un estudio de 5 consultorios de obstetricia y ginecología comunitarios, se capacitó a los médicos en la evaluación del riesgo de cáncer hereditario. Los consultorios también modificaron los exámenes de detección de las pacientes y los flujos de trabajo. Después de 8 semanas de implementación del flujo de trabajo modificado, se evaluó el riesgo hereditario de cáncer en el 92,8 % (3811/4107) de las pacientes y el 23,8 % (906/3811) de ellas cumplieron con las directrices de la National Comprehensive Cancer Network (NCCN) para obtener pruebas genéticas. Sus profesionales clínicos ofrecieron pruebas genéticas al 89,7 % (813/906) de las mujeres que cumplieron con los criterios de las directrices NCCN. En general, un 26,7 % (219/813) de las mujeres suministraron muestras para las pruebas y un 20 % (165/813) obtuvo resultados. La satisfacción con el proceso fue alta (~97 %).[
Evaluación de los servicios de proveedores de atención no especializados en genética
Cada vez se emplean más proveedores no especializados en genética que reciben capacitación en genética del cáncer, para participar en modelos de evaluación de priorización, con el fin de aumentar el acceso a los servicios de genética del cáncer. Es posible que estos proveedores participen en diferentes momentos a lo largo del proceso de evaluación del riesgo, asesoramiento y pruebas.[
Referencias:
- Ormond K: Recommendations for telephone counseling. J Genet Couns 9 (1): 63-71, 2000.
- Sangha K: Assessment of the effectiveness of genetic counseling by telephone compared to a clinic visit. J Genet Couns 12 (2): 171-84, 2003.
- Calzone KA, Prindiville SA, Jourkiv O, et al.: Randomized comparison of group versus individual genetic education and counseling for familial breast and/or ovarian cancer. J Clin Oncol 23 (15): 3455-64, 2005.
- Jenkins J, Calzone KA, Dimond E, et al.: Randomized comparison of phone versus in-person BRCA1/2 predisposition genetic test result disclosure counseling. Genet Med 9 (8): 487-95, 2007.
- Peshkin BN, Demarco TA, Graves KD, et al.: Telephone genetic counseling for high-risk women undergoing BRCA1 and BRCA2 testing: rationale and development of a randomized controlled trial. Genet Test 12 (1): 37-52, 2008.
- Zilliacus EM, Meiser B, Lobb EA, et al.: Women's experience of telehealth cancer genetic counseling. J Genet Couns 19 (5): 463-72, 2010.
- Rothwell E, Kohlmann W, Jasperson K, et al.: Patient outcomes associated with group and individual genetic counseling formats. Fam Cancer 11 (1): 97-106, 2012.
- Platten U, Rantala J, Lindblom A, et al.: The use of telephone in genetic counseling versus in-person counseling: a randomized study on counselees' outcome. Fam Cancer 11 (3): 371-9, 2012.
- Benusiglio PR, Di Maria M, Dorling L, et al.: Hereditary breast and ovarian cancer: successful systematic implementation of a group approach to genetic counselling. Fam Cancer 16 (1): 51-56, 2017.
- Fournier DM, Bazzell AF, Dains JE: Comparing Outcomes of Genetic Counseling Options in Breast and Ovarian Cancer: An Integrative Review . Oncol Nurs Forum 45 (1): 96-105, 2018.
- Schwartz MD, Valdimarsdottir HB, Peshkin BN, et al.: Randomized noninferiority trial of telephone versus in-person genetic counseling for hereditary breast and ovarian cancer. J Clin Oncol 32 (7): 618-26, 2014.
- Kinney AY, Steffen LE, Brumbach BH, et al.: Randomized Noninferiority Trial of Telephone Delivery of BRCA1/2 Genetic Counseling Compared With In-Person Counseling: 1-Year Follow-Up. J Clin Oncol 34 (24): 2914-24, 2016.
- Kinney AY, Butler KM, Schwartz MD, et al.: Expanding access to BRCA1/2 genetic counseling with telephone delivery: a cluster randomized trial. J Natl Cancer Inst 106 (12): , 2014.
- Athens BA, Caldwell SL, Umstead KL, et al.: A Systematic Review of Randomized Controlled Trials to Assess Outcomes of Genetic Counseling. J Genet Couns 26 (5): 902-933, 2017.
- Peshkin BN, Kelly S, Nusbaum RH, et al.: Patient Perceptions of Telephone vs. In-Person BRCA1/BRCA2 Genetic Counseling. J Genet Couns 25 (3): 472-82, 2016.
- Bradbury AR, Patrick-Miller LJ, Egleston BL, et al.: Randomized Noninferiority Trial of Telephone vs In-Person Disclosure of Germline Cancer Genetic Test Results. J Natl Cancer Inst 110 (9): 985-993, 2018.
- Otten E, Birnie E, Ranchor AV, et al.: Telegenetics use in presymptomatic genetic counselling: patient evaluations on satisfaction and quality of care. Eur J Hum Genet 24 (4): 513-20, 2016.
- Buchanan AH, Datta SK, Skinner CS, et al.: Randomized Trial of Telegenetics vs. In-Person Cancer Genetic Counseling: Cost, Patient Satisfaction and Attendance. J Genet Couns 24 (6): 961-70, 2015.
- Bradbury A, Patrick-Miller L, Harris D, et al.: Utilizing Remote Real-Time Videoconferencing to Expand Access to Cancer Genetic Services in Community Practices: A Multicenter Feasibility Study. J Med Internet Res 18 (2): e23, 2016.
- Solomons NM, Lamb AE, Lucas FL, et al.: Examination of the Patient-Focused Impact of Cancer Telegenetics Among a Rural Population: Comparison with Traditional In-Person Services. Telemed J E Health 24 (2): 130-138, 2018.
- Lieberman S, Tomer A, Ben-Chetrit A, et al.: Population screening for BRCA1/BRCA2 founder mutations in Ashkenazi Jews: proactive recruitment compared with self-referral. Genet Med 19 (7): 754-762, 2017.
- Metcalfe KA, Poll A, Royer R, et al.: Screening for founder mutations in BRCA1 and BRCA2 in unselected Jewish women. J Clin Oncol 28 (3): 387-91, 2010.
- Metcalfe KA, Mian N, Enmore M, et al.: Long-term follow-up of Jewish women with a BRCA1 and BRCA2 mutation who underwent population genetic screening. Breast Cancer Res Treat 133 (2): 735-40, 2012.
- Gronwald J, Huzarski T, Byrski T, et al.: Direct-to-patient BRCA1 testing: the Twoj Styl experience. Breast Cancer Res Treat 100 (3): 239-45, 2006.
- Morgan KM, Hamilton JG, Symecko H, et al.: Targeted BRCA1/2 population screening among Ashkenazi Jewish individuals using a web-enabled medical model: An observational cohort study. Genet Med 24 (3): 564-575, 2022.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 2.2024. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023.
Available online with free registration. Last accessed September 18, 2024. - Society of Gynecologic Oncology: SGO Clinical Practice Statement: Genetic Testing for Ovarian Cancer. 2014.
Available online . Last accessed December 9, 2024. - Marth C, Hubalek M, Petru E, et al.: AGO Austria recommendations for genetic testing of patients with ovarian cancer. Wien Klin Wochenschr 127 (15-16): 652-4, 2015.
- Vergote I, Banerjee S, Gerdes AM, et al.: Current perspectives on recommendations for BRCA genetic testing in ovarian cancer patients. Eur J Cancer 69: 127-134, 2016.
- McCuaig JM, Stockley TL, Shaw P, et al.: Evolution of genetic assessment for BRCA-associated gynaecologic malignancies: a Canadian multisociety roadmap. J Med Genet 55 (9): 571-577, 2018.
- Zhang S, Royer R, Li S, et al.: Frequencies of BRCA1 and BRCA2 mutations among 1,342 unselected patients with invasive ovarian cancer. Gynecol Oncol 121 (2): 353-7, 2011.
- Kurian AW, Ward KC, Howlader N, et al.: Genetic Testing and Results in a Population-Based Cohort of Breast Cancer Patients and Ovarian Cancer Patients. J Clin Oncol 37 (15): 1305-1315, 2019.
- Lin J, Sharaf RN, Saganty R, et al.: Achieving universal genetic assessment for women with ovarian cancer: Are we there yet? A systematic review and meta-analysis. Gynecol Oncol 162 (2): 506-516, 2021.
- Scheinberg T, Young A, Woo H, et al.: Mainstream consent programs for genetic counseling in cancer patients: A systematic review. Asia Pac J Clin Oncol 17 (3): 163-177, 2021.
- Kentwell M, Dow E, Antill Y, et al.: Mainstreaming cancer genetics: A model integrating germline BRCA testing into routine ovarian cancer clinics. Gynecol Oncol 145 (1): 130-136, 2017.
- Senter L, O'Malley DM, Backes FJ, et al.: Genetic consultation embedded in a gynecologic oncology clinic improves compliance with guideline-based care. Gynecol Oncol 147 (1): 110-114, 2017.
- Bednar EM, Oakley HD, Sun CC, et al.: A universal genetic testing initiative for patients with high-grade, non-mucinous epithelial ovarian cancer and the implications for cancer treatment. Gynecol Oncol 146 (2): 399-404, 2017.
- Rana HQ, Kipnis L, Hehir K, et al.: Embedding a genetic counselor into oncology clinics improves testing rates and timeliness for women with ovarian cancer. Gynecol Oncol 160 (2): 457-463, 2021.
- Colombo N, Huang G, Scambia G, et al.: Evaluation of a Streamlined Oncologist-Led BRCA Mutation Testing and Counseling Model for Patients With Ovarian Cancer. J Clin Oncol 36 (13): 1300-1307, 2018.
- McCuaig JM, Thain E, Malcolmson J, et al.: A Comparison of Patient-Reported Outcomes Following Consent for Genetic Testing Using an Oncologist- or Genetic Counselor-Mediated Model of Care. Curr Oncol 28 (2): 1459-1471, 2021.
- Richardson M, Min HJ, Hong Q, et al.: Oncology Clinic-Based Hereditary Cancer Genetic Testing in a Population-Based Health Care System. Cancers (Basel) 12 (2): , 2020.
- DeFrancesco MS, Waldman RN, Pearlstone MM, et al.: Hereditary Cancer Risk Assessment and Genetic Testing in the Community-Practice Setting. Obstet Gynecol 132 (5): 1121-1129, 2018.
- DeTroye A, Gabbett K, Yi C, et al.: Genetic testing for patients at risk of hereditary breast and ovarian cancer. JAAPA 35 (10): 48-52, 2022.
- Cohen SA, Nixon DM: A collaborative approach to cancer risk assessment services using genetic counselor extenders in a multi-system community hospital. Breast Cancer Res Treat 159 (3): 527-34, 2016.
- Walker EJ, Goldberg D, Gordon KM, et al.: Implementation of an Embedded In-Clinic Genetic Testing Station to Optimize Germline Testing for Patients with Pancreatic Adenocarcinoma. Oncologist 26 (11): e1982-e1991, 2021.
Implicaciones éticas, legales y sociales
Deber de advertir: Consideraciones relativas a la comunicación por parte del profesional de la salud de la información genética del paciente a los familiares en riesgo
La identificación del riesgo de cáncer hereditario en los pacientes, a través de un abordaje basado en el árbol genealógico, el diagnóstico clínico o los resultados de las pruebas genéticas, tiene implicaciones para los pacientes y sus familiares biológicos. Uno de los componentes principales del asesoramiento genético, según la recomendación de muchas sociedades médicas profesionales, es informar a los pacientes sobre el riesgo familiar y fomentar el diálogo entre familiares.[
Cuando los pacientes no informan a sus familiares en riesgo sobre el riesgo genético potencialmente modificable (por ejemplo, variantes patogénicas en genes de riesgo alto como BRCA1 o BRCA2) o no autorizan al proveedor para compartir estos resultados, es posible que los proveedores se enfrenten a un dilema sobre su deber de advertir a los familiares. Varios aspectos éticos y legales afectan las decisiones sobre la responsabilidad de los proveedores de informar directamente a los familiares en riesgo sobre el riesgo de cáncer hereditario.
Si un proveedor está considerando invalidar la confidencialidad del paciente o el consentimiento para notificar directamente a sus familiares sobre la información genética, es importante considerar una consulta con una o más de las siguientes opciones: especialistas en ética, comité de ética, asesor legal, funcionario responsable de la privacidad y, si procede, consejo de revisión institucional, con el fin de garantizar el cumplimiento de las normas éticas locales, así como de los requisitos legales, normativos y de privacidad.
Consideraciones sobre el deber de advertir
Se recomienda a los pacientes a que compartan con sus familiares en riesgo la información de los resultados de las pruebas genéticas que indiquen la presencia de variantes patogénicas o probablemente patogénicas. Esto es especialmente importante cuando los pacientes tienen variantes de riesgo de moderado a alto que se relacionan con un aumento del riesgo de cáncer y es posible que esto influya en la decisión de realizar exámenes de detección del cáncer y en las conductas de reducción del riesgo.
Hay controversia sobre si es responsabilidad del proveedor de atención de la salud notificar a los familiares en riesgo cuando el paciente con una variante patogénica se niega a hacerlo.[
- Hay una probabilidad alta de daño si no se advierte a los familiares.
- La amenaza del riesgo de enfermedad es previsible e inminente.
- La enfermedad o afección es prevenible o tratable.
- El paciente, a pesar del apoyo, se niega a informar a los familiares.
- El daño de la no comunicación es mayor que el daño de la comunicación.
- Los familiares en riesgo son identificables y abarcan, entre otros, familiares de primero, segundo y tercer grado.
Es infrecuente que un proveedor viole la confidencialidad de un paciente al informar a familiares en riesgo acerca de los resultados de una prueba genética.
A veces, el paciente se niega a informar a los familiares, pero autoriza al proveedor para que se comunique directamente con los familiares en riesgo. En estos casos, es importante documentar el consentimiento del paciente y considerar el método óptimo para comunicarse con los familiares, así como los recursos del proveedor para hacer seguimiento a estas solicitudes.[
Es posible que muchos proveedores no conozcan la identidad de los familiares en riesgo. Y que tampoco puedan obtener o confirmar la información de contacto de un familiar si se obtuvo de fuentes públicas. Por lo tanto, el deber de advertir conlleva dilemas que surgen con mayor frecuencia cuando un proveedor o una institución de atención médica están a cargo de la atención de más de una persona de la misma familia, o cuando el proveedor ya se ha puesto en contacto con los familiares del paciente.
Para obtener más información en inglés sobre cómo informar a los familiares en riesgo, consultar la sección
Jurisprudencia sobre el deber de advertir
Hay muy pocos precedentes legales que orienten sobre el deber de advertir directamente a los familiares como responsabilidad del paciente o del proveedor. Los dos casos más notorios sobre el riesgo de cáncer hereditario, Pate v Threlkel (acerca del cáncer medular de tiroides) y Safer v Pack (acerca de la poliposis adenomatosa familiar), son antiguos (1995 y 1996, respectivamente) y quizás solo tengan relevancia en los estados en los que se adjudicó cada caso (Florida y Nueva Jersey, respectivamente).[
Orientación y marco legal o legislativo sobre el deber de advertir
Al decidir si hay deber de advertir a los familiares en riesgo, es importante equilibrar las construcciones bioéticas de beneficencia, no maleficencia (proporcionar beneficios y evitar daños, respectivamente) y autonomía, con otros factores como las recomendaciones de las sociedades profesionales, la legislación estatal y federal, y las acciones judiciales de varios estados. La definición de la información genética (relacionada con el riesgo hereditario) varía según el caso legal y el lenguaje utilizado en la legislación estatal y federal, aunque por lo general abarca la información sobre las pruebas genéticas, así como la información de la historia familiar. La siguiente información se refiere a la orientación en los Estados Unidos, ya que hay variabilidad en las perspectivas y políticas internacionales.[
Recomendaciones de las sociedades profesionales sobre el deber de advertir
Muchas sociedades médicas profesionales y organismos gubernamentales han publicado su posición y recomendaciones sobre la comunicación entre un proveedor de atención de la salud y los familiares de un paciente en relación con la comunicación del riesgo genético. Varias organizaciones como la
Leyes federales y estatales sobre el deber de advertir
A nivel federal, hay políticas estrictas de confidencialidad que rigen la información privada de salud.[
- Existe una amenaza grave o inminente para la salud o la seguridad de una persona o del público.
- La amenaza constituye una amenaza inminente y grave para un tercero identificable.
- El médico tiene la capacidad de evitar daño significativo.
Además, la HIPAA contiene un estándar mínimo necesario, lo que significa que las entidades sujetas a tales regulaciones solo pueden solicitar y recibir información relevante para un propósito específico.[
A nivel estatal, hay una variabilidad significativa en los estatutos en cuanto a la privacidad genética y cuándo, cómo, por quién y a quién se puede divulgar la información genética.[
Si hay una pregunta sobre si es apropiado violar la confidencialidad del paciente para advertir a los familiares, es importante revisar estas normas, así como la jurisprudencia federal con un especialista en ética, un comité ético, un asesor legal, o el funcionario responsable de la privacidad para asegurar que se cumplen con los estándares éticos locales, además de los requisitos legales, regulatorios y de privacidad.
Consideraciones sobre el deber de advertir en casos de personas fallecidas
En la sección anterior se aborda principalmente el deber de advertir a los familiares cuando un paciente vivo no está dispuesto a hacerlo. Sin embargo, también hay preocupación sobre la comunicación de los resultados de las pruebas genéticas de difuntos. Esta preocupación surge en contextos de investigación relacionados con hallazgos específicos de la investigación (es decir, hallazgos directamente vinculados con el estudio) o hallazgos secundarios, de biobancos y en contextos clínicos.[
En la práctica clínica, el deber de advertir sobre los resultados de las pruebas genéticas de una persona que falleció surge cuando se obtienen las pruebas como parte de una autopsia (por ejemplo, se identifica una causa hereditaria de muerte súbita de origen cardíaco).[
- Cuando el paciente de cáncer muere antes obtener los resultados de las pruebas en la línea germinal o antes de que se comunicaran los resultados al paciente, y el resultado es positivo para una variante patogénica o variante probablemente patogénica en un gen de riesgo alto como TP53, BRCA1, BRCA2 o en otros genes relacionados con el síndrome de Lynch.
- Cuando se actualiza la clasificación de una variante de significado incierto a una variante patogénica o variante probablemente patogénica, y el paciente no alcanzó a recibir la información actualizada mientras estaba vivo.
- Cuando los familiares en riesgo solicitan el resultado de las pruebas del difunto para tomar decisiones personales fundamentadas en los resultados de las pruebas.
En previsión de estos posibles escenarios, algunos proveedores especializados en genética pueden pedir a los pacientes que firmen un formulario en el que se indique qué personas pueden acceder a los resultados de las pruebas genéticas.[
La HIPAA es una ley federal que rige la información de salud protegida de personas vivas y muertas.[
Es importante comunicarse con un funcionario responsable de la privacidad o un asesor legal antes de divulgar los resultados de las pruebas a los familiares de una persona fallecida. Los funcionarios responsables de la privacidad determinan la documentación exigida (por ejemplo, demostrar quién es o era el representante personal del difunto), las normas específicas aplicables y si el difunto otorgó permiso para compartir los resultados de las pruebas genéticas. Además, se puede consultar a un especialista en ética, un comité de ética y, si procede, un consejo de revisión institucional para asegurar el cumplimiento de las normas éticas locales, así como de los requisitos legales, reglamentarios y de privacidad.
Deber de advertir versus deber de auxiliar
Por lo general, el deber de advertir se refiere a la posible responsabilidad de notificar a los familiares biológicos en riesgo, como hijos y hermanos del paciente, sobre un riesgo hereditario importante. Sin embargo, más recientemente, se han planteado preguntas sobre el deber de advertir o el deber de auxiliar a la persona que se sometió a las pruebas cuando se identifican hallazgos genómicos secundarios o se obtienen resultados aplicables que no se buscaron cuando se solicitaron las pruebas.[
Por ejemplo, el American College of Medical Genetics and Genomics (ACMG) recomienda que las variantes patogénicas en
El ACMG también recomienda que las personas se sometan a un proceso de consentimiento informado que les permita optar por no recibir hallazgos secundarios.[
Sin embargo, para muchos de los genes de la lista del ACMG, el ACMG y otras organizaciones reconocen la incertidumbre potencial sobre la penetrancia y, por consiguiente, sobre el tratamiento médico recomendado para las personas que obtienen un resultado positivo en la prueba y no tienen antecedentes personales o familiares relevantes.[
A la luz de las complejidades asociadas con los posibles resultados de la secuenciación genómica, entre los métodos para acordar con los pacientes el tipo de resultados que les gustaría recibir quizás se incluya una conversación sobre la variedad de resultados posibles en lugar de una descripción de las implicaciones médicas de las variantes patogénicas de un grupo de genes específico.[
Por ejemplo, las variantes patogénicas se pueden clasificar como aplicables para la atención médica, como las identificadas en los genes BRCA1, BRCA2 o MSH2. Es posible que otras variantes cuenten con validez clínica, pero que se vinculen con un rango de riesgo; estas variantes quizás tengan una utilidad clínica limitada a circunstancias específicas, como las siguientes:
- Algunas variantes genéticas quizás se asocien con poco aumento del riesgo de cáncer.
- Por lo general, las variantes farmacogenómicas no permiten predecir el riesgo de enfermedad, pero exhiben utilidad clínica para personas que reciben determinados medicamentos.
- Algunas variantes quizás revelen que una persona es portadora de una afección de herencia mendeliana. Es posible que estos resultados no sean relevantes para los pacientes que no tienen hijos o que no tienen planes de tenerlos. Sin embargo, los resultados quizás tengan implicaciones reproductivas para los familiares.
- Es posible que se encuentren variantes de riesgo de penetrancia elevada para las que no hayan muchas opciones útiles para el control de la evolución de la enfermedad o el riesgo (por ejemplo, esclerosis lateral amiotrófica, enfermedad de Lou Gehrig o enfermedad de Alzheimer de inicio temprano).[
46 ]
Otra consideración es que las pruebas somáticas de tumores quizás revelen variantes patogénicas que, si se confirman en la línea germinal, tienen implicaciones en el paciente sometido a la prueba (por ejemplo, con respecto al tratamiento sistémico actual del cáncer y el riesgo de otros cánceres) y en sus familiares.[
Discriminación laboral y durante el aseguramiento
La información genética obtenida de las pruebas de susceptibilidad genética quizás tenga implicaciones médicas, económicas y psicosociales para la persona que se sometió a las pruebas y sus familiares. La posibilidad de discriminación laboral y por parte del seguro médico son preocupaciones frecuentes de las personas que piensan someterse a pruebas genéticas.[
Procedimientos legales, legislación federal y estatal, y recomendaciones de organizaciones profesionales sobre la discriminación laboral y durante el aseguramiento
Se han elaborado leyes estatales y federales para prevenir el uso de la información genética en el ámbito laboral (toma de decisiones de contratación, promoción y salario) y para el acceso a pólizas de seguros (cobertura de seguro de vida y seguro médico) por parte de empleadores, escuelas, organismos gubernamentales y aseguradoras.[
| Ley | Ejemplos de cobertura | Limitaciones clave | ¿Protege a todos los estadounidenses? |
|---|---|---|---|
| USPSTF = United States Preventive Services Task Force. | |||
| a Adaptación de Leib et al.,[ |
|||
| Ley de Derechos Civiles de 1964 |
Solo en el ámbito laboral | No aplica al seguro médico | Sí |
| Se aplica en casos de discriminación a partir de la información genética si se relaciona con raza o grupos étnicos | Una relación sólida entre un cáncer hereditario y un grupo racial o étnico es infrecuente. | ||
| Ley para Estadounidenses con Discapacidades de 1990 |
Discapacidad vinculada con una manifestación de la información genética | No aplica al seguro médico | Sí |
| Ley de Portabilidad y Responsabilidad de Seguros Médicos de 1996 |
Planes grupales de seguro médico | No impide que las aseguradoras exijan pruebas genéticas | Sí |
| No se ha definido la información genética | |||
| Prohíbe excluir a una persona de un plan grupal de seguro médico debido a la información genética | La información genética se puede usar para el aseguramiento | ||
| Prohíbe el aumento de las primas para los diferentes miembros del plan grupal | La comunicación de la información genética no está restringida | ||
| Las afecciones preexistentes no pueden incluir información genética predictiva | No se aplica a los planes de salud individuales, a menos que estén cubiertos por la disposición de portabilidad | ||
| Orden Ejecutiva 13145 de 2000 |
Prohíbe la discriminación genética de los empleados federales | No aplica al seguro médico | No; excluye a los miembros del ejército de los Estados Unidos y a cualquier persona que NO sea un empleado federal |
| Solo rige para empleados federales | |||
| Ley Antidiscriminatoria sobre Información Genética de 2008 (GINA) (decretada en 2009) |
Prohíbe la discriminación genética en el lugar de trabajo y durante el aseguramiento médico | La demanda civil se limita a los casos en los que se han agotado todos los recursos administrativos | No; excluye a los miembros del ejército de los Estados Unidos, los veteranos que obtienen atención médica a través del Departamento de Asuntos de los Veteranos y el Servicio de Salud Indígena |
| Información genética definida en términos generales | |||
| Específico para los planes de seguro grupales e individuales | |||
| Prohíbe el uso de la información genética en el momento del aseguramiento | |||
| Prohíbe que los empleadores y las aseguradoras exijan pruebas genéticas | No cubre los seguros de vida, discapacidad ni atención a largo plazo | ||
| Ley del Cuidado de Salud a Bajo Precio (ACA) (decretada en 2010) |
Los emisores de seguros médicos grupales o individuales deben proporcionar cobertura para todas las personas que lo soliciten | Los planes de salud pueden establecer límites de cobertura para los servicios que no se consideran esenciales | Sí |
| Elimina la preexistencias como razón para excluir de la cobertura | La cobertura de exámenes de detección y medicina preventiva tiene algunas restricciones | ||
| Elimina los límites anuales y de por vida de la cobertura del seguro | La cobertura del asesoramiento genético y las pruebas no se aplica a todas las personas (por ejemplo, no cubre a los hombres, las pruebas para el síndrome de Lynch o a las mujeres que no cumplen con los criterios de las directrices para las pruebas de BRCA1 o BRCA2 publicados por la USPSTF. Para obtener más información en inglés, consultar |
Sí | |
| Limita el costo de la atención médica a cargo del paciente | |||
| Cubre, sin copago, algunos servicios de detección y prevención del cáncer | |||
| Cubre el asesoramiento genético y las pruebas para los genesBRCA1oBRCA2en mujeres que cumplen con ciertos criterios | |||
Ley Antidiscriminatoria sobre Información Genética de 2008 (GINA)
Esta ley federal de los Estados Unidos contiene muchas protecciones contra la discriminación basada en la información genética.[
- Prohíbe el acceso a la información genética personal por parte de las compañías de seguros y los empleadores.
- Prohíbe a las compañías de seguros pedir a los solicitantes de planes médicos individuales o grupales que se sometan a pruebas genéticas o exámenes de detección y les prohíbe discriminar a los solicitantes de planes médicos a partir de la información genética individual.
- Prohíbe a los empleadores usar la información genética para rechazar al postulante y les prohíbe recopilar la información genética de los empleados sin su consentimiento explícito.
- Prohíbe a las agencias de empleo no enviar a un candidato o negarse a recomendarlo a partir de la información genética.[
67 ] - Prohíbe a las organizaciones laborales negarse a aceptar un miembro a partir de la composición genética del postulante.[
67 ] - No exige cobertura para pruebas o tratamientos médicos.[
68 ] - No prohíbe el aseguramiento médico según el estado de salud actual.[
68 ] - No limita al proveedor de atención médica, incluso a aquellos empleados o afiliados a planes de salud, en cuanto a la solicitud de pruebas genéticas o la notificación de resultados a personas.[
69 ] - No prohíbe las pruebas ocupacionales para los programas de monitoreo de sustancias tóxicas, los programas de bienestar patrocinados por el empleador, la administración de leyes federales y estatales de licencia familiar y médica, y ciertos casos de adquisición involuntaria de información genética.[
70 ]
La ley GINA modifica o extiende la cobertura de HIPAA, ADA, y la Ley de Seguridad de los Ingresos de Jubilación del Empleado al incluir la información genética dentro de la legislación de privacidad y confidencialidad médica, y en las determinaciones de contratación y aseguramiento. Además, con la aprobación de la ley GINA, los investigadores y los profesionales clínicos pueden alentar la participación en ensayos clínicos y la obtención de pruebas genéticas apropiadas, sabiendo que hay protecciones federales contra la discriminación a partir de los resultados de las pruebas genéticas. En la ley GINA se estableció el mínimo de protección que se debe cumplir en todos los estados. Sin embargo, para los estados con una legislación más sólida, la ley GINA no debilita las protecciones registradas en la ley estatal.
No obstante, la ley GINA tiene varias limitaciones, entre ellas las siguientes:
- GINA no rige para los miembros de las fuerzas armadas de los Estados Unidos, los veteranos que obtienen atención médica a través del Departamento de Asuntos de los Veteranos o el Servicio de Salud Indígena porque las leyes enmendadas por la ley GINA no aplican a estos grupos y programas.
- La legislación no rige los seguros de vida, el seguro de atención a largo plazo ni el seguro de incapacidad. A pesar de que GINA no brinda protección para los seguros de vida y de discapacidad proporcionados por el empleador, algunos estados abarcan estos ámbitos además del ámbito laboral, la privacidad genética, el seguro de salud, la aplicación del seguro de salud, el seguro de vida, el seguro de discapacidad y el seguro de atención a largo plazo. La
Genome Statute and Legislation Database del NHGRI, disponible en inglés, ofrece una lista indizada de los estatutos y leyes estatales relacionados con los siguientes temas: pruebas genéticas dirigidas al consumidor, protección contra la discriminación laboral y durante el aseguramiento, cobertura del seguro médico, privacidad, investigación y uso de muestras residuales de recién nacidos para exámenes de detección. - Por lo general, las disposiciones de empleo de GINA no rigen para los empleadores con menos de 15 empleados.[
68 ]
Según la ley GINA, se permite que los empleadores soliciten información genética de los empleados para los programas voluntarios de bienestar. Sin embargo, los empleadores no pueden alentar a los empleados a proporcionar su información genética; esto significa que si un empleado decide entregar la información genética al programa de bienestar, no pueden recibir una recompensa por hacerlo. Por el contrario, si un empleado opta por retener la información genética, no se le puede penalizar.[
Las excepciones a las protecciones contra la discriminación laboral y durante el aseguramiento abarcan las que siguen: Personal militar
GINA y otras protecciones estatales y federales no aplican a las pruebas genéticas del personal militar en servicio activo ni a la información genética obtenida del personal militar en servicio activo.[
Los resultados de las pruebas genéticas de predisposición a enfermedades a veces influyen en la elegibilidad militar para nuevos alistamientos. Para el personal militar actual, los resultados de las pruebas genéticas podrían afectar la elegibilidad, las asignaciones y las promociones en todo el mundo.
Por lo tanto, es importante que las personas que están pensando en enlistarse en el ejército o que están activos determinen qué políticas específicas los rigen, y cuáles son las implicaciones de las pruebas genéticas para su carrera militar actual y futura.[
Referencias:
- Robson ME, Storm CD, Weitzel J, et al.: American Society of Clinical Oncology policy statement update: genetic and genomic testing for cancer susceptibility. J Clin Oncol 28 (5): 893-901, 2010.
- Robson ME, Bradbury AR, Arun B, et al.: American Society of Clinical Oncology Policy Statement Update: Genetic and Genomic Testing for Cancer Susceptibility. J Clin Oncol 33 (31): 3660-7, 2015.
- National Society of Genetic Counselors: National Society of Genetic Counselors Code of Ethics. Chicago, Il: National Society of Genetic Counselors, 2006.
Also available online . Last accessed December 9, 2024. - International Society of Nurses in Genetics: Brief Statement of Need/Importance: Privacy and Confidentiality of Genetic Information: The Role of the Nurse. Pittsburgh, Pa: International Society of Nurses in Genetics, 2018.
Also available online . Last accessed December 9, 2024. - ASHG statement. Professional disclosure of familial genetic information. The American Society of Human Genetics Social Issues Subcommittee on Familial Disclosure. Am J Hum Genet 62 (2): 474-83, 1998.
- Burke W, Press N: Genetics as a tool to improve cancer outcomes: ethics and policy. Nat Rev Cancer 6 (6): 476-82, 2006.
- Clayton EW, Evans BJ, Hazel JW, et al.: The law of genetic privacy: applications, implications, and limitations. J Law Biosci 6 (1): 1-36, 2019.
- Roberts MC, Dotson WD, DeVore CS, et al.: Delivery Of Cascade Screening For Hereditary Conditions: A Scoping Review Of The Literature. Health Aff (Millwood) 37 (5): 801-808, 2018.
- Florida. Supreme Court: Pate v. Threlkel. Wests South Report 661: 278-82, 1995.
- New Jersey. Superior Court, Appellate Division: Safer v. Estate of Pack. Atl Report 677: 1188-93, 1996.
- Offit K, Groeger E, Turner S, et al.: The "duty to warn" a patient's family members about hereditary disease risks. JAMA 292 (12): 1469-73, 2004.
- Storm C, Agarwal R, Offit K: Ethical and legal implications of cancer genetic testing: do physicians have a duty to warn patients' relatives about possible genetic risks? J Oncol Pract 4 (5): 229-30, 2008.
- Offit K, Thom P: Ethicolegal aspects of cancer genetics. Cancer Treat Res 155: 1-14, 2010.
- Suter S: Legal Challenges in Genetics, Including Duty to Warn and Genetic Discrimination. Cold Spring Harb Perspect Med 10 (4): , 2020.
- Rothstein MA: Reconsidering the duty to warn genetically at-risk relatives. Genet Med 20 (3): 285-290, 2018.
- Dheensa S, Fenwick A, Shkedi-Rafid S, et al.: Health-care professionals' responsibility to patients' relatives in genetic medicine: a systematic review and synthesis of empirical research. Genet Med 18 (4): 290-301, 2016.
- Meggiolaro N, Barlow-Stewart K, Dunlop K, et al.: Disclosure to genetic relatives without consent - Australian genetic professionals' awareness of the health privacy law. BMC Med Ethics 21 (1): 13, 2020.
- Mitchell C, Ploem C, Chico V, et al.: Exploring the potential duty of care in clinical genomics under UK law. Med Law Int 17 (3): 158-182, 2017.
- d'Audiffret Van Haecke D, de Montgolfier S: Genetic diseases and information to relatives: practical and ethical issues for professionals after introduction of a legal framework in France. Eur J Hum Genet 26 (6): 786-795, 2018.
- U.S. Department of Health & Human Services: Health Information Privacy: Health Information of Deceased Individuals. Washington, DC: U.S. Department of Health & Human Services, 2013.
Available online . Last accessed December 9, 2024. - Health Insurance Portability and Accountability Act of 1996, Public Law 104-191, 104th Congress. Washington, DC: 1996.
Also available online . Last accessed December 9, 2024. - US Department of Health and Human Services: OCR Privacy Brief: Summary of the HIPAA Privacy Rule. Washington, DC: US Department of Health and Human Services, 2002.
Also available online . Last accessed December 9, 2024. - Evans BJ, Jarvik GP: Impact of HIPAA's minimum necessary standard on genomic data sharing. Genet Med 20 (5): 531-535, 2018.
- Amendola LM, Horike-Pyne M, Trinidad SB, et al.: Patients' Choices for Return of Exome Sequencing Results to Relatives in the Event of Their Death. J Law Med Ethics 43 (3): 476-85, 2015.
- Daniels M, Wathoo C, Brusco L, et al.: Active Disclosure of Secondary Germline Findings to Deceased Research Participants' Personal Representatives: Process and Outcomes. JCO Precis Oncol 1: , 2017.
- Chan B, Facio FM, Eidem H, et al.: Genomic inheritances: disclosing individual research results from whole-exome sequencing to deceased participants' relatives. Am J Bioeth 12 (10): 1-8, 2012.
- Gordon DR, Radecki Breitkopf C, Robinson M, et al.: Should Researchers Offer Results to Family Members of Cancer Biobank Participants? A Mixed-Methods Study of Proband and Family Preferences. AJOB Empir Bioeth 10 (1): 1-22, 2019 Jan-Mar.
- Wolf SM, Scholtes E, Koenig BA, et al.: Pragmatic Tools for Sharing Genomic Research Results with the Relatives of Living and Deceased Research Participants. J Law Med Ethics 46 (1): 87-109, 2018.
- Gatter K: Informed Consent for Genetic Testing in Autopsy. Arch Pathol Lab Med 144 (6): 674-676, 2020.
- Elger BS, Michaud K, Fellmann F, et al.: Sudden death: ethical and legal problems of post-mortem forensic genetic testing for hereditary cardiac diseases. Clin Genet 77 (3): 287-92, 2010.
- Wolf SM, Branum R, Koenig BA, et al.: Returning a Research Participant's Genomic Results to Relatives: Analysis and Recommendations. J Law Med Ethics 43 (3): 440-63, 2015.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 2.2024. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023.
Available online with free registration. Last accessed September 18, 2024. - Meinhardt RA: HHS proposes HIPAA privacy rule changes. Provider 28 (6): 37-8, 41, 2002.
- Koplin JJ, Savulescu J, Vears DF: Why genomics researchers are sometimes morally required to hunt for secondary findings. BMC Med Ethics 21 (1): 11, 2020.
- Miller DT, Lee K, Chung WK, et al.: ACMG SF v3.0 list for reporting of secondary findings in clinical exome and genome sequencing: a policy statement of the American College of Medical Genetics and Genomics (ACMG). Genet Med 23 (8): 1381-1390, 2021.
- Miller DT, Lee K, Chung WK, et al.: Correction to: ACMG SF v3.0 list for reporting of secondary findings in clinical exome and genome sequencing: a policy statement of the American College of Medical Genetics and Genomics (ACMG). Genet Med 23 (8): 1582-1584, 2021.
- Miller DT, Lee K, Gordon AS, et al.: Recommendations for reporting of secondary findings in clinical exome and genome sequencing, 2021 update: a policy statement of the American College of Medical Genetics and Genomics (ACMG). Genet Med 23 (8): 1391-1398, 2021.
- Green RC, Berg JS, Grody WW, et al.: ACMG recommendations for reporting of incidental findings in clinical exome and genome sequencing. Genet Med 15 (7): 565-74, 2013.
- ACMG Board of Directors: The use of ACMG secondary findings recommendations for general population screening: a policy statement of the American College of Medical Genetics and Genomics (ACMG). Genet Med 21 (7): 1467-1468, 2019.
- ACMG Board of Directors: Points to consider for informed consent for genome/exome sequencing. Genet Med 15 (9): 748-9, 2013.
- American College of Medical Genetics and Genomics: Incidental findings in clinical genomics: a clarification. Genet Med 15 (8): 664-6, 2013.
- Wiesner GL, Kulchak Rahm A, Appelbaum P, et al.: Returning Results in the Genomic Era: Initial Experiences of the eMERGE Network. J Pers Med 10 (2): , 2020.
- Schwartz MLB, McCormick CZ, Lazzeri AL, et al.: A Model for Genome-First Care: Returning Secondary Genomic Findings to Participants and Their Healthcare Providers in a Large Research Cohort. Am J Hum Genet 103 (3): 328-337, 2018.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Colorectal. Version 1.2023. Plymouth Meeting, PA: National Comprehensive Cancer Network, 2023.
Available with free registration. Last accessed June 28, 2023. - Bunnik EM, Janssens AC, Schermer MH: A tiered-layered-staged model for informed consent in personal genome testing. Eur J Hum Genet 21 (6): 596-601, 2013.
- Berg JS, Khoury MJ, Evans JP: Deploying whole genome sequencing in clinical practice and public health: meeting the challenge one bin at a time. Genet Med 13 (6): 499-504, 2011.
- Bombard Y, Robson M, Offit K: Revealing the incidentalome when targeting the tumor genome. JAMA 310 (8): 795-6, 2013.
- Dumbrava EI, Brusco L, Daniels M, et al.: Expanded analysis of secondary germline findings from matched tumor/normal sequencing identifies additional clinically significant mutations. JCO Precis Oncol 3: , 2019.
- Seifert BA, O'Daniel JM, Amin K, et al.: Germline Analysis from Tumor-Germline Sequencing Dyads to Identify Clinically Actionable Secondary Findings. Clin Cancer Res 22 (16): 4087-4094, 2016.
- Schrader KA, Cheng DT, Joseph V, et al.: Germline Variants in Targeted Tumor Sequencing Using Matched Normal DNA. JAMA Oncol 2 (1): 104-11, 2016.
- Hampel H: Genetic counseling and cascade genetic testing in Lynch syndrome. Fam Cancer 15 (3): 423-7, 2016.
- Bellcross CA, Bedrosian SR, Daniels E, et al.: Implementing screening for Lynch syndrome among patients with newly diagnosed colorectal cancer: summary of a public health/clinical collaborative meeting. Genet Med 14 (1): 152-62, 2012.
- Hampel H, Pearlman R, Beightol M, et al.: Assessment of Tumor Sequencing as a Replacement for Lynch Syndrome Screening and Current Molecular Tests for Patients With Colorectal Cancer. JAMA Oncol 4 (6): 806-813, 2018.
- Hampel H: Population Screening for Hereditary Colorectal Cancer. Surg Oncol Clin N Am 27 (2): 319-325, 2018.
- Manne SL, Meropol NJ, Weinberg DS, et al.: Facilitating informed decisions regarding microsatellite instability testing among high-risk individuals diagnosed with colorectal cancer. J Clin Oncol 28 (8): 1366-72, 2010.
- Beamer LC, Grant ML, Espenschied CR, et al.: Reflex immunohistochemistry and microsatellite instability testing of colorectal tumors for Lynch syndrome among US cancer programs and follow-up of abnormal results. J Clin Oncol 30 (10): 1058-63, 2012.
- Best M, Butow P, Jacobs C, et al.: Advanced cancer patient preferences for receiving molecular profiling results. Psychooncology 29 (10): 1533-1539, 2020.
- Wauters A, Van Hoyweghen I: Global trends on fears and concerns of genetic discrimination: a systematic literature review. J Hum Genet 61 (4): 275-82, 2016.
- Prince AE, Roche MI: Genetic information, non-discrimination, and privacy protections in genetic counseling practice. J Genet Couns 23 (6): 891-902, 2014.
- Parkman AA, Foland J, Anderson B, et al.: Public awareness of genetic nondiscrimination laws in four states and perceived importance of life insurance protections. J Genet Couns 24 (3): 512-21, 2015.
- Green RC, Lautenbach D, McGuire AL: GINA, genetic discrimination, and genomic medicine. N Engl J Med 372 (5): 397-9, 2015.
- Sankar P: Genetic privacy. Annu Rev Med 54: 393-407, 2003.
- Lowrey KM: Legal and ethical issues in cancer genetics nursing. Semin Oncol Nurs 20 (3): 203-8, 2004.
- Leib JR, Hoodfar E, Haidle JL, et al.: The new genetic privacy law: how GINA will affect patients seeking counseling and testing for inherited cancer risk. Community Oncology 5 (6): 351-4, 2008.
- National Human Genome Research Institute: Genetic Discrimination. Bethesda, Md: National Human Genome Research Institute, 2020.
Available online . Last accessed December 9, 2024. - FORCE: Facing Our Risk of Cancer Empowered: Patient Protection and Affordable Care Act (PPACA). Tampa, Fla: FORCE: Facing Our Risk of Cancer Empowered, 2018.
Available online . Last accessed December 9, 2024. - Asmonga D: Getting to know GINA. An overview of the Genetic Information Nondiscrimination Act. J AHIMA 79 (7): 18, 20, 22, 2008.
- National Human Genome Research Institute: "GINA": The Genetic Information Nondiscrimination Act of 2008: Information for Researchers and Health Care Professionals. Bethesda, MD: National Human Genome Research Institute, 2009.
Available online . Last accessed January 17, 2024. - United States Department of Labor: Frequently Asked Questions Regarding the Genetic Information Nondiscrimination Act. Washington, DC: United States Department of Labor, 2010.
Available online . Last accessed January 17, 2024. - U.S. Equal Employment Opportunity Commission: The Genetic Information Nondiscrimination Act of 2008. Washington, DC: U.S. Equal Employment Opportunity Commission, 2008.
Available online . Last accessed December 9, 2024. - Steck MB: Response to "Workplace Wellness Programs: Educating Patients and Families About Discrimination Via Disclosure of Genetic Information". Clin J Oncol Nurs 23 (2): 124, 2019.
- Hudson KL, Holohan MK, Collins FS: Keeping pace with the times--the Genetic Information Nondiscrimination Act of 2008. N Engl J Med 358 (25): 2661-3, 2008.
- Baruch S, Hudson K: Civilian and military genetics: nondiscrimination policy in a post-GINA world. Am J Hum Genet 83 (4): 435-44, 2008.
- Department of Defense: Office of the Secretary of Defense: Direct-to-Consumer Genetic Testing Advisory for Military Members: DOD memo on DNA testing. Washington, DC: Department of Defense, 2019.
Available online . Last accessed January 17, 2024.
Actualizaciones más recientes a este resumen (02 / 14 / 2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Este resumen fue objeto de revisión integral.
El
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre la evaluación del riesgo de cáncer y el asesoramiento genético. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Evaluación del riesgo de cáncer y asesoramiento genético son:
- Kathleen A. Calzone, PhD, RN, AGN-BC, FAAN (National Cancer Institute)
- Suzanne C. O'Neill, PhD (Georgetown University)
- John M. Quillin, PhD, MPH, MS (Virginia Commonwealth University)
- Charite Ricker, MS, CGC (University of Southern California)
- Catharine Wang, PhD, MSc (Boston University School of Public Health)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como "En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]".
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre la genética del cáncer. PDQ Evaluación del riesgo de cáncer y asesoramiento genético. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del
Última revisión: 2025-02-14
Esta información no reemplaza el consejo de un médico. Ignite Healthwise, LLC, niega toda garantía y responsabilidad por el uso de esta información. El uso que usted haga de esta información implica que usted acepta los
Healthwise, Healthwise para cada decisión de la salud, y el logo de Healthwise son marcas de fábrica de Ignite Healthwise, LLC.
Page Footer
Quiero...
Audiencia
Sitios seguros para miembros
Información sobre The Cigna Group
Aviso legal
Los planes individuales y familiares de seguro médico y dental están asegurados por Cigna Health and Life Insurance Company (CHLIC), Cigna HealthCare of Arizona, Inc., Cigna HealthCare of Illinois, Inc., Cigna HealthCare of Georgia, Inc., Cigna HealthCare of North Carolina, Inc., Cigna HealthCare of South Carolina, Inc. y Cigna HealthCare of Texas, Inc. Los planes de beneficios de salud y de seguro de salud de grupo están asegurados o administrados por CHLIC, Connecticut General Life Insurance Company (CGLIC) o sus afiliadas (puedes ver
Todas las pólizas de seguros y los planes de beneficios de grupo contienen exclusiones y limitaciones. Para conocer la disponibilidad, los costos y detalles completos de la cobertura, comunícate con un agente autorizado o con un representante de ventas de Cigna. Este sitio web no está dirigido a los residentes de New Mexico.