Comprar planes
Comprar tu propia cobertura
Planes a través de tu empleador
Conoce sobre los beneficios médicos, dentales, de farmacia y voluntarios que tu empleador puede ofrecer.
Aprender
¿Vives o trabajas fuera del país?
Genética del cáncer de piel (PDQ®) información para profesionales de salud [NCI]
Esta información es producida y suministrada por el Instituto Nacional del Cáncer (NCI, por sus siglas en inglés). La información en este tema puede haber cambiado desde que se escribió. Para la información más actual, comuníquese con el Instituto Nacional del Cáncer a través del Internet en la página web http://cancer.gov o llame al 1-800-4-CANCER.
Resumen
Esta sección es una síntesis de los temas tratados en este resumen del PDQ sobre las características genéticas del cáncer de piel; incluye enlaces a las secciones específicas que tratan la evidencia de cada tema.
- Herencia y riesgo
Más de 100 tipos de tumores exhiben manifestaciones clínicas en la piel. Muchos de estos tumores tienen un componente familiar o hereditario, ya sea aislado o como parte de un síndrome con otras manifestaciones. El
carcinoma de células basales (CCB) y elcarcinoma de células escamosas (CCE) son dos de las neoplasias malignas más frecuentes en los Estados Unidos. La causa suele ser la exposición solar, aunque hay varios genes y síndromes hereditarios asociados con aumento del riesgo de estas neoplasias. Elmelanoma de piel (que también se conoce como melanoma cutáneo) es un tipo menos común de cáncer de piel, pero un 5 % a un 10 % de todos los melanomas surgen en familias con casos múltiples y se puede heredar de manera autosómica dominante. El melanoma es el cáncer más mortal de los tipos comunes de cáncer de piel. - Genes y síndromes asociados
Varios genes y síndromes hereditarios se asocian con la aparición del cáncer de piel, por ejemplo, los siguientes:
- Carcinoma de células basales. El
síndrome de nevo de células basales (SNCB, causado por variantes patogénicas dePTCH1 y en algunos casos por variantes dePTCH2 ) se asocia con riesgo elevado de CCB. - Carcinoma de células escamosas. Los síndromes como el
albinismo oculocutáneo , laepidermolisis bullosa y laanemia de Fanconi se asocian con riesgo elevado de CCE. - Melanoma. El gen CDKN2A es un importante gen supresor de tumores de la línea germinal que se asocia con riesgo elevado de melanoma. Las variantes patogénicas de CDKN2A explican entre el 35 % al 40 % de todos los melanomas familiares. Hay variantes germinales patogénicas de otros genes (por ejemplo,
CDK4 ,MITF yBAP1 ) que también se vinculan con riesgo elevado de melanoma.
Una enfermedad autosómica recesiva, llamada
xeroderma pigmentoso (XP) , se asocia con un aumento del riesgo de presentar CCB, CCE y melanoma.Los
estudios de asociación del genoma completo son prometedores para identificar alelos de susceptibilidad de penetrancia baja que son comunes para muchas enfermedades complejas, como el melanoma; pero no se ha determinado la utilidad clínica de estos hallazgos. - Carcinoma de células basales. El
- Cuidado clínico
Las estrategias de reducción del riesgo para las personas con predisposición hereditaria al cáncer de piel son semejantes a las recomendaciones para la población general. Estas recomendaciones abarcan evitar la exposición al sol, aplicar protector solar, usar ropa de protección solar y evitar el uso de las cámaras de bronceado. Se han estudiado fármacos de quimioprevención como la
isotretinoína y la acitretina para el tratamiento de los CCE en pacientes con SNCB y XP; estos producen una disminución significativa en el número de tumores por año. Elvismodegib también demostró ser promisorio para la reducción de la tasa anual por paciente de casos nuevos de CCB que requieren tratamiento quirúrgico en personas con SNCB. También se observó que laisotretinoína reduce la incidencia de CCE en pacientes con XP.El tratamiento del cáncer de piel hereditario es similar al tratamiento del cáncer de piel esporádico. En un estudio de una población con XP, se encontró que el uso terapéutico de
fluorouracilo (5-FU) es eficaz, en especial, para el tratamiento de lesiones extensas. Además de su función terapéutica y como posible fármaco de quimioprevención, elvismodegib también está en estudio para determinar posibles efectos paliativos en tumores odontogénicos queratoquísticos de pacientes con SNCB. - Aspectos psicosociales y del comportamiento
La mayor parte de la bibliografía sobre los aspectos psicosociales de los tipos de cáncer de piel hereditarios se ha centrado en los pacientes con melanoma familiar. En las personas con riesgo de melanoma familiar, los
factores psicosociales repercuten en las decisiones sobre la toma de pruebas genéticas para determinar el riesgo de cáncer hereditario y las estrategias de manejo del riesgo. Por lo general, elinterés en las pruebas genéticas para las variantes patogénicas del gen CDKN2A es alto. Los beneficios percibidos en las personas con una historia familiar significativa de melanoma incluyen la información sobre el riesgo de melanoma personal y para la descendencia, además del incremento en la motivación para poner en práctica conductas de protección solar. En varios estudios se examinaronconductas de reducción del riesgo y detección temprana en personas con historia familiar de melanoma. En general, estos estudios indican una adopción y mantenimiento irregulares de estos comportamientos. Los estudios de intervención se han orientado al conocimiento sobre el melanoma, la protección solar y las conductas de detección en familiares de pacientes con melanoma, pero los resultados son contradictorios. Se están llevando a cabo investigaciones para comprender y abordar mejor los problemas psicosociales y de comportamiento en las familias de riesgo alto.
Introducción
Estructura de la piel
La genética del cáncer de piel es un tema demasiado amplio. Más de 100 tipos de tumores exhiben manifestaciones clínicas en la piel, muchos de estos tumores tienen un componente familiar, ya sea aislado o como parte de un síndrome que se acompaña de otras manifestaciones. Esto se debe, en parte, a que la piel en sí es un órgano complejo compuesto de varios tipos de células. Además, muchos de estos tipos de células pueden exhibir una transformación maligna en varios puntos de su diferenciación, lo que conduce a tumores con características histológicas específicas y comportamientos biológicos muy diferentes, como el carcinoma de células escamosas (CCE) y el cáncer de células basales (CCB). Estos tipos de cáncer se conocen en conjunto como cánceres de piel no melanoma o cánceres de queratinocitos.
La
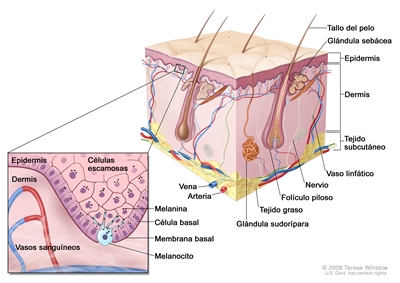
La capa externa o epidermis está compuesta sobre todo por queratinocitos, pero también contiene varios tipos de poblaciones celulares minoritarias. La capa más interna está compuesta de queratinocitos basales contiguos a la membrana basal y melanocitos entremezclados. La membrana basal es una estructura importante desde el punto de vista anatómico y funcional, que contiene productos derivados de los queratinocitos y de los fibroblastos cutáneos, como colágeno y laminina. Los queratinocitos basales van perdiendo contacto con la membrana basal al dividirse. A medida que los queratinocitos basales migran hacia la superficie de la piel, exhiben una diferenciación progresiva, pierden el núcleo y forman la capa de células espinosas, la capa de células granulosas y la capa externa queratinizada, o estrato córneo, que sirve como cubierta protectora del cuerpo.
El verdadero origen citológico del CCB sigue sin estar claro. Los queratinocitos basales y las células del CCB comparten muchas similitudes histológicas, como lo refleja su nombre. De manera alternativa, también se ha planteado que el origen del CCB son las células de la vaina radicular externa del folículo piloso.[
Todavía se debate el origen del CCE; no obstante, es probable que este tipo de cáncer se derive de las células madre epidérmicas asociadas con el folículo piloso.[
Además, dentro del compartimento epidérmico, los melanocitos se distribuyen de manera individual a lo largo de la membrana basal y a veces sufren una transformación maligna a un melanoma. Los melanocitos se derivan de las células de la cresta neural y migran al compartimento epidérmico hacia la 8.a semana de edad gestacional. Los melanocitos contienen melanina, que se almacena en melanosomas y se transporta a los queratinocitos cercanos para inducir pigmentación en la piel. La melanina proporciona un barrera que protege el núcleo de los queratinocitos contra la radiación ultravioleta, además cumple una función en el sistema inmunitario.[
Las células de Langerhans o células dendríticas, son otro tipo de célula de la epidermis cuya función principal es la presentación de antígenos. Estas células permanecen en la piel durante periodos prolongados y responden a diferentes estímulos, como la radiación ultravioleta o los corticoesteroides tópicos, que estimulan su migración fuera de la piel.[
La dermis se compone en gran medida de una matriz extracelular. Las células y orgánulos predominantes en este compartimiento son los fibroblastos, las células endoteliales, las células del músculo liso, las células transitorias del sistema inmunitario, los vasos sanguíneos y los nervios. Cuando se presenta una transformación maligna, los fibroblastos forman fibrosarcomas y las células endoteliales forman angiosarcomas, sarcomas de Kaposi y otros tumores vasculares. Varios tipos de células inmunitarias entran y salen de la piel por los vasos sanguíneos y linfáticos; entre ellas, mastocitos, linfocitos, células mononucleares, histiocitos y granulocitos. Cuando hay enfermedades inflamatorias es posible que aumente la cantidad de estas células y que formen tumores en la piel. Por ejemplo, la urticaria pigmentosa es una afección que surge de los mastocitos y en ocasiones se relaciona con la leucemia de mastocitos. El linfoma cutáneo de células T a menudo se limita a la piel durante toda su evolución. En general, el 10 % de las leucemias y los linfomas exhiben manifestaciones prominentes en la piel.[
En el compartimento dérmico también se encuentran las faneras, anejos cutáneos o anexos de la piel, que se derivan de los queratinocitos epidérmicos, y que abarcan los folículos pilosos, las glándulas sudoríparas, y las glándulas sebáceas de los folículos pilosos. Por lo general, estas estructuras se forman durante el primer o segundo trimestre del desarrollo fetal. En las faneras se pueden originar una gran variedad de tumores benignos o malignos con comportamiento biológico variable. Varios de estos tumores se asocian con síndromes familiares. En conjunto, hay docenas de subtipos histológicos de estos tumores asociados con componentes individuales de los anejos.[
Por último, la hipodermis o tejido subcutáneo es una capa que se extiende por debajo de la dermis a una profundidad variable según la ubicación anatómica. El límite más profundo puede corresponder a músculo, fascia, hueso o cartílago. Hay afecciones inflamatorias que afectan la hipodermis, como la paniculitis y algunas neoplasias malignas, como el liposarcoma.[
En cada uno de estos compartimientos se originan varias neoplasias malignas propias, pero además comprenden un área de diseminación adyacente inmediata de cánceres de piel localizados que surgen en otros compartimientos. Los límites de cada compartimiento cutáneo se usan para determinar la estadificación de los cánceres de piel. Por ejemplo, un melanoma in situ se limita a la epidermis. Cuando el cáncer cruza la membrana basal y llega a la dermis, se considera un cáncer invasivo. Además, hay neoplasias malignas internas que suelen metastatizar a la piel. La dermis y la hipodermis son los lugares más comunes de metástasis, pero algunas afecciones, como el cáncer de mama Pagetoide, afectan la epidermis.
Funciones de la piel
Las funciones de la piel son muy variadas. En primer lugar, la piel es un barrera importante que previene la pérdida generalizada de agua y calor, y protege contra las abrasiones menores. Cuando se presenta un cáncer es posible que no haya regulación adecuada de estas funciones. Por ejemplo, la eritrodermia (enrojecimiento generalizado de la piel) asociada a una quemadura solar grave altera la regulación de la temperatura corporal, lo que puede conllevar una pérdida importante de calor.
En segundo lugar, la piel tiene importantes funciones en la inmunidad innata y adaptativa. En la inmunidad adaptativa, las células presentadoras de antígenos producen respuestas en los linfocitos T que conllevan un aumento de las concentraciones de linfocitos T auxiliares (TH)1, TH 2 o TH 17.[
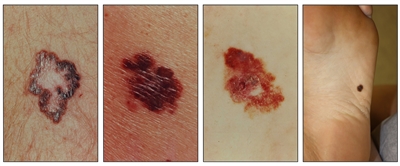
Cuadro clínico inicial de los cánceres de piel
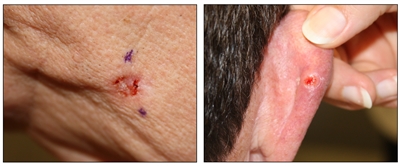
Si bien el aspecto de cada cáncer de piel es variable, hay características físicas generales útiles para la detección sistemática. Los CCB suelen tener un borde nacarado o un aspecto eccematoso (para obtener más información, consultar la
Carcinomas de células basales
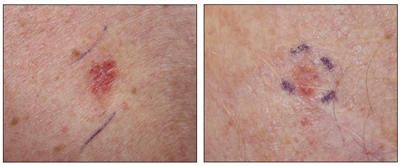
Carcinomas de células escamosas
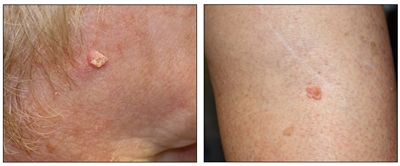
Melanomas
Referencias:
- Vandergriff TW, Bergstresser PR: Anatomy and physiology. In: Bolognia JL, Jorizzo JL, Schaffer JV: Dermatology. 3rd ed. Elsevier Saunders, 2012, pp 43-54.
- Schirren CG, Rütten A, Kaudewitz P, et al.: Trichoblastoma and basal cell carcinoma are neoplasms with follicular differentiation sharing the same profile of cytokeratin intermediate filaments. Am J Dermatopathol 19 (4): 341-50, 1997.
- Soyer HP, Rigel DS, Wurm EM: Actinic keratosis, basal cell carcinoma and squamous cell carcinoma. In: Bolognia JL, Jorizzo JL, Schaffer JV: Dermatology. 3rd ed. Elsevier Saunders, 2012, pp 1773-93.
- Lapouge G, Youssef KK, Vokaer B, et al.: Identifying the cellular origin of squamous skin tumors. Proc Natl Acad Sci U S A 108 (18): 7431-6, 2011.
- Lin JY, Fisher DE: Melanocyte biology and skin pigmentation. Nature 445 (7130): 843-50, 2007.
- Koster MI, Loomis CA, Koss TK, et al.: Skin development and maintenance. In: Bolognia JL, Jorizzo JL, Schaffer JV: Dermatology. 3rd ed. Elsevier Saunders, 2012, pp 55-64.
- Kamino H, Reddy VB, Pui J: Fibrous and fibrohistiocytic proliferations of the skin and tendons. In: Bolognia JL, Jorizzo JL, Schaffer JV: Dermatology. 3rd ed. Elsevier Saunders, 2012, pp 1961-77.
- McCalmont TH: Adnexal neoplasms. In: Bolognia JL, Jorizzo JL, Schaffer JV: Dermatology. 3rd ed. Elsevier Saunders, 2012, pp 1829-50.
- Kaddu S, Kohler S: Muscle, adipose and cartilage neoplasms. In: Bolognia JL, Jorizzo JL, Schaffer JV: Dermatology. 3rd ed. Elsevier Saunders, 2012, pp 1979-92.
- Harrington LE, Mangan PR, Weaver CT: Expanding the effector CD4 T-cell repertoire: the Th17 lineage. Curr Opin Immunol 18 (3): 349-56, 2006.
Carcinomas de células basales
Introducción
El carcinoma de células basales (CCB) es la neoplasia maligna más frecuente en personas de ascendencia europea, con un riesgo de por vida del 30 %.[
Factores de riesgo del carcinoma de células basales
Esta sección se centra en los factores de riesgo en personas con predisposición hereditaria al CCB. Para obtener más información sobre los factores de riesgo del CCB en la población general, consultar
Exposición solar
La exposición al sol es el principal factor ambiental conocido relacionado con el desarrollo de todos los tipos de cáncer de piel. Hay diferentes patrones de exposición al sol que se vinculan con cada uno de los principales tipos de cáncer de piel (CCB, carcinoma de células escamosas [CCE] y melanoma). Para obtener más información, consultar
Características pigmentarias
El fenotipo de riesgo alto se refiere a personas con las siguientes características físicas:
- Piel clara que se quema con facilidad.
- Iris poco pigmentados (ojos azules o verdes).
- Pecas en la piel expuesta al sol.
- Dificultad para broncearse.
- Cabello rubio o rojo.
En concreto, las personas con piel más pigmentada muestran una incidencia más baja de CCB que las personas con piel poco pigmentada. En un estudio pequeño de casos y controles, las personas con piel de tipo Fitzpatrick I o II (piel más clara) presentaron el doble de riesgo de CCB.[
Historia familiar
Las personas con CCB o CCE reportan una frecuencia más alta de estos tipos de cáncer en su familia en comparación con los controles. La importancia de este hallazgo no está clara. Aparte de los trastornos genéticos específicos que confieren un aumento del riesgo de CCB, una historia familiar de cualquier tipo de cáncer de piel es un factor predictivo importante del desarrollo de CCB. Los resultados del Nurses' Health Study y del Health Professionals Follow-Up Study indican que la historia familiar de melanoma en un familiar de primer grado (FPG) se vincula con aumento del riesgo de CCB en hombres y mujeres (RR, 1,31; IC 95 %, 1,25–1,37; P < 0,0001).[
En un estudio sobre la heredabilidad del cáncer en 80 309 gemelos monocigóticos y 123 382 gemelos dicigóticos, se observó que los NMSC tienen una heredabilidad del 43 % (IC 95 %, 26–59 %), lo que indica que casi la mitad del riesgo de este cáncer se debe a factores hereditarios.[
Antecedentes personales de carcinoma de células basales o de células escamosas
Los antecedentes personales de CCB o CCE se relacionan de manera importante con el desarrollo subsecuente de un CCB o CCE. Hay un aumento aproximado del 20 % en el riesgo de una lesión subsiguiente en el primer año posterior al diagnóstico de un cáncer de piel. La media de edad de aparición de estos tipos de cáncer se ubica alrededor de los 65 años.[
Principales genes asociados con el carcinoma de células basales
PTCH1
Las variantes patogénicas hereditarias del gen que codifica la proteína receptora transmembrana PTCH1 o PTCH se relacionan con el síndrome de nevo de células basales (SNCB), también conocido como síndrome de carcinoma nevoide de células basales o síndrome de Gorlin, mientras que las variantes somáticas de este gen se relacionan con los CCB cutáneos esporádicos. PTCH1, el homólogo humano del gen patched (ptc) de polaridad de segmento de la Drosophila, es un componente integral de la vía de señalización del erizo sónico (hedgehog), que cumple varias funciones durante el desarrollo (formación de las extremidades, segmentación embrionaria, diferenciación del tubo neural) y de regulación (mantenimiento de células madre). Para obtener más información, consultar la sección
En el estado de reposo, la proteína receptora transmembrana PTCH1, mediante su actividad catalítica, inhibe la proteína transmembrana 7 Smoothened (Smo), por lo que evita la posterior transducción de la señal.[
En el CCB esporádico y en el familiar, la demostración de una pérdida alélica en el cromosoma 9q22 indicó la posibilidad de un gen supresor de tumores.[
PTCH2
Se han observado variantes patogénicas truncadoras de PTCH2, un homólogo de PTCH1 ubicado en el cromosoma 1p32.1-32.3, en el CCB y en el meduloblastoma.[
Genes posiblemente asociados con el carcinoma de células basales
BAP1(Proteína 1 asociada a BRCA1)
Las variantes patogénicas del gen BAP1 se relacionan con un aumento del riesgo de varios tipos de cáncer, como el melanoma cutáneo y el melanoma uveal. Aunque no se conoce la penetrancia del CCB en personas con variantes patogénicas BAP1, se han reportado varias familias con variantes de BAP1 con diagnósticos de CCB.[
MC1R
En un metanálisis se observó que a mayor número de variantes patogénicas de MC1R en el portador, mayor es el riesgo de presentar CCE y CCB. Las personas con 2 o más variantes patogénicas de MC1R presentaron una OR de 2,48 (IC 95 %, 1,96–3,15) para el CCB y una OR de 2,80 (IC 95 %, 1,71–4,57) para el CCE; este riesgo aumentó en personas de cabello rojo.[
Síndromes de predisposición al carcinoma de células basales
Síndrome de nevo de células basales
El síndrome de nevo o nevoide de células basales (SNCB), que también se llama síndrome de Gorlin, síndrome de Gorlin-Goltz y síndrome del CCB nevoide, es una enfermedad autosómica dominante con una prevalencia estimada de 1 en 57 000 personas.[
Como se detalló antes, PTCH1 participa en el desarrollo y tiene funciones reguladoras; de manera que las variantes germinales patogénicas espontáneas o hereditarias de PTCH1 en el SNCB pueden dar lugar a una variedad amplia de manifestaciones físicas con potencial diagnóstico. La variante patogénica de SNCB se ubica en el cromosoma 9q22.3-q31, y tiene una puntuación del logaritmo de las probabilidades (LOD) máxima de 3,597 y 6,457 en los marcadores D9S12 y D9S53.[
El diagnóstico de SNCB por lo general se basa en hallazgos clínicos y radiológicos característicos. Se usan varios conjuntos de criterios diagnósticos para el SNCB (para obtener más información, consultar el
Otras neoplasias benignas relacionadas son los pólipos gástricos harmatomatosos,[
Entre las personas que cumplían con los criterios diagnósticos de SNCB, fue más probable que el diagnóstico se hiciera a una edad más temprana en quienes tenían variantes patogénicas de PTCH1 que en aquellas que no tenían las variantes patogénicas de PTCH1 (19 y 36 años, respectivamente). También fue más probable que estas personas que cumplían con los criterios diagnósticos y tenían las variantes patogénicas de PTCH1 presentaran manifestaciones clínicas como quistes mandibulares (con variantes de PTCH1, 63 %; sin variantes de PTCH1, 34 %), costillas bífidas (con variantes de PTCH1, 56 %; sin variantes de PTCH1, 34 %), o cualquier hallazgo esquelético (con variantes de PTCH1, 74 %; sin variantes de PTCH1, 51 %).[
Los criterios diagnósticos del SNCB se describen en el
| Evans et al. 1993[ |
Kimonis et al. 1997[ |
Veenstra-Knol et al. 2005[ |
SNCB Colloquium Group 2011b[ |
|---|---|---|---|
| CCB = carcinoma de células basales. | |||
| a Se necesitan 2 criterios mayores o 1 criterio mayor acompañado de 2 criterios menores para cumplir con los requisitos para el diagnóstico del SNCB.[ |
|||
| b El diagnóstico se basa en 1 criterio mayor cuando hay pruebas de diagnóstico molecular, pero cuando no se han hecho pruebas de diagnóstico molecular se aceptan 2 criterios mayores o 1 criterio mayor acompañado de 2 criterios menores.[ |
|||
| Criterios principalesa | |||
| >2 CCB a cualquier edad, 1 CCB diagnosticado antes de los 30 años o >10 nevos de células basales | >2 CCB a cualquier edad o 1 CCB diagnosticado antes de los 20 años | >2 CCB a cualquier edad o 1 CCB diagnosticado antes de los 20 años | Aparición de un CCB antes de los 20 años o un número excesivo de CCB fuera de proporción de acuerdo a la exposición solar previa y el tipo de piel |
| Queratoquiste odontogénico en el maxilar o un quiste óseo poliostótico comprobados por análisis histológico | Queratoquiste odontogénico en el maxilar comprobado por análisis histológico | Queratoquiste odontogénico en el maxilar comprobado por análisis histológico | Queratoquiste odontogénico en el maxilar antes de los 20 años |
| ≥3 hoyuelospalmaresoplantares | ≥3 hoyuelos palmares o plantares | ≥3 hoyuelos palmares o plantares | Hoyuelos palmoplantares |
| Calcificaciones ectópicas, calcificaciones encefálicas laminillares o tempranas (diagnosticadas antes de los 20 años) de la hoz cerebral | Calcificación bilaminar de la hoz cerebral | Calcificación ectópica (laminillar o temprana de la hoz cerebral) encefálicas | Calcificación bilaminar de la hoz cerebral |
| Historia familiar de SNCB | Unfamiliar de primer gradocon SNCB. | Historia familiar de SNCB | Un familiar de primer grado con SNCB. |
| (Las anomalías en las costillas se enumeran como criterio menor; ver a continuación) | Costillas bífidas, fusionadas o muy separadas | Costillas bífidas, fusionadas o muy separadas | (Las anomalías en las costillas se enumeran como criterio menor; ver a continuación) |
| (El meduloblastoma es un criterio menor; ver a continuación) | (El meduloblastoma es un criterio menor; ver a continuación) | (El meduloblastoma es un criterio menor; ver a continuación) | Meduloblastoma (usualmente desmoplásico) |
| Criterios menores | |||
| Perímetro occipitofrontal >97 centil y frente prominente | Macrocefalia (ajustada por talla) | Macrocefalia (>97 centil) | Macrocefalia |
| Anomalías esquelética congénitas: costillas bífidas, fusionadas, muy separadas; costillas ausentes o bífidas; vértebras en cuña o fusionadas. | Puente en la silla turca, anomalías vertebrales (hemivértebras, fusión o elongación de cuerpos vertebrales), deformidades de las manos y los pies, radiolucencias con forma de llama en manos y pies. | Puente en la silla turca, anomalías vertebrales (hemivértebras, fusión o elongación de cuerpos vertebrales), deformidades de las manos y los pies | Deformidades esqueléticas (anomalías vertebrales, acortamiento del 4. metacarpiano, polidactilia postaxial) |
| (Las anomalías de las costillas se enumeran como criterio principal; ver más arriba) | (Las anomalías de las costillas se enumeran como criterio principal; ver más arriba) | Anomalías en las costillas | |
| Fibroma cardiaco u ovárico | Fibroma ovárico | Fibroma cardiaco u ovárico | Fibroma cardiaco u ovárico |
| Meduloblastoma | Meduloblastoma | Meduloblastoma | (El meduloblastoma es un criterio principal; ver más arriba) |
| Deformidad congénita: fisura labial o palatina, polidactilia, cataratas, coloboma, microftalmia | Fisura labial o palatina, frente prominente, hipotelorismo moderado o grave | Fisura labial o palatina, polidactilia | Fisura labial o palatina |
| Deformidad de Sprengel, deformidad del tórax marcada, sindactilia pronunciada | Deformidad de Sprengel, deformidad del tórax marcada, sindactilia pronunciada | ||
| Quistes linfomesentéricos | Quistes linfomesentéricos | ||
| Anomalías oculares: cataratas, coloboma, microftalmia | Anomalías oculares (estrabismo, hipotelorismo, cataratas congénitas, coloboma) | ||
Una de las principales preocupaciones en personas con el SNCB, son las neoplasias malignas asociadas, la más común de ellas es el CCB. El CCB en personas con SNCB puede aparecer incluso durante la niñez como lesiones pequeñas similares a los acrocordones; las lesiones más grandes exhiben características cutáneas más clásicas.[
Las variantes de otros genes relacionados con un aumento del riesgo del CCB en la población general parecen modificar la edad de aparición del CCB en personas con SNCB. En un estudio de 125 personas con SNCB se encontró que una variante del gen MC1R (Arg151Cys) se relacionó con una mediana de edad de inicio temprana de 27 años (IC 95 %, 20–34), en comparación con las personas que no portaban el alelo de riesgo, quienes presentaron una mediana de edad de inicio del CCB de 34 años (IC 95 %, 30–40) (CRI, 1,64; IC 95 %, 1,04–2,58, P = 0,034). Una variante del gen TERT-CLPTM1L mostró un efecto similar; las personas con el alelo de riesgo presentaron una mediana de edad de inicio del CCB de 31 años (IC 95 %, 28–37) en comparación con una mediana de inicio del CCB de 41 años (IC 95 %, 32–48) en personas que no portaron un alelo de riesgo (CRI, 1,44; IC 95 %, 1,08–1,93, P = 014).[
Muchas otras neoplasias malignas se han relacionado con el SNCB. El meduloblastoma presenta la relación más fuerte con el SNCB y se diagnostica en el 1 % al 5 % de los casos de SNCB. Si bien el meduloblastoma asociado al SNCB suele diagnosticarse entre los 2 y 3 años de edad, el meduloblastoma esporádico por lo general se diagnostica entre los 6 y 10 años de edad.[
Los queratoquistes odontogénicos o tumores odontogénicos queratoquísticos (TOQ), según el nuevo nombre otorgado por el grupo de trabajo de la Organización Mundial de la Salud, son una de las características principales del SNCB.[
Los hoyuelos palmoplantares son otro hallazgo importante en el CCB, y se presentan en el 70 % al 80 % de las personas con SNCB.[
Varios hallazgos radiológicos se relacionan con el SNCB, como la calcificación laminillar de la hoz cerebral;[
En el
| Hallazgo | Frecuencia (%) | Mediana de edad de inicio |
|---|---|---|
| Adaptación de un informe de Kimonis et al.[ |
||
| Hoyuelos palmoplantares | 87 | Por lo general a los 10 años |
| Quistes queratogénicos en el maxilar | 74 | Por lo general a los 20 años |
| Puente en la silla turca | 68 | Congénito |
| Calcificación de la hoz cerebral | 65 | Por lo general a los 40 años |
| Macrocefalia | 50 | Congénito |
| Hipotelorismo | 42 | Congénito |
| Radiolucencias óseas en las manos | 30 | Congénito |
| Frente prominente | 27 | Congénito |
| Costillas bífidas | 26 | Congénito |
| Calcificación de la tienda del cerebelo | 20 | No notificado |
| Fibromas ováricos | 17 | 30 años |
| Hemivértebras | 15 | Congénito |
| Deformidad del tórax | 11 | Congénito |
| Fusión de cuerpos vertebrales | 10 | Congénito |
| Labio leporino y paladar hendido | 3 | Congénito |
Las personas con variantes patogénicas de PTCH2 a veces exhiben un fenotipo de SNCB menos intenso que las personas con variantes del gen PTCH1. Es posible que estas personas no presenten características como hoyuelos palmoplantares, macrocefalia, calcificación de la hoz cerebral, hipertelorismo y cara tosca.[
En 10 niños se describió un síndrome de microdeleción de 9p22.3 que afecta el locus PTCH1.[
Se han encontrado variantes germinales patogénicas de SUFU, un regulador inverso importante de la vía del erizo sónico (hedgehog) en un número pequeño de personas con un fenotipo clínico semejante al SNCB.[
Genes de reparación del DNA
Además de las variantes patogénicas de los genes asociados de manera primaria con el CCB, otros genes relacionados con el cáncer pueden conferir un aumento del riesgo de CCB. En un estudio de 61 personas con un número elevado de CCB (media, 11 CCB; intervalo, 6–65), se hizo una prueba genética para 29 genes de susceptibilidad al cáncer de penetrancia alta. Se encontraron 13 variantes patogénicas de 12 de las 61 personas (19,7 %). Este resultado fue más alto de lo esperado en comparación con las personas de la base de datos Exome Aggregation Consortium (ExAC) (3 %). Todos estos genes con variantes patogénicas repercutían en la reparación del DNA, lo que indica que los errores en las vías de reparación del DNA quizás aumentan el riesgo de CCB. De estas 61 personas, 21 (34,4 %) presentaban un antecedente de diagnóstico de otro tipo de cáncer, como melanoma, cáncer de mama, cáncer de colon y cáncer de próstata.
Xeroderma pigmentoso
El xeroderma pigmentoso (XP) es un trastorno hereditario de la reparación por escisión de nucleótidos que produce neoplasias malignas cutáneas en la primera década de la vida.[
Síndromes raros
Síndrome de Rombo
El síndrome de Rombo es un trastorno genético o genodermatosis muy infrecuente que se vincula con el CCB. Se piensa que es un trastorno de herencia autosómica dominante y se han reportado 3 series de casos en la literatura médica.[
Síndrome de Bazex-Dupré-Christol
El síndrome de Bazex-Dupré-Christol es otra genodermatosis rara relacionada con el desarrollo de CCB, que cuenta con una documentación más completa que el síndrome de Rombo. La herencia exhibe un modelo dominante ligado al cromosoma X, y no se ha notificado transmisión de varón a varón.[
Las características físicas abarcan hipotricosis, hipohidrosis, milios, atrofodermia folicular en las mejillas y muchos CCB, que se manifiestan hacia el final de la segunda década de vida y el principio de la tercera.[
Epidermólisis ampollosa simple
Un subtipo raro y grave de epidermólisis ampollosa simple (EBS), previamente conocido como Dowling-Meara (EBS-DM), se hereda principalmente de manera autosómica dominante y se asocia con variantes patogénicas de la queratina-5 (KRT5) o la queratina-14 (KRT14).[
Las características de los síndromes hereditarios relacionados con una predisposición al CCB se describen a continuación en el
| Síndrome | Herencia | Gen o locus cromosómico | Observaciones clínicas |
|---|---|---|---|
| AD = autosómica dominante; AR =autosómica recesivo; CCE = carcinoma de células escamosas; XD = dominante ligada al cromosoma X. | |||
| Síndrome de nevo de células basales, síndrome de Gorlin | AD | PTCH1,[ |
CCB (antes de los 20 años) |
| Síndrome de Rombo | AD | Desconocida | Milios, atrofodermia vermiculada, acrocianosis, tricoepiteliomas y CCB (edad de 30–40 años) |
| Síndrome de Bazex-Dupré-Christol | XD > AD | Xq24-27[ |
Hipotricosis (variable),[ |
| Síndrome de Brooke-Spiegler | AD | CYLD[ |
Cilindroma (frente, cuero cabelludo, tronco y área púbica),[ |
| CCB infundibuloquístico hereditario múltiple | AD[ |
Desconocida | Múltiples CCB (de tipo infundibuloquístico) |
| Síndrome de Schopf-Schultz-Passarge | AR > AD | Desconocida | Displasia ectodérmica (hipotricosis, hipodoncia ydistrofia ungueal[anoniquia y traquioniquia]), hidrocistomas de párpados, queratosis e hiperhidrosis palmoplantar y CBB[ |
| Xeroderma pigmentoso | AR | XPA,XPB/ERCC3,XPC,XPD/ERCC2,XPE/DDB2,XPF/ERCC4,XPG/ERCC5 | CCE, CCB, melanoma, sensibilidad al sol intensa, anormalidades oftalmológicas y neurológicas |
| Variante de xeroderma pigmentoso | AR | POLH | CCE, CCB, melanoma, sensibilidad al sol intensa, anomalías oftalmológicas |
Para obtener más información, consultar la sección
Intervenciones
Detección
Como se detalla más adelante, el U.S. Preventive Services Task Force no recomienda la administración regular de exámenes de detección para identificar de manera temprana las neoplasias cutáneas malignas, incluso el CCB. Sin embargo, una vez que se detecta un CCB en la piel de una persona, la National Comprehensive cáncer Network recomienda que dicha persona se someta a exámenes cutáneos completos 2 veces al año o cada año durante los primeros 5 años posteriores al diagnóstico. Después de los primeros 5 años, se recomienda por lo menos un examen cutáneo cada año durante el resto de la vida.[
En el
| IRM = imágenes por resonancia magnética. | |
| Adaptación de Bree et al.[ |
|
| Para adultos: | |
| • IRM cerebral (inicial) | |
| • Exploración cutánea cada 4 meses | |
| • Radiografía panorámica del maxilar cada año | |
| • Evaluación neurológica (si hay antecedentes de meduloblastoma) | |
| • Ecografía pélvica (inicial) | |
| • Exploración ginecológica cada año | |
| • Evaluación nutricional | |
| • Evaluación fetal para hidrocefalia, macrocefalia o fibromas cardíacos durante el embarazo | |
| • Reducción al mínimo de la exposición a la radiación diagnóstica cuando sea posible | |
| Para menores de edad: | |
| • IRM cerebral (cada año hasta los 8 años)[ |
|
| • Riesgo bajo (PTCH1): no se hace un examen de detección radiográfico a menos que se encuentren hallazgos anormales en el examen neurológico, un cambio en la circunferencia de la cabeza y otros signos o síntomas inusuales[ |
|
| • Riesgo alto (SUFU): IRM cerebral cada 4 meses hasta los 3 años, luego cada 6 meses hasta los 5 años[ |
|
| • Ecocardiograma (inicial) | |
| • Exploración dermatológica (inicial) | |
| • Anual hasta los 10 años, aumento de la frecuencia una vez se diagnóstica el primer carcinoma de células basales[ |
|
| • Radiografía panorámica del maxilar (inicial y luego cada año cuando no se observan quistes; una vez se diagnostica el primer quiste se continúan cada 6 meses hasta los 21 años o hasta que no se encuentren quistes por 2 años consecutivos) | |
| • A partir de los 8 años de edad y después cada 12–18 meses[ |
|
| • Algunos dermatólogos recomiendan esperar hasta que se presenten síntomas para comenzar a obtener radiografías panorámicas con el fin de limitar la exposición a la radiación[ |
|
| • Radiografía de columna vertebral al año de edad o en el momento del diagnóstico (si hay anormalidades, se sigue el protocolo de escoliosis) | |
| • Ecografía pélvica en la menarquia o a los 18 años de edad | |
| • Evaluación auditiva, del habla y oftalmológica | |
| • Reducción al mínimo de la exposición a la radiación diagnóstica cuando sea posible | |
Nivel de evidencia: 5
Prevención primaria
Evitar la exposición solar excesiva, esporádica o acumulada es importante para reducir el riesgo de CCB y de otras neoplasias malignas cutáneas. Programar las actividades fuera de las horas pico de radiación UV, usar ropa y sombreros de protección solar y abundante protector solar, además de evitar a toda costa el uso de cámaras bronceadoras son pasos razonables para minimizar el riesgo futuro de cáncer de piel.[
Nivel de evidencia: 2aii
Quimioprevención
Se ha explorado la función de varios retinoides sistémicos, como la isotretinoína y la acitretina, en la quimioprevención y el tratamiento de múltiples CCB, en especial en pacientes con SNCB. En un estudio del uso de isotretinoína en 12 pacientes con múltiples CCB, entre ellos 5 pacientes con SNCB, se observó regresión tumoral; la eficacia fue menor a medida que aumentó el diámetro del tumor.[
La carga tumoral acumulativa y en evolución se deben evaluar de manera cuidadosa por la posibilidad de una administración a largo plazo de un tipo de medicamento que tiene efectos secundarios acumulados e idiosincráticos. El perfil de efectos secundarios de los retinoides sistémicos hace que se recomiende la supervisión de un profesional con experiencia específica en la formulación de los retinoides sistémicos y que se sienta cómodo al formular este tipo de medicamentos. Sin embargo, en todas las mujeres en edad reproductiva, es esencial evitar de manera estricta el embarazo durante la administración del retinoide sistémico —hasta 1 mes después de interrumpir la isotretinoína y 3 años después de interrumpir la acitretina— para evitar malformaciones devastadoras y potencialmente mortales. En los Estados Unidos, la isotretinoína solo se puede recetar en el contexto del programa
Nivel de evidencia (retinoides): 2aii
En un estudio de fase II en 41 pacientes con SNCB, se demostró que el vismodegib (inhibidor de la vía del erizo sónico hedgehog) reduce la tasa anual por paciente de formación de nuevos CCB que requieren cirugía.[
Nivel de evidencia (vismodegib): 1aii
En un ensayo clínico controlado con placebo y con enmascaramiento doble de fase III, se evaluaron los efectos de la nicotinamida oral (vitamina B3) en 386 personas con antecedentes de por lo menos 2 carcinomas de queratinocitos (CCB o CCE) en los 5 años previos al comienzo del estudio.[
Nivel de evidencia (nicotinamida): 1aii
Tratamiento
El tratamiento de los CCB individuales en el SNCB por lo general es el mismo que para los cánceres de células basales esporádicos. Debido al gran número de lesiones en algunos pacientes, esto representa un reto quirúrgico. La terapia de campo con imiquimod o la terapia fotodinámica son opciones atractivas porque permiten el tratamiento de varios tumores al mismo tiempo.[
Las directrices consensuadas para el uso de terapia fotodinámica con metilaminolevulinato en el SNCB recomiendan que mejor se reserve esta modalidad para el CCB superficial de todos los tamaños y para el CCB nodular de menos de 2 mm de grosor.[
Nivel de evidencia (imiquimod y terapia fotodinámica): 4
También se ha investigado el tratamiento tópico con LDE225, un agonista de Smoothened, para el tratamiento del CCB en un número pequeño de pacientes con SNCB y se notificaron resultados prometedores;[
Nivel de evidencia (LDE225): 1
Además de los efectos en la prevención del CCB en pacientes con SNCB, es posible que el vismodegib también tenga un efecto paliativo en los TOQ que se encuentran en esta población. En un informe inicial se indicó que el uso de GDC-0449, un inhibidor de la vía del erizo sónico (hedgehog), conocido como vismodegib, produjo resolución de los TOQ en un paciente con SNCB.[
Nivel de evidencia (vismodegib): 3diii
Referencias:
- Miller DL, Weinstock MA: Nonmelanoma skin cancer in the United States: incidence. J Am Acad Dermatol 30 (5 Pt 1): 774-8, 1994.
- Gon A, Minelli L: Risk factors for basal cell carcinoma in a southern Brazilian population: a case-control study. Int J Dermatol 50 (10): 1286-90, 2011.
- Wu S, Han J, Li WQ, et al.: Basal-cell carcinoma incidence and associated risk factors in U.S. women and men. Am J Epidemiol 178 (6): 890-7, 2013.
- Wei EX, Li X, Nan H: Having a first-degree relative with melanoma increases lifetime risk of melanoma, squamous cell carcinoma, and basal cell carcinoma. J Am Acad Dermatol 81 (2): 489-499, 2019.
- Berlin NL, Cartmel B, Leffell DJ, et al.: Family history of skin cancer is associated with early-onset basal cell carcinoma independent of MC1R genotype. Cancer Epidemiol 39 (6): 1078-83, 2015.
- Mucci LA, Hjelmborg JB, Harris JR, et al.: Familial Risk and Heritability of Cancer Among Twins in Nordic Countries. JAMA 315 (1): 68-76, 2016.
- Epstein E: Value of follow-up after treatment of basal cell carcinoma. Arch Dermatol 108 (6): 798-800, 1973.
- Møller R, Nielsen A, Reymann F: Multiple basal cell carcinoma and internal malignant tumors. Arch Dermatol 111 (5): 584-5, 1975.
- Bergstresser PR, Halprin KM: Multiple sequential skin cancers. The risk of skin cancer in patients with previous skin cancer. Arch Dermatol 111 (8): 995-6, 1975.
- Robinson JK: Risk of developing another basal cell carcinoma. A 5-year prospective study. Cancer 60 (1): 118-20, 1987.
- Greenberg ER, Baron JA, Stukel TA, et al.: A clinical trial of beta carotene to prevent basal-cell and squamous-cell cancers of the skin. The Skin Cancer Prevention Study Group. N Engl J Med 323 (12): 789-95, 1990.
- Karagas MR, Stukel TA, Greenberg ER, et al.: Risk of subsequent basal cell carcinoma and squamous cell carcinoma of the skin among patients with prior skin cancer. Skin Cancer Prevention Study Group. JAMA 267 (24): 3305-10, 1992.
- Cantwell MM, Murray LJ, Catney D, et al.: Second primary cancers in patients with skin cancer: a population-based study in Northern Ireland. Br J Cancer 100 (1): 174-7, 2009.
- Efird JT, Friedman GD, Habel L, et al.: Risk of subsequent cancer following invasive or in situ squamous cell skin cancer. Ann Epidemiol 12 (7): 469-75, 2002.
- Wheless L, Black J, Alberg AJ: Nonmelanoma skin cancer and the risk of second primary cancers: a systematic review. Cancer Epidemiol Biomarkers Prev 19 (7): 1686-95, 2010.
- Frisch M, Hjalgrim H, Olsen JH, et al.: Risk for subsequent cancer after diagnosis of basal-cell carcinoma. A population-based, epidemiologic study. Ann Intern Med 125 (10): 815-21, 1996.
- Cho HG, Kuo KY, Li S, et al.: Frequent basal cell cancer development is a clinical marker for inherited cancer susceptibility. JCI Insight 3 (15): , 2018.
- Small J, Wallace K, Hill EG, et al.: A cohort study of personal and family history of skin cancer in relation to future risk of non-cutaneous malignancies. Cancer Causes Control 30 (11): 1213-1221, 2019.
- Tuohimaa P, Pukkala E, Scélo G, et al.: Does solar exposure, as indicated by the non-melanoma skin cancers, protect from solid cancers: vitamin D as a possible explanation. Eur J Cancer 43 (11): 1701-12, 2007.
- de Vries E, Soerjomataram I, Houterman S, et al.: Decreased risk of prostate cancer after skin cancer diagnosis: a protective role of ultraviolet radiation? Am J Epidemiol 165 (8): 966-72, 2007.
- Grant WB: A meta-analysis of second cancers after a diagnosis of nonmelanoma skin cancer: additional evidence that solar ultraviolet-B irradiance reduces the risk of internal cancers. J Steroid Biochem Mol Biol 103 (3-5): 668-74, 2007.
- Soerjomataram I, Louwman WJ, Lemmens VE, et al.: Are patients with skin cancer at lower risk of developing colorectal or breast cancer? Am J Epidemiol 167 (12): 1421-9, 2008.
- Tabata T, Kornberg TB: Hedgehog is a signaling protein with a key role in patterning Drosophila imaginal discs. Cell 76 (1): 89-102, 1994.
- Lum L, Beachy PA: The Hedgehog response network: sensors, switches, and routers. Science 304 (5678): 1755-9, 2004.
- Tojo M, Kiyosawa H, Iwatsuki K, et al.: Expression of the GLI2 oncogene and its isoforms in human basal cell carcinoma. Br J Dermatol 148 (5): 892-7, 2003.
- Gailani MR, Bale SJ, Leffell DJ, et al.: Developmental defects in Gorlin syndrome related to a putative tumor suppressor gene on chromosome 9. Cell 69 (1): 111-7, 1992.
- Shanley SM, Dawkins H, Wainwright BJ, et al.: Fine deletion mapping on the long arm of chromosome 9 in sporadic and familial basal cell carcinomas. Hum Mol Genet 4 (1): 129-33, 1995.
- Hahn H, Christiansen J, Wicking C, et al.: A mammalian patched homolog is expressed in target tissues of sonic hedgehog and maps to a region associated with developmental abnormalities. J Biol Chem 271 (21): 12125-8, 1996.
- Gailani MR, Ståhle-Bäckdahl M, Leffell DJ, et al.: The role of the human homologue of Drosophila patched in sporadic basal cell carcinomas. Nat Genet 14 (1): 78-81, 1996.
- Wicking C, Shanley S, Smyth I, et al.: Most germ-line mutations in the nevoid basal cell carcinoma syndrome lead to a premature termination of the PATCHED protein, and no genotype-phenotype correlations are evident. Am J Hum Genet 60 (1): 21-6, 1997.
- Smyth I, Narang MA, Evans T, et al.: Isolation and characterization of human patched 2 (PTCH2), a putative tumour suppressor gene in basal cell carcinoma and medulloblastoma on chromosome 1p32. Hum Mol Genet 8 (2): 291-7, 1999.
- Shakhova O, Leung C, van Montfort E, et al.: Lack of Rb and p53 delays cerebellar development and predisposes to large cell anaplastic medulloblastoma through amplification of N-Myc and Ptch2. Cancer Res 66 (10): 5190-200, 2006.
- Goodrich LV, Johnson RL, Milenkovic L, et al.: Conservation of the hedgehog/patched signaling pathway from flies to mice: induction of a mouse patched gene by Hedgehog. Genes Dev 10 (3): 301-12, 1996.
- Rahnama F, Toftgård R, Zaphiropoulos PG: Distinct roles of PTCH2 splice variants in Hedgehog signalling. Biochem J 378 (Pt 2): 325-34, 2004.
- Smith MJ, Evans DG: PTCH2 is not a strong candidate gene for gorlin syndrome predisposition. Fam Cancer 21 (3): 343-346, 2022.
- Wadt KA, Aoude LG, Johansson P, et al.: A recurrent germline BAP1 mutation and extension of the BAP1 tumor predisposition spectrum to include basal cell carcinoma. Clin Genet 88 (3): 267-72, 2015.
- Carbone M, Flores EG, Emi M, et al.: Combined Genetic and Genealogic Studies Uncover a Large BAP1 Cancer Syndrome Kindred Tracing Back Nine Generations to a Common Ancestor from the 1700s. PLoS Genet 11 (12): e1005633, 2015.
- de la Fouchardière A, Cabaret O, Savin L, et al.: Germline BAP1 mutations predispose also to multiple basal cell carcinomas. Clin Genet 88 (3): 273-7, 2015.
- Mochel MC, Piris A, Nose V, et al.: Loss of BAP1 Expression in Basal Cell Carcinomas in Patients With Germline BAP1 Mutations. Am J Clin Pathol 143 (6): 901-4, 2015.
- Tagliabue E, Fargnoli MC, Gandini S, et al.: MC1R gene variants and non-melanoma skin cancer: a pooled-analysis from the M-SKIP project. Br J Cancer 113 (2): 354-63, 2015.
- Ferrucci LM, Cartmel B, Molinaro AM, et al.: Host phenotype characteristics and MC1R in relation to early-onset basal cell carcinoma. J Invest Dermatol 132 (4): 1272-9, 2012.
- Farndon PA, Del Mastro RG, Evans DG, et al.: Location of gene for Gorlin syndrome. Lancet 339 (8793): 581-2, 1992.
- Shimkets R, Gailani MR, Siu VM, et al.: Molecular analysis of chromosome 9q deletions in two Gorlin syndrome patients. Am J Hum Genet 59 (2): 417-22, 1996.
- Bale AE: Variable expressivity of patched mutations in flies and humans. Am J Hum Genet 60 (1): 10-2, 1997.
- Fan Z, Li J, Du J, et al.: A missense mutation in PTCH2 underlies dominantly inherited NBCCS in a Chinese family. J Med Genet 45 (5): 303-8, 2008.
- Smith MJ, Beetz C, Williams SG, et al.: Germline mutations in SUFU cause Gorlin syndrome-associated childhood medulloblastoma and redefine the risk associated with PTCH1 mutations. J Clin Oncol 32 (36): 4155-61, 2014.
- Pastorino L, Ghiorzo P, Nasti S, et al.: Identification of a SUFU germline mutation in a family with Gorlin syndrome. Am J Med Genet A 149A (7): 1539-43, 2009.
- Agaram NP, Collins BM, Barnes L, et al.: Molecular analysis to demonstrate that odontogenic keratocysts are neoplastic. Arch Pathol Lab Med 128 (3): 313-7, 2004.
- High A, Zedan W: Basal cell nevus syndrome. Curr Opin Oncol 17 (2): 160-6, 2005.
- Bacanli A, Ciftcioglu MA, Savas B, et al.: Nevoid basal cell carcinoma syndrome associated with unilateral renal agenesis: acceleration of basal cell carcinomas following radiotherapy. J Eur Acad Dermatol Venereol 19 (4): 510-1, 2005.
- Strong LC: Genetic and environmental interactions. Cancer 40 (4 Suppl): 1861-6, 1977.
- Evans DG, Birch JM, Orton CI: Brain tumours and the occurrence of severe invasive basal cell carcinoma in first degree relatives with Gorlin syndrome. Br J Neurosurg 5 (6): 643-6, 1991.
- Levanat S, Gorlin RJ, Fallet S, et al.: A two-hit model for developmental defects in Gorlin syndrome. Nat Genet 12 (1): 85-7, 1996.
- Pan S, Dong Q, Sun LS, et al.: Mechanisms of inactivation of PTCH1 gene in nevoid basal cell carcinoma syndrome: modification of the two-hit hypothesis. Clin Cancer Res 16 (2): 442-50, 2010.
- Evans DG, Ladusans EJ, Rimmer S, et al.: Complications of the naevoid basal cell carcinoma syndrome: results of a population based study. J Med Genet 30 (6): 460-4, 1993.
- Kimonis VE, Goldstein AM, Pastakia B, et al.: Clinical manifestations in 105 persons with nevoid basal cell carcinoma syndrome. Am J Med Genet 69 (3): 299-308, 1997.
- Veenstra-Knol HE, Scheewe JH, van der Vlist GJ, et al.: Early recognition of basal cell naevus syndrome. Eur J Pediatr 164 (3): 126-30, 2005.
- Bree AF, Shah MR; BCNS Colloquium Group: Consensus statement from the first international colloquium on basal cell nevus syndrome (BCNS). Am J Med Genet A 155A (9): 2091-7, 2011.
- Klein RD, Dykas DJ, Bale AE: Clinical testing for the nevoid basal cell carcinoma syndrome in a DNA diagnostic laboratory. Genet Med 7 (9): 611-9, 2005 Nov-Dec.
- Kimonis VE, Mehta SG, Digiovanna JJ, et al.: Radiological features in 82 patients with nevoid basal cell carcinoma (NBCC or Gorlin) syndrome. Genet Med 6 (6): 495-502, 2004 Nov-Dec.
- Evans DG, Oudit D, Smith MJ, et al.: First evidence of genotype-phenotype correlations in Gorlin syndrome. J Med Genet 54 (8): 530-536, 2017.
- Shanley S, Ratcliffe J, Hockey A, et al.: Nevoid basal cell carcinoma syndrome: review of 118 affected individuals. Am J Med Genet 50 (3): 282-90, 1994.
- Scully RE, Galdabini JJ, McNeely BU: Case records of the Massachusetts General Hospital. Weekly clinicopathological exercises. Case 14-1976. N Engl J Med 294 (14): 772-7, 1976.
- Ponti G, Pastorino L, Pollio A, et al.: Ameloblastoma: a neglected criterion for nevoid basal cell carcinoma (Gorlin) syndrome. Fam Cancer 11 (3): 411-8, 2012.
- Schwartz RA: Basal-cell-nevus syndrome and gastrointestinal polyposis. N Engl J Med 299 (1): 49, 1978.
- Totten JR: The multiple nevoid basal cell carcinoma syndrome. Report of its occurrence in four generations of a family. Cancer 46 (6): 1456-62, 1980.
- Jones KL, Wolf PL, Jensen P, et al.: The Gorlin syndrome: a genetically determined disorder associated with cardiac tumor. Am Heart J 111 (5): 1013-5, 1986.
- Gorlin RJ: Nevoid basal-cell carcinoma syndrome. Medicine (Baltimore) 66 (2): 98-113, 1987.
- Mortimer PS, Geaney DP, Liddell K, et al.: Basal cell naevus syndrome and intracranial meningioma. J Neurol Neurosurg Psychiatry 47 (2): 210-2, 1984.
- Kijima C, Miyashita T, Suzuki M, et al.: Two cases of nevoid basal cell carcinoma syndrome associated with meningioma caused by a PTCH1 or SUFU germline mutation. Fam Cancer 11 (4): 565-70, 2012.
- Tamoney HJ: Basal cell nevoid syndrome. Am Surg 35 (4): 279-83, 1969.
- DiSanto S, Abt AB, Boal DK, et al.: Fetal rhabdomyoma and nevoid basal cell carcinoma syndrome. Pediatr Pathol 12 (3): 441-7, 1992 May-Jun.
- Korczak JF, Brahim JS, DiGiovanna JJ, et al.: Nevoid basal cell carcinoma syndrome with medulloblastoma in an African-American boy: a rare case illustrating gene-environment interaction. Am J Med Genet 69 (3): 309-14, 1997.
- Wolthers OD, Stellfeld M: Benign mesenchymoma in the trachea of a patient with the nevoid basal cell carcinoma syndrome. J Laryngol Otol 101 (5): 522-6, 1987.
- Ponti G, Manfredini M, Pastorino L, et al.: PTCH1 Germline Mutations and the Basaloid Follicular Hamartoma Values in the Tumor Spectrum of Basal Cell Carcinoma Syndrome (NBCCS). Anticancer Res 38 (1): 471-476, 2018.
- Iacono RP, Apuzzo ML, Davis RL, et al.: Multiple meningiomas following radiation therapy for medulloblastoma. Case report. J Neurosurg 55 (2): 282-6, 1981.
- Mack EE, Wilson CB: Meningiomas induced by high-dose cranial irradiation. J Neurosurg 79 (1): 28-31, 1993.
- Moss SD, Rockswold GL, Chou SN, et al.: Radiation-induced meningiomas in pediatric patients. Neurosurgery 22 (4): 758-61, 1988.
- Chiritescu E, Maloney ME: Acrochordons as a presenting sign of nevoid basal cell carcinoma syndrome. J Am Acad Dermatol 44 (5): 789-94, 2001.
- Tom WL, Hurley MY, Oliver DS, et al.: Features of basal cell carcinomas in basal cell nevus syndrome. Am J Med Genet A 155A (9): 2098-104, 2011.
- Lo Muzio L, Nocini PF, Savoia A, et al.: Nevoid basal cell carcinoma syndrome. Clinical findings in 37 Italian affected individuals. Clin Genet 55 (1): 34-40, 1999.
- Goldstein AM, Pastakia B, DiGiovanna JJ, et al.: Clinical findings in two African-American families with the nevoid basal cell carcinoma syndrome (NBCC). Am J Med Genet 50 (3): 272-81, 1994.
- Yasar B, Byers HJ, Smith MJ, et al.: Common variants modify the age of onset for basal cell carcinomas in Gorlin syndrome. Eur J Hum Genet 23 (5): 708-10, 2015.
- Mazzola CA, Pollack IF: Medulloblastoma. Curr Treat Options Neurol 5 (3): 189-198, 2003.
- Amlashi SF, Riffaud L, Brassier G, et al.: Nevoid basal cell carcinoma syndrome: relation with desmoplastic medulloblastoma in infancy. A population-based study and review of the literature. Cancer 98 (3): 618-24, 2003.
- Cowan R, Hoban P, Kelsey A, et al.: The gene for the naevoid basal cell carcinoma syndrome acts as a tumour-suppressor gene in medulloblastoma. Br J Cancer 76 (2): 141-5, 1997.
- Evans DG, Farndon PA, Burnell LD, et al.: The incidence of Gorlin syndrome in 173 consecutive cases of medulloblastoma. Br J Cancer 64 (5): 959-61, 1991.
- Berlin NI, Van Scott EJ, Clendenning WE, et al.: Basal cell nevus syndrome. Combined clinical staff conference at the National Institutes of Health. Ann Intern Med 64 (2): 403-21, 1966.
- Jackson R, Gardere S: Nevoid basal cell carcinoma syndrome. Can Med Assoc J 105 (8): 850 passim, 1971.
- Lindeberg H, Halaburt H, Larsen PO: The naevoid basal cell carcinoma syndrome. Clinical, biochemical and radiological aspects. J Maxillofac Surg 10 (4): 246-9, 1982.
- CAWSON RA, KERR GA: THE SYNDROME OF JAW CYSTS, BASAL CELL TUMOURS AND SKELETAL ABNORMALITIES. Proc R Soc Med 57: 799-801, 1964.
- Kedem A, Even-Paz Z, Freund M: Basal cell nevus syndrome associated with malignant melanoma of the iris. Dermatologica 140 (2): 99-106, 1970.
- Zvulunov A, Strother D, Zirbel G, et al.: Nevoid basal cell carcinoma syndrome. Report of a case with associated Hodgkin's disease. J Pediatr Hematol Oncol 17 (1): 66-70, 1995.
- Potaznik D, Steinherz P: Multiple nevoid basal cell carcinoma syndrome and Hodgkin's disease. Cancer 53 (12): 2713-5, 1984.
- Beddis IR, Mott MG, Bullimore J: Case report: nasopharyngeal rhabdomyosarcoma and Gorlin's naevoid basal cell carcinoma syndrome. Med Pediatr Oncol 11 (3): 178-9, 1983.
- Sobota A, Pena M, Santi M, et al.: Undifferentiated sinonasal carcinoma in a patient with nevoid basal cell carcinoma syndrome. Int J Surg Pathol 15 (3): 303-6, 2007.
- González-Alva P, Tanaka A, Oku Y, et al.: Keratocystic odontogenic tumor: a retrospective study of 183 cases. J Oral Sci 50 (2): 205-12, 2008.
- Suzuki M, Nagao K, Hatsuse H, et al.: Molecular pathogenesis of keratocystic odontogenic tumors developing in nevoid basal cell carcinoma syndrome. Oral Surg Oral Med Oral Pathol Oral Radiol 116 (3): 348-53, 2013.
- Shear M: The aggressive nature of the odontogenic keratocyst: is it a benign cystic neoplasm? Part 1. Clinical and early experimental evidence of aggressive behaviour. Oral Oncol 38 (3): 219-26, 2002.
- Guo YY, Zhang JY, Li XF, et al.: PTCH1 gene mutations in Keratocystic odontogenic tumors: a study of 43 Chinese patients and a systematic review. PLoS One 8 (10): e77305, 2013.
- Gu XM, Zhao HS, Sun LS, et al.: PTCH mutations in sporadic and Gorlin-syndrome-related odontogenic keratocysts. J Dent Res 85 (9): 859-63, 2006.
- Lam KY, Chan AC: Odontogenic keratocysts: a clinicopathological study in Hong Kong Chinese. Laryngoscope 110 (8): 1328-32, 2000.
- North JP, McCalmont TH, LeBoit P: Palmar pits associated with the nevoid basal cell carcinoma syndrome. J Cutan Pathol 39 (8): 735-8, 2012.
- Chenevix-Trench G, Wicking C, Berkman J, et al.: Further localization of the gene for nevoid basal cell carcinoma syndrome (NBCCS) in 15 Australasian families: linkage and loss of heterozygosity. Am J Hum Genet 53 (3): 760-7, 1993.
- Ratcliffe JF, Shanley S, Ferguson J, et al.: The diagnostic implication of falcine calcification on plain skull radiographs of patients with basal cell naevus syndrome and the incidence of falcine calcification in their relatives and two control groups. Br J Radiol 68 (808): 361-8, 1995.
- Ratcliffe JF, Shanley S, Chenevix-Trench G: The prevalence of cervical and thoracic congenital skeletal abnormalities in basal cell naevus syndrome; a review of cervical and chest radiographs in 80 patients with BCNS. Br J Radiol 68 (810): 596-9, 1995.
- Betancourt NJ, Qian MF, Pickford JR, et al.: Gorlin Syndrome: Assessing Genotype-Phenotype Correlations and Analysis of Early Clinical Characteristics as Risk Factors for Disease Severity. J Clin Oncol 40 (19): 2119-2127, 2022.
- Fujii K, Ohashi H, Suzuki M, et al.: Frameshift mutation in the PTCH2 gene can cause nevoid basal cell carcinoma syndrome. Fam Cancer 12 (4): 611-4, 2013.
- Muller EA, Aradhya S, Atkin JF, et al.: Microdeletion 9q22.3 syndrome includes metopic craniosynostosis, hydrocephalus, macrosomia, and developmental delay. Am J Med Genet A 158A (2): 391-9, 2012.
- Huq AJ, Walsh M, Rajagopalan B, et al.: Mutations in SUFU and PTCH1 genes may cause different cutaneous cancer predisposition syndromes: similar, but not the same. Fam Cancer 17 (4): 601-606, 2018.
- Brugières L, Remenieras A, Pierron G, et al.: High frequency of germline SUFU mutations in children with desmoplastic/nodular medulloblastoma younger than 3 years of age. J Clin Oncol 30 (17): 2087-93, 2012.
- Aavikko M, Li SP, Saarinen S, et al.: Loss of SUFU function in familial multiple meningioma. Am J Hum Genet 91 (3): 520-6, 2012.
- Guerrini-Rousseau L, Dufour C, Varlet P, et al.: Germline SUFU mutation carriers and medulloblastoma: clinical characteristics, cancer risk, and prognosis. Neuro Oncol 20 (8): 1122-1132, 2018.
- DiGiovanna JJ, Kraemer KH: Shining a light on xeroderma pigmentosum. J Invest Dermatol 132 (3 Pt 2): 785-96, 2012.
- Michaëlsson G, Olsson E, Westermark P: The Rombo syndrome: a familial disorder with vermiculate atrophoderma, milia, hypotrichosis, trichoepitheliomas, basal cell carcinomas and peripheral vasodilation with cyanosis. Acta Derm Venereol 61 (6): 497-503, 1981.
- van Steensel MA, Jaspers NG, Steijlen PM: A case of Rombo syndrome. Br J Dermatol 144 (6): 1215-8, 2001.
- Ashinoff R, Jacobson M, Belsito DV: Rombo syndrome: a second case report and review. J Am Acad Dermatol 28 (6): 1011-4, 1993.
- Viksnins P, Berlin A: Follicular atrophoderma and basal cell carcinomas: the Bazex syndrome. Arch Dermatol 113 (7): 948-51, 1977.
- Vabres P, de Prost Y: Bazex-Dupré-Christol syndrome: a possible diagnosis for basal cell carcinomas, coarse sparse hair, and milia. Am J Med Genet 45 (6): 786, 1993.
- Rapelanoro R, Taïeb A, Lacombe D: Congenital hypotrichosis and milia: report of a large family suggesting X-linked dominant inheritance. Am J Med Genet 52 (4): 487-90, 1994.
- Vabres P, Lacombe D, Rabinowitz LG, et al.: The gene for Bazex-Dupré-Christol syndrome maps to chromosome Xq. J Invest Dermatol 105 (1): 87-91, 1995.
- Parren LJ, Abuzahra F, Wagenvoort T, et al.: Linkage refinement of Bazex-Dupré-Christol syndrome to an 11·4-Mb interval on chromosome Xq25-27.1. Br J Dermatol 165 (1): 201-3, 2011.
- Parrish JA, Baden HP, Goldsmith LA, et al.: Studies of the density and the properties of the hair in a new inherited syndrome of hypotrichosis. Ann Hum Genet 35 (3): 349-56, 1972.
- Gould DJ, Barker DJ: Follicular atrophoderma with multiple basal cell carcinomas (Bazex). Br J Dermatol 99 (4): 431-5, 1978.
- Yung A, Newton-Bishop JA: A case of Bazex-Dupré-Christol syndrome associated with multiple genital trichoepitheliomas. Br J Dermatol 153 (3): 682-4, 2005.
- Kidd A, Carson L, Gregory DW, et al.: A Scottish family with Bazex-Dupré-Christol syndrome: follicular atrophoderma, congenital hypotrichosis, and basal cell carcinoma. J Med Genet 33 (6): 493-7, 1996.
- Arin MJ, Grimberg G, Schumann H, et al.: Identification of novel and known KRT5 and KRT14 mutations in 53 patients with epidermolysis bullosa simplex: correlation between genotype and phenotype. Br J Dermatol 162 (6): 1365-9, 2010.
- Has C, Bauer JW, Bodemer C, et al.: Consensus reclassification of inherited epidermolysis bullosa and other disorders with skin fragility. Br J Dermatol 183 (4): 614-627, 2020.
- Fine JD: Inherited epidermolysis bullosa. Orphanet J Rare Dis 5: 12, 2010.
- Fine JD: Epidemiology of Inherited Epidermolysis Bullosa Based on Incidence and Prevalence Estimates From the National Epidermolysis Bullosa Registry. JAMA Dermatol 152 (11): 1231-1238, 2016.
- Fine JD, Johnson LB, Weiner M, et al.: Epidermolysis bullosa and the risk of life-threatening cancers: the National EB Registry experience, 1986-2006. J Am Acad Dermatol 60 (2): 203-11, 2009.
- García M, Santiago JL, Terrón A, et al.: Two novel recessive mutations in KRT14 identified in a cohort of 21 Spanish families with epidermolysis bullosa simplex. Br J Dermatol 165 (3): 683-92, 2011.
- Bolling MC, Lemmink HH, Jansen GH, et al.: Mutations in KRT5 and KRT14 cause epidermolysis bullosa simplex in 75% of the patients. Br J Dermatol 164 (3): 637-44, 2011.
- Johnson RL, Rothman AL, Xie J, et al.: Human homolog of patched, a candidate gene for the basal cell nevus syndrome. Science 272 (5268): 1668-71, 1996.
- Hahn H, Wicking C, Zaphiropoulous PG, et al.: Mutations of the human homolog of Drosophila patched in the nevoid basal cell carcinoma syndrome. Cell 85 (6): 841-51, 1996.
- Scheinfeld N, Hu G, Gill M, et al.: Identification of a recurrent mutation in the CYLD gene in Brooke-Spiegler syndrome. Clin Exp Dermatol 28 (5): 539-41, 2003.
- Bignell GR, Warren W, Seal S, et al.: Identification of the familial cylindromatosis tumour-suppressor gene. Nat Genet 25 (2): 160-5, 2000.
- Weyers W, Nilles M, Eckert F, et al.: Spiradenomas in Brooke-Spiegler syndrome. Am J Dermatopathol 15 (2): 156-61, 1993.
- Rajan N, Langtry JA, Ashworth A, et al.: Tumor mapping in 2 large multigenerational families with CYLD mutations: implications for disease management and tumor induction. Arch Dermatol 145 (11): 1277-84, 2009.
- Requena L, Fariña MC, Robledo M, et al.: Multiple hereditary infundibulocystic basal cell carcinomas: a genodermatosis different from nevoid basal cell carcinoma syndrome. Arch Dermatol 135 (10): 1227-35, 1999.
- Nordin H, Månsson T, Svensson A: Familial occurrence of eccrine tumours in a family with ectodermal dysplasia. Acta Derm Venereol 68 (6): 523-30, 1988.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Basal Cell Skin Cancer. Version 2.2022. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2022.
Available online with free subscription Last accessed June 24, 2024. - Foulkes WD, Kamihara J, Evans DGR, et al.: Cancer Surveillance in Gorlin Syndrome and Rhabdoid Tumor Predisposition Syndrome. Clin Cancer Res 23 (12): e62-e67, 2017.
- Lin JS, Eder M, Weinmann S, et al.: Behavioral Counseling to Prevent Skin Cancer: Systematic Evidence Review to Update the 2003 U.S. Preventive Services Task Force Recommendation. Agency for Healthcare Research and Quality, 2011. Report No.: 11-05152-EF-1.
Also available online . Last accessed April 25, 2024. - Peck GL, DiGiovanna JJ, Sarnoff DS, et al.: Treatment and prevention of basal cell carcinoma with oral isotretinoin. J Am Acad Dermatol 19 (1 Pt 2): 176-85, 1988.
- Goldberg LH, Hsu SH, Alcalay J: Effectiveness of isotretinoin in preventing the appearance of basal cell carcinomas in basal cell nevus syndrome. J Am Acad Dermatol 21 (1): 144-5, 1989.
- Cristofolini M, Zumiani G, Scappini P, et al.: Aromatic retinoid in the chemoprevention of the progression of nevoid basal-cell carcinoma syndrome. J Dermatol Surg Oncol 10 (10): 778-81, 1984.
- Tang JY, Mackay-Wiggan JM, Aszterbaum M, et al.: Inhibiting the hedgehog pathway in patients with the basal-cell nevus syndrome. N Engl J Med 366 (23): 2180-8, 2012.
- Tang JY, Ally MS, Chanana AM, et al.: Inhibition of the hedgehog pathway in patients with basal-cell nevus syndrome: final results from the multicentre, randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Oncol 17 (12): 1720-1731, 2016.
- Dréno B, Kunstfeld R, Hauschild A, et al.: Two intermittent vismodegib dosing regimens in patients with multiple basal-cell carcinomas (MIKIE): a randomised, regimen-controlled, double-blind, phase 2 trial. Lancet Oncol 18 (3): 404-412, 2017.
- Chen AC, Martin AJ, Choy B, et al.: A Phase 3 Randomized Trial of Nicotinamide for Skin-Cancer Chemoprevention. N Engl J Med 373 (17): 1618-26, 2015.
- Stockfleth E, Ulrich C, Hauschild A, et al.: Successful treatment of basal cell carcinomas in a nevoid basal cell carcinoma syndrome with topical 5% imiquimod. Eur J Dermatol 12 (6): 569-72, 2002 Nov-Dec.
- Mougel F, Debarbieux S, Ronger-Savlé S, et al.: Methylaminolaevulinate photodynamic therapy in patients with multiple basal cell carcinomas in the setting of Gorlin-Goltz syndrome or after radiotherapy. Dermatology 219 (2): 138-42, 2009.
- Basset-Seguin N, Bissonnette R, Girard C, et al.: Consensus recommendations for the treatment of basal cell carcinomas in Gorlin syndrome with topical methylaminolaevulinate-photodynamic therapy. J Eur Acad Dermatol Venereol 28 (5): 626-32, 2014.
- Skvara H, Kalthoff F, Meingassner JG, et al.: Topical treatment of Basal cell carcinomas in nevoid Basal cell carcinoma syndrome with a smoothened inhibitor. J Invest Dermatol 131 (8): 1735-44, 2011.
- Goldberg LH, Landau JM, Moody MN, et al.: Resolution of odontogenic keratocysts of the jaw in basal cell nevus syndrome with GDC-0449. Arch Dermatol 147 (7): 839-41, 2011.
- Ally MS, Tang JY, Joseph T, et al.: The use of vismodegib to shrink keratocystic odontogenic tumors in patients with basal cell nevus syndrome. JAMA Dermatol 150 (5): 542-5, 2014.
Carcinoma de células escamosas
Introducción
El carcinoma de células escamosas (CCE) es el segundo tipo más común de cáncer de piel y representa cerca del 20 % de las neoplasias malignas cutáneas. Aunque la mayoría de los registros de cáncer no incluyen información sobre la incidencia de los carcinomas de queratinocitos (carcinoma de células basales [CCB] y CCE), la incidencia anual estimada oscila entre 1 millón a 5,4 millones de casos en los Estados Unidos.[
La muerte por este cáncer es infrecuente; sin embargo, la morbilidad y los costos del tratamiento son considerables.
Factores de riesgo del carcinoma de células escamosas
Exposición solar y otros factores de riesgo
La exposición al sol es el principal factor ambiental conocido que se relaciona con la formación del cáncer en todos los tipos de cáncer de piel; sin embargo, hay diferentes patrones de exposición al sol que se vinculan con cada tipo principal de cáncer de piel.[
Características de la piel
El CCB y el CCE, al igual que el melanoma, se presenta de manera más frecuente en personas de piel más clara que en personas de piel más oscura.[
Sin embargo, el CCE también se presenta en personas de piel más oscura. En un registro asiático con sede en Singapur se notificó un aumento de cáncer de piel en esa zona geográfica, con una tasa de incidencia de 8,9 por 100 000 años-persona. Sin embargo, se observó que la incidencia de CCE estaba en descenso.[
Las pecas en la piel y la reacción de la piel a la exposición solar son otros factores de riesgo identificados del CCE.[
La presencia de cicatrices en la piel también aumenta el riesgo de CCE, aunque la carcinogénesis en este entorno quizás tome años o incluso decenios. Los CCE que se presentan en heridas crónicas se conocen como úlceras de Marjolin. La media de tiempo hasta la formación del carcinoma en estas heridas es de 26 años.[
Inmunodepresión
La inmunodepresión también contribuye a la formación de CCB y CCE. En las personas receptores de trasplantes de órganos sólidos, el riesgo de CCE es de 65 a 250 veces más alto, y el riesgo de CCB es 10 veces más alto que el observado en la población general, aunque el riesgo varía según el tipo de trasplante y el fármaco inmunodepresor.[
Antecedentes personales de cáncer de piel de células basales, de células escamosas y melanoma
Los antecedentes personales de CCB o CCE se relacionan de manera importante con un CCB o CCE posterior. En un estudio en Irlanda se observó que las personas con antecedentes de CCB tenían una incidencia 14 % más alta de CCE subsiguiente; en los hombres con antecedentes de CCB, el riesgo de CCE subsiguiente fue un 27 % más alto.[
En un estudio Suizo de 224 probandos con melanoma y 944 familiares de primer grado (FPG) de 154 familias con CDKN2A normal y 11 680 controles emparejados, se observó que los antecedentes personales y familiares de melanoma aumentan el riesgo de SCC, con un riesgo relativo (RR) de 9,1 (IC 95 %, 6,0–13,7) para los antecedentes personales y de 3,4 (IC 95 %, 2,2–5,2) para los antecedentes familiares.[
Historia familiar de carcinoma de células escamosas o lesiones premalignas asociadas
Si bien la bibliografía es escasa sobre este tema, una historia familiar de CCE aumenta el riesgo de CCE en los FPG. En un estudio independiente de encuestas se analizaron 415 casos de CCE y 415 controles, el riesgo de CCE aumentó en las personas con una historia familiar de CCE (OR ajustada, 3,4; IC 95 %, 1,0–11,6), incluso después del ajuste por tipo de piel, color de cabello y color de ojos.[
En un estudio sobre la heredabilidad del cáncer en 80 309 gemelos monocigóticos y 123 382 gemelos dicigóticos, se observó que los NMSC tienen una heredabilidad del 43 % (IC 95 %, 26–59 %), lo que indica que casi la mitad del riesgo de este cáncer se debe a factores hereditarios.[
Síndromes y genes asociados con la predisposición al carcinoma de células escamosas
En otras partes de este resumen se definen los principales genes que son necesarios y suficientes para que aparezca la enfermedad, además de las variantes patogénicas de estos genes que se consideran causales de enfermedad. Los trastornos producidos por las variantes patogénicas de un solo gen en determinadas familias conllevan un riesgo muy alto de enfermedad y son relativamente infrecuentes. La influencia del medio ambiente en la aparición de la enfermedad en personas con estos trastornos de un solo gen a menudo es muy difícil de determinar debido a la rareza de la variante genética.
La identificación de un factor de riesgo ambiental fuerte, como la exposición crónica a la radiación UV, dificulta el análisis de la causalidad genética del CCE cutáneo. Aunque el riesgo que se deriva de la exposición a la radiación UV es bien conocido, la cuantificación del riesgo atribuible para la formación del cáncer es un reto. Además, la determinación de los casos de CCE de piel no siempre es sencilla. En muchos registros y estudios epidemiológicos no se evalúa por completo la incidencia del CCE de la piel debido a los siguientes aspectos: 1) es una práctica común tratar lesiones sospechosas de CCE incluso cuando no se cuenta con diagnóstico por biopsia y 2) el potencial de metástasis es relativamente bajo. Además, el NMSC se suele excluir de manera rutinaria de los principales registros del cáncer, como el Surveillance, Epidemiology, and End Results.
Teniendo en cuenta estas consideraciones, el análisis que sigue se enfoca en los genes relacionados con trastornos que aumentan la incidencia de cáncer de piel.
Las características de los principales síndromes hereditarios relacionados con una predisposición al CCE se describen en el
| Afección | Genes | Vías |
|---|---|---|
| SWI/SNF =SWItch/Sucrose Non-Fermentable. | ||
| a Información de Loh et al.[ |
||
| |
BLM/RECQL3 | Estabilidad cromosómica |
| |
LYST | Regulación del transporte lisosómico |
| |
DKC1,TERC,TINF2,NHP2/NOLA2,NOP10/NOLA3,TERT,WRAP53,C16orf57,RTEL1 | Mantenimiento y transporte detelómeros |
| |
COL7A1 | Anclaje de colágeno de la membrana basal a la dermis |
| |
MYO5A | Transporte de gránulos de pigmentos |
| |
EVER1/TMC6,EVER2/TMC8 | Transducción de señales en el retículo endoplasmático |
| |
FANCA,FANCB,FANCC,FANCD1/BRCA2,FANCD2,FANCE,FANCF,FANCG/XRCC9,FANCI,FANCJ/BRIP1/BACH1,FANCL,FANCM,FANCN/PALB2,FANCO/RAD51C,FANCP/SLX4/BTBD12,FANCQ/ERCC4/XPF,FANCS/BRCA1 | Reparación delDNA |
| |
MYO5A,RAB27A,MLPH | Transporte de gránulos de pigmentos |
| |
HPS1,HPS2/AP3B1,HPS3,HPS4,HPS5,HPS6,HPS7/DTNBP1,HPS8/BLOC1S3,HPS9/BLOC1S6,HPS10/AP3D1 | Almacenamiento de melanosomas y lisosomas |
| Síndrome de Hurieza | SMARCAD1 | vía SWI/SNF reguladora de cromatina |
| |
LAMA3,LAMB3,LAMC2,COL17A1 | Tejido conjuntivo |
| |
TGFBR1 | Señalización de factores de crecimiento |
| |
TYR,OCA2,TYRP1,SLC45A2/MATP/OCA4, locus 4q24,SLC24A5,C10Orf11 | Síntesis de melanina |
| |
ANAPC1 | Ciclo celular |
| |
RECQL4,C16orf57 | Estabilidad cromosómica |
| |
WRN/RECQL2 | Estabilidad cromosómica |
| |
XPA,XPB/ERCC3,XPC,XPD/ERCC2,XPE/DDB2,XPF/ERCC4,XPG/ERCC5 | Reparación de la escisión de nucleótidos |
| |
POLH | Polimerasa propensa a error |
Xeroderma pigmentoso
El xeroderma pigmentoso (XP) es un trastorno hereditario de la reparación por escisión de nucleótidos que produce neoplasias malignas cutáneas en la primera década de la vida.[
La historia natural de esta enfermedad comienza en el primer año de vida, cuando la sensibilidad al sol se hace evidente, y aparece xerosis (piel seca) y cambios pigmentarios en la piel expuesta al sol. Cerca de la mitad de los pacientes de XP tienen antecedentes de quemaduras graves con exposición solar mínima. Otros pacientes con XP no tienen esta reacción, pero presentan pigmentación en forma de pecas antes de los 2 años en sitios expuestos al sol. Estas manifestaciones progresan a atrofia cutánea y formación de telangiectasias. Cerca de la mitad de las personas con este trastorno presentarán CCB o CCE, y alrededor de un cuarto de estas personas padecerá de melanoma.[
Las manifestaciones no cutáneas de XP abarcan anomalías oftalmológicas, neurológicas y del envejecimiento. Las anomalías de la córnea y los párpados que se presentan en la XP se vinculan con exposición a la radiación UV. Los ejemplos de anomalías oftalmológicas incluyen queratitis, opacidad corneal, ectropión, entropión, hiperpigmentación de los párpados, pérdida de las pestañas y cáncer (incluso cáncer de conjuntiva y córnea).[
En personas con XP también se han notificado varias neoplasias no cutáneas, en su mayoría CCE de la punta de la lengua, cáncer del sistema nervioso central, cánceres hematológicos, cáncer de tiroides, cánceres ginecológicos y cáncer de pulmón en personas que fuman.[
La herencia de XP es autosómica recesiva. Se han identificado 7 grupos de complementación asociados con este trastorno. Cerca del 40 % de los casos de XP observados en los NIH fueron de XPC. Se observaron variantes patogénicas de ERCC2 (XPD) en casi el 20 %. El grupo de complementación A, debido a una variante patogénica del gen XPA, representa cerca del 10 % de los casos.[
La función de los genes XP es reconocer y reparar los fotoproductos de la radiación UV. Los principales fotoproductos se forman en las pirimidinas adyacentes y constan de dímeros de ciclobutano y fotoproductos pirimidina-pirimidona (6-4). El producto de XPC participa en la identificación inicial del daño al DNA; se une a la lesión y actúa como un marcador para la reparación posterior. La proteína DDB2 (XPE) también participa en este proceso y funciona con XPC. El producto del gen XPA mantiene regiones de una sola hebra durante la reparación y actúa con el complejo del factor transcripción TFIII. El complejo TFIIH incluye los productos génicos de ERCC3 (XPB) y ERCC2 (XPD), que funcionan como helicasas de DNA durante el desenrollado del DNA. Las proteínas ERCC4 (XPF) y ERCC5 (XPG) actúan como endonucleasas del DNA para crear muescas en una sola cadena en los extremos 5' y 3' del DNA dañado, lo que conlleva la escisión de 28 a 30 nucleótidos, que incluye el fotoproducto. Las polimerasas de DNA reemplazan la lesión con la secuencia correcta y una ligasa de DNA completa la reparación.[
Una variante de XP que se asocia con variantes patogénicas de POLH (XPV) es responsable de alrededor del 10 % de los casos reportados.[
El trabajo de investigación sobre las correlaciones entre genotipo y fenotipo en los grupos de complementación de XP continúa; sin embargo, la evidencia indica que la variante patogénica específica quizás tenga más influencia sobre el fenotipo que el grupo de complementación.[
El diagnóstico de XP se establece a partir de los hallazgos clínicos y la historia familiar. Se han desarrollado ensayos funcionales para evaluar la capacidad de reparación del DNA después de la exposición a la radiación, pero estas pruebas no están disponibles en el ámbito clínico en los Estados Unidos. El uso de pruebas genéticas clínicas con análisis de secuencia para identificar variantes patogénicas está disponible para múltiples genes asociados con XP; la lista se encuentra en el
Epitelioma escamoso autocurativo múltiple (síndrome de Ferguson-Smith)
El epitelioma escamoso autocurativo múltiple (MSSE) o síndrome de Ferguson-Smith, descrito por primera vez en 1934, se caracteriza por tumores de piel invasores que son histológicamente idénticos al CCE cutáneo esporádico, pero que resuelven de manera espontánea sin intervención. El análisis de ligamiento de familias afectadas exhibe una asociación con el brazo largo del cromosoma 9, y el análisis del haplotipo ubica el gen 9q22.3 entre D9S197 y D9S1809.[
En esta ubicación genómica se encontró pérdida de heterocigosidad somática en el CCE relacionado con el síndrome de Ferguson-Smith, lo que indica que TGFBR1 puede actuar como gen supresor de tumores.[
Albinismo oculocutáneo
El albinismo es un factor de riesgo importante para el cáncer de piel en personas de ascendencia africana.[
El CCE que se presenta a edades muy tempranas es una característica distintiva del albinismo oculocutáneo. En una cohorte de casi 1000 pacientes nigerianos con albinismo, todos presentaban lesiones cutáneas malignas o premalignas a los 20 años de edad.[
Se sabe que dos tipos de albinismo oculocutáneo se relacionan con un aumento del riesgo de CCE en la piel. El albinismo oculocutáneo de tipo 1, o albinismo relacionado con la tirosinasa, se produce por variantes patogénicas del gen de la tirosinasa TYR, ubicado en el brazo largo del cromosoma 11. Este tipo de albinismo explica alrededor de la mitad de los casos en personas de ascendencia europea.[
La tirosinasa actúa como una enzima esencial para la síntesis de melanina en los melanocitos. Una variante de este gen propia del albinismo oculocutáneo de tipo 1 produce proteínas con poca o nula actividad, que corresponden a los fenotipos OCA1B y OCA1A, respectivamente. Las personas con OCA1B nacen con un color claro en la piel, el cabello y los ojos, y luego adquieren un poco de pigmento durante la vida; por el contrario, las personas con OCA1A no adquieren pigmentación con la edad.
El producto del gen OCA2 es una proteína que se encuentra en la membrana de los melanosomas. Aunque se desconoce su función específica, participa en el mantenimiento de la estructura o el pH de este entorno.[
Las variantes genéticas de SLC45A2 (MATP asociada a OCA4), SLC24A5 (asociada a OCA6) y TYRP1 (proteína 1 relacionada con la tirosinasa asociada a OCA3) se vinculan con tipos menos comunes de albinismo oculocutáneo. La incidencia reportada de alteraciones en estos genes en una población internacional de pacientes con albinismo fue del 7 % para SLC45A2, 1 % para TYRP1, y menos de 0,5 % para SLC24A5.[
Se encontraron otros genes relacionados con albinismo oculocutáneo en un número pequeño de pacientes. El gen OCA5, ubicado en el cromosoma 4q24, se identificó en una familia de Pakistán, mientras que la causa de OCA6 son variantes patogénicas de SLC24A5 en el cromosoma 15q21.[
Si bien la mayoría de los casos de albinismo oculocutáneo se heredan como un trastorno autosómico recesivo, en un estudio se encontró que hay sobrerrepresentación de variantes heterocigotas de genes como TYR, OCA2, TYRP1 y SLC45A2 en familias con múltiples casos de melanoma. Se requiere más investigación para determinar si estos genes son genes de susceptibilidad al melanoma de penetrancia moderada en heterocigotos.[
| Tipo | Subtipo | Gen | Población de notificación | Disponibilidad de la prueba clínica |
|---|---|---|---|---|
| Albinismo oculocutáneo de tipo 1 | 1A | TYR | Japonesa,[ |
Sí |
| 1B | TYR | |||
| Albinismo oculocutáneo de tipo 2 | OCA2(genP) | Africana,[ |
Sí | |
| Albinismo oculocutáneo de tipo 3 | TYRP1 | Africana,[ |
Sí | |
| Albinismo oculocutáneo de tipo 4 | SLC45A2 (MATP) | Japonesa,[ |
Sí | |
| Albinismo oculocutáneo de tipo 5 | OCA5 | Pakistaní[ |
No en los Estados Unidos | |
| Albinismo oculocutáneo de tipo 6 | SLC24A5 | china,[ |
Sí | |
| Albinismo oculocutáneo de tipo 7 | C10orf11(LRMDA) | de las islas Faroe,[ |
Sí |
Otros síndromes de albinismo
Un subgrupo de albinismo incluye a las personas que exhiben una tríada de albinismo, tiempo de sangrado prolongado y depósito de una sustancia ceroide en órganos como los pulmones y el aparato digestivo. Este síndrome, conocido como síndrome de Hermansky-Pudlak, se hereda de manera autosómica recesiva, pero es posible que tenga una herencia pseudodominante en familias puertorriqueñas, debido a la prevalencia elevada en esta población.[
Otros 2 síndromes se asocian con disminución de la pigmentación de la piel y los ojos. El síndrome de Chediak-Higashi es un trastorno autosómico recesivo que se caracteriza por cuerpos de inclusión eosinofílicos positivos para peroxidasa en precursores leucocitarios tempranos, hemofagocitosis, aumento de la susceptibilidad a infecciones y aumento de la incidencia de una linfohistiocitosis de fase acelerada. Las variantes patogénicas del gen LYST son la base de este síndrome, que suele producir la muerte en la primera década de vida.[
El síndrome de Griscelli, que también se hereda de manera autosómica recesiva, se describió originalmente como disminución de la pigmentación cutánea con hipomelanosis y deterioro neurológico, pero su presentación clínica es bastante variable. Esta combinación de síntomas ahora se denomina síndrome de Griscelli de tipo 1 o enfermedad de Elejalde. Se atribuye a las variantes patogénicas del gen MYO5A, que afecta el transporte de melanosomas.[
Epidermólisis ampollosa
Hay numerosas formas de epidermólisis ampollosa (EB), que se caracteriza por fisuras y ampollas en la piel. En un estudio del registro holandés de EB se encontró una incidencia general de EB de 41,3 por millón de personas nacidas vivas y de 22,4 por millón de personas de la población general.[
Epidermólisis ampollosa distrófica
Cerca del 95 % de las personas con el trastorno hereditario epidermólisis ampollosa distrófica (DEB) tienen una variante germinal patogénica detectable del gen COL7A1. Este gen (ubicado en 3p21.3), se expresa en los queratinocitos basales de la epidermis y codifica el colágeno de tipo VII. Este colágeno compone las fibrillas que unen la membrana basal con la dermis, y proporcionan estabilidad estructural y resistencia de la piel a traumatismos leves.[
Hay dos subtipos de DEB de herencia recesiva: generalizada grave (RDEB-sev gen; antes conocida como de tipo Hallopeau-Siemens) y generalizada de otro tipo o generalizada intermedia (RDEB-O; antes conocida como de tipo no–Hallopeau-Siemens); y una forma de herencia dominante, epidermólisis ampollosa distrófica dominante (DDEB).[
La tasa de variantes patogénicas de novo para el DDEB es de alrededor del 30 %; también se ha notificado mosaicismo germinal materno.[
Las variantes patogénicas de COL7A1 producen un enrollamiento helicoidal triple anormal con funcionamiento reducido, lo que aumenta la fragilidad cutánea y el ampollamiento. En los estudios de la carcinogénesis dirigida por RAS en queratinocitos de la RDEB generalizada grave, la retención del NC1 aminoterminal, el primer fragmento no colagenoso del colágeno de tipo VII, es oncogénico en ratones.[
Epidermólisis ampollosa de la unión
La epidermólisis ampollosa de la unión (JEB) es un tipo de EB autosómica recesiva con una incidencia estimada de 2,68 por millón de personas nacidas vivas y una prevalencia estimada de 0,49 por millón de personas en los Estados Unidos.[
Epidermodisplasia verruciforme
Las variantes patogénicas en cualquiera de dos genes adyacentes en el cromosoma 17q25 pueden causar epidermodisplasia verruciforme, un trastorno hereditario raro asociado con una mayor susceptibilidad a la infección por virus del papiloma humano (VPH). La infección con ciertos subtipos de VPH produce lesiones verrugosas generalizadas persistentes, que se convierten en CCE in situ e invasores en un 30 % a un 60 % de los pacientes.[
Los genes asociados con este trastorno, EVER1 y EVER2, se identificaron en el 2002.[
En un estudio de casos y controles reciente se examinó el efecto de un polimorfismo específico en el gen EVER2 (rs7208422) sobre el riesgo de CCE cutáneo en 239 personas con antecedentes de CCE y 432 controles. Este polimorfismo es una variante de un solo nucleótido con codificación (A > T) en el exón 8, codón 306 del gen EVER2. La frecuencia del alelo T entre los controles fue de 0,45. La homocigosis para el polimorfismo causó un aumento modesto en el riesgo de CCE, con una OR ajustada de 1,7 (IC 95 %, 1,1–2,7) en relación con los homocigotos para el tipo normal del gen. En este estudio, también se encontró que aquellos con uno o más de los alelos T tienen mayor seropositividad para cualquier tipo de VPH y para los tipos de VPH 5 y 8, en comparación con el tipo normal.[
Hay evidencia que indica heterogeneidad no alélica en la epidermodisplasia verruciforme. En una persona nacida de progenitores emparentados con epidermodisplasia verruciforme, que además tenía infecciones bacterianas y fúngicas, se encontraron variantes patogénicas homocigotas R115X en el gen MST1.[
Anemia de Fanconi
La anemia de Fanconi es un trastorno complejo que se caracteriza por un aumento de la incidencia de tumores hematológicos y sólidos, como el CCE de piel. La anemia de Fanconi es una enfermedad de herencia autosómica recesiva. Se trata de un síndrome relativamente raro con una frecuencia estimada de portadores de 1 de cada 181 personas en los Estados Unidos (intervalo: 1 en 156 hasta 1 en 209) y una frecuencia de portadores de hasta 1 en 100 personas con ascendencia judía askenazí.[
Las personas con esta enfermedad tienen un aumento de la susceptibilidad a los agentes entrecruzadores del DNA (por ejemplo, mitomicina-C o diepoxibutano) y a la radiación ionizante y UV. El diagnóstico de esta enfermedad se determina al observar un aumento de la rotura cromosómica, reordenamientos o intercambios en las células después de la exposición a carcinógenos como el diepoxibutano.
Se han identificado 17 grupos de complementación en la anemia de Fanconi; la información detallada de los genes asociados a estos grupos se registra en el
| Gen | Locus | Incidencia aproximada en pacientes con anemia de Fanconi (%) | Patrón de transmisión de la enfermedad |
|---|---|---|---|
| AR = autosómico recesivo; XLR =recesivo ligada al cromosoma X. | |||
| FANCA | 16q24.3 | 70 | AR |
| FANCB | Xp22.31 | Raro | XLR |
| FANCC | 9q22.3 | 10 | AR |
| FANCD1(BRCA2) | 13q12.3 | Raro | AR |
| FANCD2 | 3p25.3 | Raro | AR |
| FANCE | 6p21.3 | 10 | AR |
| FANCF | 11p15 | Raro | AR |
| FANCG(XRCC9) | 9p13 | 10 | AR |
| FANCI(KIAA1794) | 15q25-26 | Raro | AR |
| FANCJ(BACH1/BRIP1) | 17q22.3 | Raro | AR |
| FANCL(PHF9/POG) | 2p16.1 | Raro | AR |
| FANCM(Hef) | 14q21.3 | Raro | AR |
| FANCN(PALB2) | 16p12.1 | Raro | AR |
| FANCO(RAD51C) | 17q22 | Raro | AR |
| FANCP(SLX4/BTBD12) | 16p13.3 | Raro | AR |
| FANCQ(ERCC4/XPF) | 16p13.12 | Raro | AR |
| FANCS(BRCA1) | 17q21.31 | Raro | AR |
Las proteínas que participan en la reparación del entrecruzamiento del DNA se conocen como vía FANC por su participación en la anemia de Fanconi.[
En 2018, un grupo reportó un aumento significativo en los casos de CCE (OR, 1,69; IC 95 %, 1,26–2,26) asociados con un alelo BRCA2 específico, que es relativamente prevalente en población islandesa (K3326X; frecuencia alélica, 1,1 %).[
Disqueratosis congénita (síndrome de Zinsser-Cole-Engman)
La disqueratosis congénita, al igual que el
Cerca del 10 % de las personas con disqueratosis congénita presentaran tumores no hematológicos, a menudo antes de la tercera década de vida.[
Múltiples genes asociados con la función de los telómeros (DKC1, TERC, TINF2, NHP2, NOP10, RTEL1 y TERT) están implicados en la disqueratosis congénita; aproximadamente la mitad de los pacientes con diagnóstico clínico de esta enfermedad tienen variantes patogénicas identificadas en 1 de estos 7 genes.[
El abordaje recomendado para el diagnóstico comienza con un ensayo de panel de 6 células para analizar la longitud telomérica de los leucocitos. Si la longitud de los telómeros está en el 1 % más bajo en 3 o más tipos celulares, se indica el uso de pruebas genéticas moleculares.[
Síndrome de Rothmund-Thomson
El síndrome de Rothmund-Thomson, también conocido como poiquilodermia congénita, es un trastorno hereditario caracterizado por inestabilidad cromosómica. La manifestación cutánea de esta afección es un exantema ampolloso eritematoso en la cara, los glúteos y las extremidades en la infancia temprana. Otras características de este síndrome son las telangiectasias, las anomalías esqueléticas, la estatura baja, las cataratas y el aumento del riesgo de osteosarcoma. Se desarrollan zonas de hiperpigmentación e hipopigmentación en la piel más adelante en la vida, y se puede presentar CCB o CCE a una edad temprana.[
Una variante patogénica del gen RECQL4 se identifica en el 66 % de las personas afectadas con manifestaciones clínicas del síndrome de Rothmund-Thomson de tipo 2. Este gen se ubica en 8q24.3, y se cree que su herencia es autosómica recesiva. RECQL4 codifica la helicasa de DNA dependiente de ATP de tipo Q4, que facilita el desenrollamiento del DNA para permitir procesos celulares como la replicación, la transcripción y la reparación. También se ha indicado que esta proteína cumple una función en la reparación de rupturas de la cadena doble de DNA.[
Se han identificado por lo menos 19 variantes patogénicas truncadoras diferentes de este gen que son deletéreas.[
Se encontró que 3 de 6 familias con síndrome de Rothmund-Thomson de tipo 2 exhibían variantes patogénicas homocigotas del gen C16orf57. También se identificaron variantes patogénicas de este gen en personas con disqueratosis congénita y poiquilodermia con neutropenia, lo que indica un vínculo entre estos síndromes;[
El cuadro clínico inicial del síndrome de Rothmund-Thomson de tipo 1 es similar al tipo 2, excepto que las personas tienen cataratas juveniles bilaterales y no presentan osteosarcoma. En un estudio de 7 familias con 10 niños con características de síndrome de Rothmund-Thomson de tipo 1 se identificó una variante de empalme intrónica profunda del gen ANAPC1.[
Síndrome de Bloom
La pérdida de estabilidad genómica es una causa importante del síndrome de Bloom. En este trastorno se produce aumento de la ruptura cromosómica y se diagnostica mediante un aumento de los intercambios de cromátidas hermanas en el análisis cromosómico. Las manifestaciones clínicas del síndrome de Bloom incluyen retraso grave del crecimiento, infecciones recurrentes, diabetes, enfermedad pulmonar crónica y aumento de la susceptibilidad a muchos tipos de cáncer. En un estudio de 290 participantes del Bloom Syndrome Registry (inscritos desde 1960 hasta 2021), se encontró que 155 participantes (53 %) presentaron una o más neoplasias malignas; la incidencia cumulada de cualquier tipo de cáncer a los 40 años fue del 83 %.[
El cáncer de piel explica alrededor del 9 % de los tumores en el Bloom Syndrome Registry.[
El gen BLM, ubicado en el brazo corto del cromosoma 15, es el único gen que se conoce está relacionado con el síndrome de Bloom. Este gen codifica una proteína de 1417 aminoácidos regulada por el ciclo celular que actúa como ATPasa dependiente de DNA y también desenrolla la doble hélice de DNA. El dominio de helicasa exhibe semejanza considerable con la subfamilia RecQ de las helicasas de DNA. Se piensa que la ausencia de este producto de gen desestabiliza otras enzimas que participan en la replicación y reparación del DNA.[
Este raro síndrome hereditario de ruptura cromosómica se hereda de manera autosómica recesiva y se caracteriza por pérdida de la estabilidad genómica. Se han descrito 64 variantes patogénicas del gen BLM que abarcan inserciones y deleciones de nucleótidos (41 %), variantes sin sentido (30 %), variantes que producen errores de empalme (14 %) y variantes de cambio de sentido (16 %).[
Se encontró que las células de personas con síndrome de Bloom tienen respuestas anormales a la radiación UV. La acumulación nuclear normal de TP53 después de la radiación UV estaba ausente en 2 de 11 cultivos celulares primarios de personas con síndrome de Bloom; en contraste, las respuestas en cultivos de personas que tienen XP y ataxia-telangiectasia eran normales.[
Síndrome de Werner
Al igual que el síndrome de Bloom, el síndrome de Werner se caracteriza por un inestabilidad cromosómica espontánea, lo que aumenta la susceptibilidad al cáncer y el envejecimiento prematuro. Los criterios diagnósticos, a menudo en el entorno de consanguinidad, incluyen cataratas, estatura corta, encanecimiento prematuro o adelgazamiento del cabello, y una prueba positiva de ácido hialurónico en orina de 24 horas. Las manifestaciones cutáneas cardinales de este trastorno son cambios cutáneos esclerodermatosos, ulceraciones, atrofia y cambios en la pigmentación. Las personas con este síndrome tienen una esperanza de vida promedio inferior a 50 años.[
Se han identificado variantes patogénicas del gen WRN en el cromosoma 8p12-p11.2 en cerca del 90 % de las personas con este síndrome; no se sabe que otros genes estén relacionados con el síndrome de Werner.[
Las variantes patogénicas descritas del gen WRN incluyen todos los tipos de variantes, como las de cambio de sentido, de sitio de empalme y reordenamientos grandes.[
Las variantes patogénicas del gen WRN causan disminución en la concentración nuclear del producto génico. Las concentraciones intracelulares de mRNA (ARN mensajero) y de la proteína que se origina de la variante también se reducen de manera marcada en comparación con las de tipo normal. La semivida de los mRNA y de la proteína que se origina de la variante también es más corta que la de los mRNA y proteínas de tipo normal.[
MC1R
En un metanálisis se observó que a mayor número de variantes patogénicas de MC1R en el portador, mayor es el riesgo de presentar CCE y CCB. Las personas con 2 o más variantes patogénicas de MC1R presentaron una OR de 2,48 (IC 95 %, 1,96–3,15) para el CCB y una OR de 2,80 (IC 95 %, 1,71–4,57) para el CCE; este riesgo aumentó en personas de cabello rojo.[
Intervenciones
Prevención y tratamiento de los cánceres de piel
En un ensayo clínico controlado con placebo y con enmascaramiento doble de fase III realizado en Australia, se evaluaron los efectos de la nicotinamida oral (vitamina B3) en 386 personas con antecedente de por lo menos 2 cánceres de piel no melanoma en los 5 años previos a la inscripción en el estudio.[
Nivel de evidencia (nicotinamida): 1aii
Debido a que muchos de los síndromes descritos antes son raros, se han llevado a cabo pocos ensayos clínicos en estas poblaciones específicas. Sin embargo, se ha obtenido información valiosa a partir de la experiencia clínica relacionada con el riesgo del cáncer de piel y el tratamiento en la población con XP. La evasión estricta de la exposición al sol desde la infancia, el uso de ropa protectora y la vigilancia clínica de la piel son componentes esenciales del tratamiento de la XP. Se recomienda tomar fotografías de toda la piel, las conjuntivas y los párpados como ayuda durante el seguimiento clínico.[
Nivel de evidencia: 5
La isotretinoína oral se ha utilizado como quimioprevención en pacientes con XP y los resultados son prometedores. En un pequeño estudio sobre el uso diario de isotretinoína (ácido retinoico 13-cis administrado en dosis de 2 mg/kg/día), se redujo la incidencia de NMSC en un 63 % en un número pequeño de personas con XP. Los efectos tóxicos del tratamiento abarcan síntomas mucocutáneos, alteraciones en las pruebas del funcionamiento hepático y las concentraciones de triglicéridos, además de síntomas osteomusculares como artralgias, calcificaciones de tendones y ligamentos, y osteoporosis.[
Nivel de evidencia (isotretinoína oral para la XP): 3aii
Nivel de evidencia (isotretinoína oral para el SNCB, síndrome de Rombo y epidermodisplasia verruciforme): 5
En un ensayo aleatorizado controlado con placebo en 30 pacientes con XP se investigó el efecto quimiopreventivo de la loción liposomal T4N5 para uso tópico que contiene la enzima bacteriana T4 endonucleasa V.[
Nivel de evidencia: 1aii
Se ha investigado la terapia con 5-FU en pacientes con XP que presentan un CCE irresecable. En un estudio prospectivo se usaron varios métodos de tratamiento, como terapia tópica de las lesiones, infusión sistémica breve de ácido fólico e infusión sistémica continua de ácido fólico con cisplatino. El tratamiento tópico con 5-FU demostró un poco de eficacia, pero en algunos casos quedó tumor viable en la profundidad de la dermis. La quimioterapia sistémica produjo 1 respuesta completa y 3 respuestas parciales en 5 pacientes, lo que indica que es una opción de tratamiento para lesiones generalizadas.[
Nivel de evidencia: 3diii
En los pacientes con EB, el tratamiento preferido sigue siendo la escisión local amplia del CCE con márgenes de 2 cm. Según el tamaño del CCE, es posible que sea difícil evaluar a estos pacientes. La eliminación completa de los tumores del CCE a veces exige una cirugía de control continuo de márgenes (escisión de Mohs) o el uso de márgenes quirúrgicos amplios y es posible que hagan falta múltiples intervenciones quirúrgicas. En ocasiones se necesita reorganizar los tejidos o usar sustitutos dérmicos para lograr el cierre de la herida.[
En las directrices vigentes se recomienda que las personas con EB que tienen CCE irresecables reciban radioterapia, pero es posible que se necesite administrar la dosis en fracciones más pequeñas para disminuir el riesgo de descamación cutánea. También es posible considerar el uso de antagonistas de receptor del factor de crecimiento epidérmico o inhibidores de tirosina–cinasas en personas con CCE avanzado.[
Nivel de evidencia: 5
No hay muchos datos sobre personas con trastornos genéticos distintos al XP, pero las medidas generales de protección solar siguen siendo importantes. La protección cuidadosa de la piel y los ojos es la base de la prevención en todos los pacientes con aumento de la susceptibilidad al cáncer de piel. Los puntos clave son evasión de la exposición al sol en horas pico, la ropa y los lentes de protección, además del uso atento de protector solar. También se ha recomendado que algunos grupos con síndromes de cáncer de piel hereditario, como la epidermodisplasia verruciforme, eviten la radioterapia.[
Nivel de evidencia: 5
Para las personas con DEB, el cuidado de heridas es fundamental. El uso de crema de sulfadiacina de plata, miel de grado médico y apósitos blandos de silicona puede ser útil en estos casos. Otro aspecto fundamental que se debe considerar para la cicatrización de las heridas en estos pacientes es conservar el estado nutricional, que se puede afectar debido a estenosis esofágicas, anemia por deficiencia de hierro, infecciones e inflamación. Es posible que se justifique la administración de multivitaminas, a menudo en dosis más altas que las recomendadas para la población general.[
Nivel de evidencia: 5
El mantenimiento de la integridad de la piel es un factor clave para el tratamiento de los pacientes con JEB. En un pequeño estudio de 5 lactantes con JEB generalizada grave con al menos una variante patogénica de LAMB3 que produce truncamiento prematuro, se evaluaron los efectos clínicos del tratamiento con gentamicina (7,5 mg/kg/día durante 3 semanas) en la fragilidad cutánea y otras características clínicas. El tratamiento no afectó la mortalidad general, pero hubo una disminución de la fragilidad cutánea en 4 de los 5 pacientes; una mejora de la percepción de calidad de vida según lo notificado por los cuidadores, incluso un aumento de la actividad física sin ampollas; y un aumento de la expresión de la laminina 332 en la piel.[
Nivel de evidencia: 3c
Se ha explorado el trasplante de médula ósea para pacientes con DEB; sin embargo, no hay evidencia de que esta intervención disminuya el cáncer de piel.[
Nivel de evidencia (CSM para la prevención de ampollas): 1b
Nivel de evidencia (CSM para el tratamiento de ampollas): 1
Tratamientos futuros para la epidermólisis ampollosa
Los equipos de investigadores están aprovechando los avances recientes en tecnologías para estudiar las estrategias nuevas de tratamiento de la EB dominante y recesiva.[
En un ensayo aleatorizado de 31 pacientes con DEB se comparó el uso tópico de beremagene geperpavec con un placebo. El beremagene geperpavec es una terapia génica tópica a base del virus del herpes simplex de tipo 1 (VSH-1) que transporta el gen COL7A1 a la piel y por lo tanto, restaura la producción de la proteína colágeno VII. Esta terapia mejoró la cicatrización de heridas y redujo la intensidad del dolor durante el cambio de vendaje.[
Nivel de evidencia: 1
Referencias:
- Rogers HW, Weinstock MA, Harris AR, et al.: Incidence estimate of nonmelanoma skin cancer in the United States, 2006. Arch Dermatol 146 (3): 283-7, 2010.
- American Cancer Society: Cancer Facts and Figures 2024. American Cancer Society, 2024.
Available online . Last accessed December 30, 2024. - Rogers HW, Weinstock MA, Feldman SR, et al.: Incidence Estimate of Nonmelanoma Skin Cancer (Keratinocyte Carcinomas) in the U.S. Population, 2012. JAMA Dermatol 151 (10): 1081-6, 2015.
- Flohil SC, van der Leest RJ, Arends LR, et al.: Risk of subsequent cutaneous malignancy in patients with prior keratinocyte carcinoma: a systematic review and meta-analysis. Eur J Cancer 49 (10): 2365-75, 2013.
- Armstrong BK, Kricker A: The epidemiology of UV induced skin cancer. J Photochem Photobiol B 63 (1-3): 8-18, 2001.
- Rosso S, Zanetti R, Martinez C, et al.: The multicentre south European study 'Helios'. II: Different sun exposure patterns in the aetiology of basal cell and squamous cell carcinomas of the skin. Br J Cancer 73 (11): 1447-54, 1996.
- Gallagher RP, Hill GB, Bajdik CD, et al.: Sunlight exposure, pigmentation factors, and risk of nonmelanocytic skin cancer. II. Squamous cell carcinoma. Arch Dermatol 131 (2): 164-9, 1995.
- Lindelöf B, Sigurgeirsson B, Tegner E, et al.: PUVA and cancer risk: the Swedish follow-up study. Br J Dermatol 141 (1): 108-12, 1999.
- Lim JL, Stern RS: High levels of ultraviolet B exposure increase the risk of non-melanoma skin cancer in psoralen and ultraviolet A-treated patients. J Invest Dermatol 124 (3): 505-13, 2005.
- Karagas MR, Stannard VA, Mott LA, et al.: Use of tanning devices and risk of basal cell and squamous cell skin cancers. J Natl Cancer Inst 94 (3): 224-6, 2002.
- Guo X, Fujino Y, Ye X, et al.: Association between multi-level inorganic arsenic exposure from drinking water and skin lesions in China. Int J Environ Res Public Health 3 (3): 262-7, 2006.
- Chen Y, Hall M, Graziano JH, et al.: A prospective study of blood selenium levels and the risk of arsenic-related premalignant skin lesions. Cancer Epidemiol Biomarkers Prev 16 (2): 207-13, 2007.
- Karagas MR, Stukel TA, Morris JS, et al.: Skin cancer risk in relation to toenail arsenic concentrations in a US population-based case-control study. Am J Epidemiol 153 (6): 559-65, 2001.
- Schwartz RA: Arsenic and the skin. Int J Dermatol 36 (4): 241-50, 1997.
- Mehta S, Goyal U, Gupta LK, et al.: Chronic Arsenicosis: Cases from a Nonendemic Area of South Rajasthan. Indian J Dermatol 64 (2): 164, 2019 Mar-Apr.
- Das KK, Chakaraborty A, Rahman A, et al.: Incidences of malignancy in chronic burn scar ulcers: experience from Bangladesh. Burns 41 (6): 1315-21, 2015.
- Koh D, Wang H, Lee J, et al.: Basal cell carcinoma, squamous cell carcinoma and melanoma of the skin: analysis of the Singapore Cancer Registry data 1968-97. Br J Dermatol 148 (6): 1161-6, 2003.
- Asgari MM, Warton EM, Whittemore AS: Family history of skin cancer is associated with increased risk of cutaneous squamous cell carcinoma. Dermatol Surg 41 (4): 481-6, 2015.
- Halder RM, Bang KM: Skin cancer in blacks in the United States. Dermatol Clin 6 (3): 397-405, 1988.
- Asuquo ME, Ebughe G: Major dermatological malignancies encountered in the University of Calabar Teaching Hospital, Calabar, southern Nigeria. Int J Dermatol 51 (Suppl 1): 32-6, 36-40, 2012.
- English DR, Armstrong BK, Kricker A, et al.: Demographic characteristics, pigmentary and cutaneous risk factors for squamous cell carcinoma of the skin: a case-control study. Int J Cancer 76 (5): 628-34, 1998.
- Kricker A, Armstrong BK, English DR, et al.: Pigmentary and cutaneous risk factors for non-melanocytic skin cancer--a case-control study. Int J Cancer 48 (5): 650-62, 1991.
- Akgüner M, Barutçu A, Yilmaz M, et al.: Marjolin's ulcer and chronic burn scarring. J Wound Care 7 (3): 121-2, 1998.
- Friedman R, Hanson S, Goldberg LH: Squamous cell carcinoma arising in a Leishmania scar. Dermatol Surg 29 (11): 1148-9, 2003.
- Jensen P, Hansen S, Møller B, et al.: Skin cancer in kidney and heart transplant recipients and different long-term immunosuppressive therapy regimens. J Am Acad Dermatol 40 (2 Pt 1): 177-86, 1999.
- Hartevelt MM, Bavinck JN, Kootte AM, et al.: Incidence of skin cancer after renal transplantation in The Netherlands. Transplantation 49 (3): 506-9, 1990.
- Lindelöf B, Sigurgeirsson B, Gäbel H, et al.: Incidence of skin cancer in 5356 patients following organ transplantation. Br J Dermatol 143 (3): 513-9, 2000.
- Krynitz B, Edgren G, Lindelöf B, et al.: Risk of skin cancer and other malignancies in kidney, liver, heart and lung transplant recipients 1970 to 2008--a Swedish population-based study. Int J Cancer 132 (6): 1429-38, 2013.
- Glover MT, Niranjan N, Kwan JT, et al.: Non-melanoma skin cancer in renal transplant recipients: the extent of the problem and a strategy for management. Br J Plast Surg 47 (2): 86-9, 1994.
- Kaplan AL, Cook JL: Cutaneous squamous cell carcinoma in patients with chronic lymphocytic leukemia. Skinmed 4 (5): 300-4, 2005 Sep-Oct.
- Euvrard S, Kanitakis J, Decullier E, et al.: Subsequent skin cancers in kidney and heart transplant recipients after the first squamous cell carcinoma. Transplantation 81 (8): 1093-100, 2006.
- Herrero JI, España A, D'Avola D, et al.: Subsequent nonmelanoma skin cancer after liver transplantation. Transplant Proc 44 (6): 1568-70, 2012 Jul-Aug.
- Cantwell MM, Murray LJ, Catney D, et al.: Second primary cancers in patients with skin cancer: a population-based study in Northern Ireland. Br J Cancer 100 (1): 174-7, 2009.
- Epstein E: Value of follow-up after treatment of basal cell carcinoma. Arch Dermatol 108 (6): 798-800, 1973.
- Møller R, Nielsen A, Reymann F: Multiple basal cell carcinoma and internal malignant tumors. Arch Dermatol 111 (5): 584-5, 1975.
- Bergstresser PR, Halprin KM: Multiple sequential skin cancers. The risk of skin cancer in patients with previous skin cancer. Arch Dermatol 111 (8): 995-6, 1975.
- Robinson JK: Risk of developing another basal cell carcinoma. A 5-year prospective study. Cancer 60 (1): 118-20, 1987.
- Greenberg ER, Baron JA, Stukel TA, et al.: A clinical trial of beta carotene to prevent basal-cell and squamous-cell cancers of the skin. The Skin Cancer Prevention Study Group. N Engl J Med 323 (12): 789-95, 1990.
- Karagas MR, Stukel TA, Greenberg ER, et al.: Risk of subsequent basal cell carcinoma and squamous cell carcinoma of the skin among patients with prior skin cancer. Skin Cancer Prevention Study Group. JAMA 267 (24): 3305-10, 1992.
- Helgadottir H, Höiom V, Tuominen R, et al.: CDKN2a mutation-negative melanoma families have increased risk exclusively for skin cancers but not for other malignancies. Int J Cancer 137 (9): 2220-6, 2015.
- Wei EX, Li X, Nan H: Having a first-degree relative with melanoma increases lifetime risk of melanoma, squamous cell carcinoma, and basal cell carcinoma. J Am Acad Dermatol 81 (2): 489-499, 2019.
- Hussain SK, Sundquist J, Hemminki K: The effect of having an affected parent or sibling on invasive and in situ skin cancer risk in Sweden. J Invest Dermatol 129 (9): 2142-7, 2009.
- Hemminki K, Zhang H, Czene K: Familial invasive and in situ squamous cell carcinoma of the skin. Br J Cancer 88 (9): 1375-80, 2003.
- Lindström LS, Yip B, Lichtenstein P, et al.: Etiology of familial aggregation in melanoma and squamous cell carcinoma of the skin. Cancer Epidemiol Biomarkers Prev 16 (8): 1639-43, 2007.
- Mucci LA, Hjelmborg JB, Harris JR, et al.: Familial Risk and Heritability of Cancer Among Twins in Nordic Countries. JAMA 315 (1): 68-76, 2016.
- Loh AYT, Špoljar S, Neo GYW, et al.: Huriez syndrome: Additional pathogenic variants supporting allelism to SMARCAD syndrome. Am J Med Genet A 188 (6): 1752-1760, 2022.
- DiGiovanna JJ, Kraemer KH: Shining a light on xeroderma pigmentosum. J Invest Dermatol 132 (3 Pt 2): 785-96, 2012.
- Kraemer KH, Lee MM, Andrews AD, et al.: The role of sunlight and DNA repair in melanoma and nonmelanoma skin cancer. The xeroderma pigmentosum paradigm. Arch Dermatol 130 (8): 1018-21, 1994.
- Bradford PT, Goldstein AM, Tamura D, et al.: Cancer and neurologic degeneration in xeroderma pigmentosum: long term follow-up characterises the role of DNA repair. J Med Genet 48 (3): 168-76, 2011.
- Moussaid L, Benchikhi H, Boukind EH, et al.: [Cutaneous tumors during xeroderma pigmentosum in Morocco: study of 120 patients] Ann Dermatol Venereol 131 (1 Pt 1): 29-33, 2004.
- Brooks BP, Thompson AH, Bishop RJ, et al.: Ocular manifestations of xeroderma pigmentosum: long-term follow-up highlights the role of DNA repair in protection from sun damage. Ophthalmology 120 (7): 1324-36, 2013.
- Merideth M, Tamura D, Angra D, et al.: Reproductive Health in Xeroderma Pigmentosum: Features of Premature Aging. Obstet Gynecol 134 (4): 814-819, 2019.
- DiGiovanna JJ, Patronas N, Katz D, et al.: Xeroderma pigmentosum: spinal cord astrocytoma with 9-year survival after radiation and isotretinoin therapy. J Cutan Med Surg 2 (3): 153-8, 1998.
- Nikolaev S, Yurchenko AA, Sarasin A: Increased risk of internal tumors in DNA repair-deficient xeroderma pigmentosum patients: analysis of four international cohorts. Orphanet J Rare Dis 17 (1): 104, 2022.
- Robbins JH: Xeroderma pigmentosum complementation group H is withdrawn and reassigned to group D. Hum Genet 88 (2): 242, 1991.
- Khan SG, Oh KS, Shahlavi T, et al.: Reduced XPC DNA repair gene mRNA levels in clinically normal parents of xeroderma pigmentosum patients. Carcinogenesis 27 (1): 84-94, 2006.
- Hirai Y, Noda A, Kodama Y, et al.: Increased risk of skin cancer in Japanese heterozygotes of xeroderma pigmentosum group A. J Hum Genet 63 (11): 1181-1184, 2018.
- Messaoud O, Ben Rekaya M, Cherif W, et al.: Genetic homogeneity of mutational spectrum of group-A xeroderma pigmentosum in Tunisian patients. Int J Dermatol 49 (5): 544-8, 2010.
- Ben Rekaya M, Messaoud O, Talmoudi F, et al.: High frequency of the V548A fs X572 XPC mutation in Tunisia: implication for molecular diagnosis. J Hum Genet 54 (7): 426-9, 2009.
- Cartault F, Nava C, Malbrunot AC, et al.: A new XPC gene splicing mutation has lead to the highest worldwide prevalence of xeroderma pigmentosum in black Mahori patients. DNA Repair (Amst) 10 (6): 577-85, 2011.
- Doubaj Y, Laarabi FZ, Elalaoui SC, et al.: Carrier frequency of the recurrent mutation c.1643_1644delTG in the XPC gene and birth prevalence of the xeroderma pigmentosum in Morocco. J Dermatol 39 (4): 382-4, 2012.
- Hirai Y, Kodama Y, Moriwaki S, et al.: Heterozygous individuals bearing a founder mutation in the XPA DNA repair gene comprise nearly 1% of the Japanese population. Mutat Res 601 (1-2): 171-8, 2006.
- Vogelstein B, Knizler K: Nucleotide excision repair syndromes: xeroderma pigmentosum, Cockayne syndrome, and trichothiodystrophy. In: Vogelstein B, Kinzler KW, eds.: The Genetic Basis of Human Cancer. 2nd ed. McGraw-Hill, 2002, pp 211-37.
- Kraemer KH, Slor H: Xeroderma pigmentosum. Clin Dermatol 3 (1): 33-69, 1985 Jan-Mar.
- Moriwaki S, Kraemer KH: Xeroderma pigmentosum--bridging a gap between clinic and laboratory. Photodermatol Photoimmunol Photomed 17 (2): 47-54, 2001.
- Ben Rekaya M, Laroussi N, Messaoud O, et al.: A founder large deletion mutation in Xeroderma pigmentosum-Variant form in Tunisia: implication for molecular diagnosis and therapy. Biomed Res Int 2014: 256245, 2014.
- Fassihi H, Sethi M, Fawcett H, et al.: Deep phenotyping of 89 xeroderma pigmentosum patients reveals unexpected heterogeneity dependent on the precise molecular defect. Proc Natl Acad Sci U S A 113 (9): E1236-45, 2016.
- Amr K, Messaoud O, El Darouti M, et al.: Mutational spectrum of Xeroderma pigmentosum group A in Egyptian patients. Gene 533 (1): 52-6, 2014.
- Schriver C, Cleaver J, et al., eds.: Xeroderma pigmentosum and cockayne syndrome. In: Cleaver J, Kraemer K, eds.: The Metabolic and Molecular Bases of Inherited Disease. 7th ed. McGraw-Hill Book Co, 1995, pp 4397.
- Lambert WC, Gagna CE, Lambert MW: Xeroderma pigmentosum: its overlap with trichothiodystrophy, Cockayne syndrome and other progeroid syndromes. Adv Exp Med Biol 637: 128-37, 2008.
- Robbins JH, Kraemer KH, Lutzner MA, et al.: Xeroderma pigmentosum. An inherited diseases with sun sensitivity, multiple cutaneous neoplasms, and abnormal DNA repair. Ann Intern Med 80 (2): 221-48, 1974.
- Weeda G, Eveno E, Donker I, et al.: A mutation in the XPB/ERCC3 DNA repair transcription gene, associated with trichothiodystrophy. Am J Hum Genet 60 (2): 320-9, 1997.
- Lehmann AR: The xeroderma pigmentosum group D (XPD) gene: one gene, two functions, three diseases. Genes Dev 15 (1): 15-23, 2001.
- Broughton BC, Berneburg M, Fawcett H, et al.: Two individuals with features of both xeroderma pigmentosum and trichothiodystrophy highlight the complexity of the clinical outcomes of mutations in the XPD gene. Hum Mol Genet 10 (22): 2539-47, 2001.
- Goudie DR, Yuille MA, Leversha MA, et al.: Multiple self-healing squamous epitheliomata (ESS1) mapped to chromosome 9q22-q31 in families with common ancestry. Nat Genet 3 (2): 165-9, 1993.
- Goudie DR, D'Alessandro M, Merriman B, et al.: Multiple self-healing squamous epithelioma is caused by a disease-specific spectrum of mutations in TGFBR1. Nat Genet 43 (4): 365-9, 2011.
- Bose S, Morgan LJ, Booth DR, et al.: The elusive multiple self-healing squamous epithelioma (MSSE) gene: further mapping, analysis of candidates, and loss of heterozygosity. Oncogene 25 (5): 806-12, 2006.
- Mabula JB, Chalya PL, Mchembe MD, et al.: Skin cancers among Albinos at a University teaching hospital in Northwestern Tanzania: a retrospective review of 64 cases. BMC Dermatol 12: 5, 2012.
- Luande J, Henschke CI, Mohammed N: The Tanzanian human albino skin. Natural history. Cancer 55 (8): 1823-8, 1985.
- Knöpfel N, Martín-Santiago A, Del Pozo LJ, et al.: Amelanotic naevoid melanoma in a 16-month-old albino infant. Clin Exp Dermatol 42 (1): 84-88, 2017.
- Iversen U, Iversen OH: Tumours of the skin. In: Templeton AC, ed.: Tumours in a Tropical Country: A Survey of Uganda, 1964-1968. Springer, 1973, pp 180-99.
- Hutton SM, Spritz RA: A comprehensive genetic study of autosomal recessive ocular albinism in Caucasian patients. Invest Ophthalmol Vis Sci 49 (3): 868-72, 2008.
- Laetitia MM, Veronique K, Mamy NZ, et al.: Molecular genetic characterization of Congolese patients with oculocutaneous albinism. Eur J Med Genet 65 (11): 104611, 2022.
- Brilliant MH: The mouse p (pink-eyed dilution) and human P genes, oculocutaneous albinism type 2 (OCA2), and melanosomal pH. Pigment Cell Res 14 (2): 86-93, 2001.
- Sviderskaya EV, Bennett DC, Ho L, et al.: Complementation of hypopigmentation in p-mutant (pink-eyed dilution) mouse melanocytes by normal human P cDNA, and defective complementation by OCA2 mutant sequences. J Invest Dermatol 108 (1): 30-4, 1997.
- Mauri L, Manfredini E, Del Longo A, et al.: Clinical evaluation and molecular screening of a large consecutive series of albino patients. J Hum Genet 62 (2): 277-290, 2017.
- Inagaki K, Suzuki T, Shimizu H, et al.: Oculocutaneous albinism type 4 is one of the most common types of albinism in Japan. Am J Hum Genet 74 (3): 466-71, 2004.
- Mauri L, Barone L, Al Oum M, et al.: SLC45A2 mutation frequency in Oculocutaneous Albinism Italian patients doesn't differ from other European studies. Gene 533 (1): 398-402, 2014.
- Simeonov DR, Wang X, Wang C, et al.: DNA variations in oculocutaneous albinism: an updated mutation list and current outstanding issues in molecular diagnostics. Hum Mutat 34 (6): 827-35, 2013.
- Moreno-Artero E, Morice-Picard F, Lasseaux E, et al.: Oculo-Cutaneous Albinism Type 4 (OCA4): Phenotype-Genotype Correlation. Genes (Basel) 13 (12): , 2022.
- Ibarrola-Villava M, Hu HH, Guedj M, et al.: MC1R, SLC45A2 and TYR genetic variants involved in melanoma susceptibility in southern European populations: results from a meta-analysis. Eur J Cancer 48 (14): 2183-91, 2012.
- Kausar T, Bhatti MA, Ali M, et al.: OCA5, a novel locus for non-syndromic oculocutaneous albinism, maps to chromosome 4q24. Clin Genet 84 (1): 91-3, 2013.
- Wei AH, Zang DJ, Zhang Z, et al.: Exome sequencing identifies SLC24A5 as a candidate gene for nonsyndromic oculocutaneous albinism. J Invest Dermatol 133 (7): 1834-40, 2013.
- Morice-Picard F, Lasseaux E, François S, et al.: SLC24A5 mutations are associated with non-syndromic oculocutaneous albinism. J Invest Dermatol 134 (2): 568-571, 2014.
- Grønskov K, Dooley CM, Østergaard E, et al.: Mutations in c10orf11, a melanocyte-differentiation gene, cause autosomal-recessive albinism. Am J Hum Genet 92 (3): 415-21, 2013.
- Nathan V, Johansson PA, Palmer JM, et al.: Germline variants in oculocutaneous albinism genes and predisposition to familial cutaneous melanoma. Pigment Cell Melanoma Res 32 (6): 854-863, 2019.
- Tomita Y, Miyamura Y: Oculocutaneous albinism and analysis of tyrosinase gene in Japanese patients. Nagoya J Med Sci 61 (3-4): 97-102, 1998.
- Liu N, Kong XD, Shi HR, et al.: Tyrosinase gene mutations in the Chinese Han population with OCA1. Genet Res (Camb) 96: e14, 2014.
- FROGGATT P: Albinism in Northern Ireland. Ann Hum Genet 24: 213-38, 1960.
- McLeod R, Lowry RB: Incidence of albinism in British Columbia (B.C.). Separation by hairbulb test. Clin Genet 9 (1): 77-80, 1976.
- Martínez-Frías ML, Bermejo E: Prevalence of congenital anomaly syndromes in a Spanish gypsy population. J Med Genet 29 (7): 483-6, 1992.
- Grønskov K, Ek J, Sand A, et al.: Birth prevalence and mutation spectrum in danish patients with autosomal recessive albinism. Invest Ophthalmol Vis Sci 50 (3): 1058-64, 2009.
- Chiang PW, Drautz JM, Tsai AC, et al.: A new hypothesis of OCA1B. Am J Med Genet A 146A (22): 2968-70, 2008.
- Okoro AN: Albinism in Nigeria. A clinical and social study. Br J Dermatol 92 (5): 485-92, 1975.
- Kagore F, Lund PM: Oculocutaneous albinism among schoolchildren in Harare, Zimbabwe. J Med Genet 32 (11): 859-61, 1995.
- Lee ST, Nicholls RD, Bundey S, et al.: Mutations of the P gene in oculocutaneous albinism, ocular albinism, and Prader-Willi syndrome plus albinism. N Engl J Med 330 (8): 529-34, 1994.
- WOOLF CM: ALBINISM AMONG INDIANS IN ARIZONA AND NEW MEXICO. Am J Hum Genet 17: 23-35, 1965.
- Manga P, Kromberg JG, Box NF, et al.: Rufous oculocutaneous albinism in southern African Blacks is caused by mutations in the TYRP1 gene. Am J Hum Genet 61 (5): 1095-101, 1997.
- Rundshagen U, Zühlke C, Opitz S, et al.: Mutations in the MATP gene in five German patients affected by oculocutaneous albinism type 4. Hum Mutat 23 (2): 106-10, 2004.
- Bertolotti A, Lasseaux E, Plaisant C, et al.: Identification of a homozygous mutation of SLC24A5 (OCA6) in two patients with oculocutaneous albinism from French Guiana. Pigment Cell Melanoma Res 29 (1): 104-6, 2016.
- Mondal M, Sengupta M, Samanta S, et al.: Molecular basis of albinism in India: evaluation of seven potential candidate genes and some new findings. Gene 511 (2): 470-4, 2012.
- Perry PK, Silverberg NB: Cutaneous malignancy in albinism. Cutis 67 (5): 427-30, 2001.
- Fukai K, Oh J, Frenk E, et al.: Linkage disequilibrium mapping of the gene for Hermansky-Pudlak syndrome to chromosome 10q23.1-q23.3. Hum Mol Genet 4 (9): 1665-9, 1995.
- Wildenberg SC, Oetting WS, Almodóvar C, et al.: A gene causing Hermansky-Pudlak syndrome in a Puerto Rican population maps to chromosome 10q2. Am J Hum Genet 57 (4): 755-65, 1995.
- Anikster Y, Huizing M, White J, et al.: Mutation of a new gene causes a unique form of Hermansky-Pudlak syndrome in a genetic isolate of central Puerto Rico. Nat Genet 28 (4): 376-80, 2001.
- Suzuki T, Li W, Zhang Q, et al.: Hermansky-Pudlak syndrome is caused by mutations in HPS4, the human homolog of the mouse light-ear gene. Nat Genet 30 (3): 321-4, 2002.
- Zhang Q, Zhao B, Li W, et al.: Ru2 and Ru encode mouse orthologs of the genes mutated in human Hermansky-Pudlak syndrome types 5 and 6. Nat Genet 33 (2): 145-53, 2003.
- Li W, Zhang Q, Oiso N, et al.: Hermansky-Pudlak syndrome type 7 (HPS-7) results from mutant dysbindin, a member of the biogenesis of lysosome-related organelles complex 1 (BLOC-1). Nat Genet 35 (1): 84-9, 2003.
- Morgan NV, Pasha S, Johnson CA, et al.: A germline mutation in BLOC1S3/reduced pigmentation causes a novel variant of Hermansky-Pudlak syndrome (HPS8). Am J Hum Genet 78 (1): 160-6, 2006.
- Cullinane AR, Curry JA, Carmona-Rivera C, et al.: A BLOC-1 mutation screen reveals that PLDN is mutated in Hermansky-Pudlak Syndrome type 9. Am J Hum Genet 88 (6): 778-87, 2011.
- Toro J, Turner M, Gahl WA: Dermatologic manifestations of Hermansky-Pudlak syndrome in patients with and without a 16-base pair duplication in the HPS1 gene. Arch Dermatol 135 (7): 774-80, 1999.
- Dell'Angelica EC, Shotelersuk V, Aguilar RC, et al.: Altered trafficking of lysosomal proteins in Hermansky-Pudlak syndrome due to mutations in the beta 3A subunit of the AP-3 adaptor. Mol Cell 3 (1): 11-21, 1999.
- Nagle DL, Karim MA, Woolf EA, et al.: Identification and mutation analysis of the complete gene for Chediak-Higashi syndrome. Nat Genet 14 (3): 307-11, 1996.
- Perou CM, Moore KJ, Nagle DL, et al.: Identification of the murine beige gene by YAC complementation and positional cloning. Nat Genet 13 (3): 303-8, 1996.
- Barbosa MD, Nguyen QA, Tchernev VT, et al.: Identification of the homologous beige and Chediak-Higashi syndrome genes. Nature 382 (6588): 262-5, 1996.
- Engle LJ, Kennett RH: Cloning, analysis, and chromosomal localization of myoxin (MYH12), the human homologue to the mouse dilute gene. Genomics 19 (3): 407-16, 1994.
- Ménasché G, Pastural E, Feldmann J, et al.: Mutations in RAB27A cause Griscelli syndrome associated with haemophagocytic syndrome. Nat Genet 25 (2): 173-6, 2000.
- Ménasché G, Ho CH, Sanal O, et al.: Griscelli syndrome restricted to hypopigmentation results from a melanophilin defect (GS3) or a MYO5A F-exon deletion (GS1). J Clin Invest 112 (3): 450-6, 2003.
- Baardman R, Yenamandra VK, Duipmans JC, et al.: Novel insights into the epidemiology of epidermolysis bullosa (EB) from the Dutch EB Registry: EB more common than previously assumed? J Eur Acad Dermatol Venereol 35 (4): 995-1006, 2021.
- Has C, Hess M, Anemüller W, et al.: Epidemiology of inherited epidermolysis bullosa in Germany. J Eur Acad Dermatol Venereol 37 (2): 402-410, 2023.
- Petrof G, Papanikolaou M, Martinez AE, et al.: The epidemiology of epidermolysis bullosa in England and Wales: data from the national epidermolysis bullosa database. Br J Dermatol 186 (5): 843-848, 2022.
- Mariath LM, Santin JT, Frantz JA, et al.: Genotype-phenotype correlations on epidermolysis bullosa with congenital absence of skin: A comprehensive review. Clin Genet 99 (1): 29-41, 2021.
- Montaudié H, Chiaverini C, Sbidian E, et al.: Inherited epidermolysis bullosa and squamous cell carcinoma: a systematic review of 117 cases. Orphanet J Rare Dis 11 (1): 117, 2016.
- Phillips GS, Huang A, Augsburger BD, et al.: A retrospective analysis of diagnostic testing in a large North American cohort of patients with epidermolysis bullosa. J Am Acad Dermatol 86 (5): 1063-1071, 2022.
- Rossi S, Castiglia D, Pisaneschi E, et al.: Immunofluorescence mapping, electron microscopy and genetics in the diagnosis and sub-classification of inherited epidermolysis bullosa: a single-centre retrospective comparative study of 87 cases with long-term follow-up. J Eur Acad Dermatol Venereol 35 (4): 1007-1016, 2021.
- Has C, Bauer JW, Bodemer C, et al.: Consensus reclassification of inherited epidermolysis bullosa and other disorders with skin fragility. Br J Dermatol 183 (4): 614-627, 2020.
- Bruckner-Tuderman L: Hereditary skin diseases of anchoring fibrils. J Dermatol Sci 20 (2): 122-33, 1999.
- van den Akker PC, Jonkman MF, Rengaw T, et al.: The international dystrophic epidermolysis bullosa patient registry: an online database of dystrophic epidermolysis bullosa patients and their COL7A1 mutations. Hum Mutat 32 (10): 1100-7, 2011.
- Fine JD, Bruckner-Tuderman L, Eady RA, et al.: Inherited epidermolysis bullosa: updated recommendations on diagnosis and classification. J Am Acad Dermatol 70 (6): 1103-26, 2014.
- Fine JD: Epidemiology of Inherited Epidermolysis Bullosa Based on Incidence and Prevalence Estimates From the National Epidermolysis Bullosa Registry. JAMA Dermatol 152 (11): 1231-1238, 2016.
- Fine J, Johnson L, Suchindran C, et al.: Cancer and inherited epidermolysis bullosa. In: Fine J, Bauer E, McGuire J, et al., eds.: Epidermolysis Bullosa; Clinical, Epidemiologic, and Laboratory Advances and the Findings of the National Epidermolysis Bullosa Registry. The Johns Hopkins University Press, 1999, pp 175-92.
- Fine JD, Johnson LB, Weiner M, et al.: Chemoprevention of squamous cell carcinoma in recessive dystrophic epidermolysis bullosa: results of a phase 1 trial of systemic isotretinoin. J Am Acad Dermatol 50 (4): 563-71, 2004.
- Fine JD, Johnson LB, Weiner M, et al.: Cause-specific risks of childhood death in inherited epidermolysis bullosa. J Pediatr 152 (2): 276-80, 2008.
- van den Akker PC, van Essen AJ, Kraak MM, et al.: Long-term follow-up of patients with recessive dystrophic epidermolysis bullosa in the Netherlands: expansion of the mutation database and unusual phenotype-genotype correlations. J Dermatol Sci 56 (1): 9-18, 2009.
- Feinstein JA, Jambal P, Peoples K, et al.: Assessment of the Timing of Milestone Clinical Events in Patients With Epidermolysis Bullosa From North America. JAMA Dermatol 155 (2): 196-203, 2019.
- Farhi D: Surgical management of epidermolysis bullosa: the importance of a multidisciplinary management. Int J Dermatol 46 (8): 815-6, 2007.
- Wessagowit V, Ashton GH, Mohammedi R, et al.: Three cases of de novo dominant dystrophic epidermolysis bullosa associated with the mutation G2043R in COL7A1. Clin Exp Dermatol 26 (1): 97-9, 2001.
- Cserhalmi-Friedman PB, Garzon MC, Guzman E, et al.: Maternal germline mosaicism in dominant dystrophic epidermolysis bullosa. J Invest Dermatol 117 (5): 1327-8, 2001.
- Cuadrado-Corrales N, Sánchez-Jimeno C, García M, et al.: A prevalent mutation with founder effect in Spanish Recessive Dystrophic Epidermolysis Bullosa families. BMC Med Genet 11: 139, 2010.
- Ben Brick AS, Laroussi N, Mesrati H, et al.: Mutational founder effect in recessive dystrophic epidermolysis bullosa families from Southern Tunisia. Arch Dermatol Res 306 (4): 405-11, 2014.
- Ortiz-Urda S, Garcia J, Green CL, et al.: Type VII collagen is required for Ras-driven human epidermal tumorigenesis. Science 307 (5716): 1773-6, 2005.
- Fine JD: Inherited epidermolysis bullosa. Orphanet J Rare Dis 5: 12, 2010.
- Aumailley M, Bruckner-Tuderman L, Carter WG, et al.: A simplified laminin nomenclature. Matrix Biol 24 (5): 326-32, 2005.
- Nakano A, Chao SC, Pulkkinen L, et al.: Laminin 5 mutations in junctional epidermolysis bullosa: molecular basis of Herlitz vs. non-Herlitz phenotypes. Hum Genet 110 (1): 41-51, 2002.
- Schumann H, Hammami-Hauasli N, Pulkkinen L, et al.: Three novel homozygous point mutations and a new polymorphism in the COL17A1 gene: relation to biological and clinical phenotypes of junctional epidermolysis bullosa. Am J Hum Genet 60 (6): 1344-53, 1997.
- Fine JD, Mellerio JE: Extracutaneous manifestations and complications of inherited epidermolysis bullosa: part I. Epithelial associated tissues. J Am Acad Dermatol 61 (3): 367-84; quiz 385-6, 2009.
- Kiritsi D, Kern JS, Schumann H, et al.: Molecular mechanisms of phenotypic variability in junctional epidermolysis bullosa. J Med Genet 48 (7): 450-7, 2011.
- Majewski S, Jabłońska S: Epidermodysplasia verruciformis as a model of human papillomavirus-induced genetic cancer of the skin. Arch Dermatol 131 (11): 1312-8, 1995.
- Sterling JC: Human papillomaviruses and skin cancer. J Clin Virol 32 (Suppl 1): S67-71, 2005.
- Karagas MR, Nelson HH, Sehr P, et al.: Human papillomavirus infection and incidence of squamous cell and basal cell carcinomas of the skin. J Natl Cancer Inst 98 (6): 389-95, 2006.
- Ramoz N, Rueda LA, Bouadjar B, et al.: Mutations in two adjacent novel genes are associated with epidermodysplasia verruciformis. Nat Genet 32 (4): 579-81, 2002.
- Mulvihill J, Miller R, Fraumeni J, eds.: Nosology among the neoplastic genedermatoses. In: Mulvihill J, Miller R, Fraumeni J, eds.: Genetics of Human Cancer. Raven Press, 1977, pp 145-67.
- Jabłońska S, Orth G, Jarzabek-Chorzelska M, et al.: Twenty-one years of follow-up studies of familial epidermodysplasia verruciformis. Dermatologica 158 (5): 309-27, 1979.
- McDermott DF, Gammon B, Snijders PJ, et al.: Autosomal dominant epidermodysplasia verruciformis lacking a known EVER1 or EVER2 mutation. Pediatr Dermatol 26 (3): 306-10, 2009 May-Jun.
- Lazarczyk M, Pons C, Mendoza JA, et al.: Regulation of cellular zinc balance as a potential mechanism of EVER-mediated protection against pathogenesis by cutaneous oncogenic human papillomaviruses. J Exp Med 205 (1): 35-42, 2008.
- Patel AS, Karagas MR, Pawlita M, et al.: Cutaneous human papillomavirus infection, the EVER2 gene and incidence of squamous cell carcinoma: a case-control study. Int J Cancer 122 (10): 2377-9, 2008.
- Crequer A, Picard C, Patin E, et al.: Inherited MST1 deficiency underlies susceptibility to EV-HPV infections. PLoS One 7 (8): e44010, 2012.
- Ramoz N, Taïeb A, Rueda LA, et al.: Evidence for a nonallelic heterogeneity of epidermodysplasia verruciformis with two susceptibility loci mapped to chromosome regions 2p21-p24 and 17q25. J Invest Dermatol 114 (6): 1148-53, 2000.
- Rosenberg PS, Tamary H, Alter BP: How high are carrier frequencies of rare recessive syndromes? Contemporary estimates for Fanconi Anemia in the United States and Israel. Am J Med Genet A 155A (8): 1877-83, 2011.
- Rosenberg PS, Greene MH, Alter BP: Cancer incidence in persons with Fanconi anemia. Blood 101 (3): 822-6, 2003.
- Alter BP: Cancer in Fanconi anemia, 1927-2001. Cancer 97 (2): 425-40, 2003.
- Puligandla B, Stass SA, Schumacher HR, et al.: Terminal deoxynucleotidyl transferase in Fanconi's anaemia. Lancet 2 (8102): 1263, 1978.
- Alter BP, Frissora CL, Halpérin DS, et al.: Fanconi's anaemia and pregnancy. Br J Haematol 77 (3): 410-8, 1991.
- Berger R, Le Coniat M, Schaison G: Chromosome abnormalities in bone marrow of Fanconi anemia patients. Cancer Genet Cytogenet 65 (1): 47-50, 1993.
- Lebbé C, Pinquier L, Rybojad M, et al.: Fanconi's anaemia associated with multicentric Bowen's disease and decreased NK cytotoxicity. Br J Dermatol 129 (5): 615-8, 1993.
- Bagby GC, Alter BP: Fanconi anemia. Semin Hematol 43 (3): 147-56, 2006.
- Chang L, Yuan W, Zeng H, et al.: Whole exome sequencing reveals concomitant mutations of multiple FA genes in individual Fanconi anemia patients. BMC Med Genomics 7: 24, 2014.
- Wang W: Emergence of a DNA-damage response network consisting of Fanconi anaemia and BRCA proteins. Nat Rev Genet 8 (10): 735-48, 2007.
- Howlett NG, Taniguchi T, Olson S, et al.: Biallelic inactivation of BRCA2 in Fanconi anemia. Science 297 (5581): 606-9, 2002.
- Seal S, Thompson D, Renwick A, et al.: Truncating mutations in the Fanconi anemia J gene BRIP1 are low-penetrance breast cancer susceptibility alleles. Nat Genet 38 (11): 1239-41, 2006.
- Berwick M, Satagopan JM, Ben-Porat L, et al.: Genetic heterogeneity among Fanconi anemia heterozygotes and risk of cancer. Cancer Res 67 (19): 9591-6, 2007.
- Rafnar T, Sigurjonsdottir GR, Stacey SN, et al.: Association of BRCA2 K3326* With Small Cell Lung Cancer and Squamous Cell Cancer of the Skin. J Natl Cancer Inst 110 (9): 967-974, 2018.
- Walne AJ, Vulliamy T, Beswick R, et al.: TINF2 mutations result in very short telomeres: analysis of a large cohort of patients with dyskeratosis congenita and related bone marrow failure syndromes. Blood 112 (9): 3594-600, 2008.
- Alter BP, Giri N, Savage SA, et al.: Cancer in dyskeratosis congenita. Blood 113 (26): 6549-57, 2009.
- Vulliamy T, Dokal I: Dyskeratosis congenita. Semin Hematol 43 (3): 157-66, 2006.
- Knight SW, Heiss NS, Vulliamy TJ, et al.: X-linked dyskeratosis congenita is predominantly caused by missense mutations in the DKC1 gene. Am J Hum Genet 65 (1): 50-8, 1999.
- Vulliamy T, Marrone A, Szydlo R, et al.: Disease anticipation is associated with progressive telomere shortening in families with dyskeratosis congenita due to mutations in TERC. Nat Genet 36 (5): 447-9, 2004.
- Vulliamy TJ, Walne A, Baskaradas A, et al.: Mutations in the reverse transcriptase component of telomerase (TERT) in patients with bone marrow failure. Blood Cells Mol Dis 34 (3): 257-63, 2005 May-Jun.
- Vulliamy T, Beswick R, Kirwan M, et al.: Mutations in the telomerase component NHP2 cause the premature ageing syndrome dyskeratosis congenita. Proc Natl Acad Sci U S A 105 (23): 8073-8, 2008.
- Walne AJ, Vulliamy T, Marrone A, et al.: Genetic heterogeneity in autosomal recessive dyskeratosis congenita with one subtype due to mutations in the telomerase-associated protein NOP10. Hum Mol Genet 16 (13): 1619-29, 2007.
- Savage SA, Giri N, Baerlocher GM, et al.: TINF2, a component of the shelterin telomere protection complex, is mutated in dyskeratosis congenita. Am J Hum Genet 82 (2): 501-9, 2008.
- Marrone A, Walne A, Tamary H, et al.: Telomerase reverse-transcriptase homozygous mutations in autosomal recessive dyskeratosis congenita and Hoyeraal-Hreidarsson syndrome. Blood 110 (13): 4198-205, 2007.
- Ballew BJ, Yeager M, Jacobs K, et al.: Germline mutations of regulator of telomere elongation helicase 1, RTEL1, in Dyskeratosis congenita. Hum Genet 132 (4): 473-80, 2013.
- Walne AJ, Vulliamy T, Kirwan M, et al.: Constitutional mutations in RTEL1 cause severe dyskeratosis congenita. Am J Hum Genet 92 (3): 448-53, 2013.
- Fedick AM, Shi L, Jalas C, et al.: Carrier screening of RTEL1 mutations in the Ashkenazi Jewish population. Clin Genet 88 (2): 177-81, 2015.
- Batista LF, Pech MF, Zhong FL, et al.: Telomere shortening and loss of self-renewal in dyskeratosis congenita induced pluripotent stem cells. Nature 474 (7351): 399-402, 2011.
- Neveling K, Bechtold A, Hoehn H: Genetic instability syndromes with progeroid features. Z Gerontol Geriatr 40 (5): 339-48, 2007.
- Zhong F, Savage SA, Shkreli M, et al.: Disruption of telomerase trafficking by TCAB1 mutation causes dyskeratosis congenita. Genes Dev 25 (1): 11-6, 2011.
- Walne AJ, Vulliamy T, Beswick R, et al.: Mutations in C16orf57 and normal-length telomeres unify a subset of patients with dyskeratosis congenita, poikiloderma with neutropenia and Rothmund-Thomson syndrome. Hum Mol Genet 19 (22): 4453-61, 2010.
- Colombo EA, Bazan JF, Negri G, et al.: Novel C16orf57 mutations in patients with Poikiloderma with Neutropenia: bioinformatic analysis of the protein and predicted effects of all reported mutations. Orphanet J Rare Dis 7: 7, 2012.
- Alter BP, Baerlocher GM, Savage SA, et al.: Very short telomere length by flow fluorescence in situ hybridization identifies patients with dyskeratosis congenita. Blood 110 (5): 1439-47, 2007.
- Vulliamy TJ, Marrone A, Knight SW, et al.: Mutations in dyskeratosis congenita: their impact on telomere length and the diversity of clinical presentation. Blood 107 (7): 2680-5, 2006.
- Vulliamy TJ, Dokal I: Dyskeratosis congenita: the diverse clinical presentation of mutations in the telomerase complex. Biochimie 90 (1): 122-30, 2008.
- Borg MF, Olver IN, Hill MP: Rothmund-Thomson syndrome and tolerance of chemoradiotherapy. Australas Radiol 42 (3): 216-8, 1998.
- Haneke E, Gutschmidt E: Premature multiple Bowen's disease in poikiloderma congenitale with warty hyperkeratoses. Dermatologica 158 (5): 384-8, 1979.
- Wang LL, Levy ML, Lewis RA, et al.: Clinical manifestations in a cohort of 41 Rothmund-Thomson syndrome patients. Am J Med Genet 102 (1): 11-7, 2001.
- Piquero-Casals J, Okubo AY, Nico MM: Rothmund-thomson syndrome in three siblings and development of cutaneous squamous cell carcinoma. Pediatr Dermatol 19 (4): 312-6, 2002 Jul-Aug.
- Petkovic M, Dietschy T, Freire R, et al.: The human Rothmund-Thomson syndrome gene product, RECQL4, localizes to distinct nuclear foci that coincide with proteins involved in the maintenance of genome stability. J Cell Sci 118 (Pt 18): 4261-9, 2005.
- Wang LL, Gannavarapu A, Kozinetz CA, et al.: Association between osteosarcoma and deleterious mutations in the RECQL4 gene in Rothmund-Thomson syndrome. J Natl Cancer Inst 95 (9): 669-74, 2003.
- Kitao S, Lindor NM, Shiratori M, et al.: Rothmund-thomson syndrome responsible gene, RECQL4: genomic structure and products. Genomics 61 (3): 268-76, 1999.
- Werner SR, Prahalad AK, Yang J, et al.: RECQL4-deficient cells are hypersensitive to oxidative stress/damage: Insights for osteosarcoma prevalence and heterogeneity in Rothmund-Thomson syndrome. Biochem Biophys Res Commun 345 (1): 403-9, 2006.
- Nakayama H: RecQ family helicases: roles as tumor suppressor proteins. Oncogene 21 (58): 9008-21, 2002.
- Ajeawung NF, Nguyen TTM, Lu L, et al.: Mutations in ANAPC1, Encoding a Scaffold Subunit of the Anaphase-Promoting Complex, Cause Rothmund-Thomson Syndrome Type 1. Am J Hum Genet 105 (3): 625-630, 2019.
- Sugrañes TA, Flanagan M, Thomas C, et al.: Age of first cancer diagnosis and survival in Bloom syndrome. Genet Med 24 (7): 1476-1484, 2022.
- Cunniff C, Djavid AR, Carrubba S, et al.: Health supervision for people with Bloom syndrome. Am J Med Genet A 176 (9): 1872-1881, 2018.
- Ellis NA, Groden J, Ye TZ, et al.: The Bloom's syndrome gene product is homologous to RecQ helicases. Cell 83 (4): 655-66, 1995.
- Bugreev DV, Yu X, Egelman EH, et al.: Novel pro- and anti-recombination activities of the Bloom's syndrome helicase. Genes Dev 21 (23): 3085-94, 2007.
- German J, Ellis N: Bloom syndrome. In: Vogelstein B, Kinzler KW, eds.: The Genetic Basis of Human Cancer. 2nd ed. McGraw-Hill, 2002, pp 267-88.
- German J, Sanz MM, Ciocci S, et al.: Syndrome-causing mutations of the BLM gene in persons in the Bloom's Syndrome Registry. Hum Mutat 28 (8): 743-53, 2007.
- Ellis NA, Ciocci S, Proytcheva M, et al.: The Ashkenazic Jewish Bloom syndrome mutation blmAsh is present in non-Jewish Americans of Spanish ancestry. Am J Hum Genet 63 (6): 1685-93, 1998.
- Lu X, Lane DP: Differential induction of transcriptionally active p53 following UV or ionizing radiation: defects in chromosome instability syndromes? Cell 75 (4): 765-78, 1993.
- Meetei AR, Sechi S, Wallisch M, et al.: A multiprotein nuclear complex connects Fanconi anemia and Bloom syndrome. Mol Cell Biol 23 (10): 3417-26, 2003.
- Yamamoto K, Imakiire A, Miyagawa N, et al.: A report of two cases of Werner's syndrome and review of the literature. J Orthop Surg (Hong Kong) 11 (2): 224-33, 2003.
- Huang S, Lee L, Hanson NB, et al.: The spectrum of WRN mutations in Werner syndrome patients. Hum Mutat 27 (6): 558-67, 2006.
- Goto M, Miller RW, Ishikawa Y, et al.: Excess of rare cancers in Werner syndrome (adult progeria). Cancer Epidemiol Biomarkers Prev 5 (4): 239-46, 1996.
- Tsuchiya H, Tomita K, Ohno M, et al.: Werner's syndrome combined with quintuplicate malignant tumors: a case report and review of literature data. Jpn J Clin Oncol 21 (2): 135-42, 1991.
- Lauper JM, Krause A, Vaughan TL, et al.: Spectrum and risk of neoplasia in Werner syndrome: a systematic review. PLoS One 8 (4): e59709, 2013.
- Machino H, Miki Y, Teramoto T, et al.: Cytogenetic studies in a patient with porokeratosis of Mibelli, multiple cancers and a forme fruste of Werner's syndrome. Br J Dermatol 111 (5): 579-86, 1984.
- Goto M, Imamura O, Kuromitsu J, et al.: Analysis of helicase gene mutations in Japanese Werner's syndrome patients. Hum Genet 99 (2): 191-3, 1997.
- Oshima J, Yu CE, Piussan C, et al.: Homozygous and compound heterozygous mutations at the Werner syndrome locus. Hum Mol Genet 5 (12): 1909-13, 1996.
- Uhrhammer NA, Lafarge L, Dos Santos L, et al.: Werner syndrome and mutations of the WRN and LMNA genes in France. Hum Mutat 27 (7): 718-9, 2006.
- Yu CE, Oshima J, Wijsman EM, et al.: Mutations in the consensus helicase domains of the Werner syndrome gene. Werner's Syndrome Collaborative Group. Am J Hum Genet 60 (2): 330-41, 1997.
- Shen JC, Loeb LA: The Werner syndrome gene: the molecular basis of RecQ helicase-deficiency diseases. Trends Genet 16 (5): 213-20, 2000.
- Shen J, Loeb LA: Unwinding the molecular basis of the Werner syndrome. Mech Ageing Dev 122 (9): 921-44, 2001.
- Brosh RM, Bohr VA: Roles of the Werner syndrome protein in pathways required for maintenance of genome stability. Exp Gerontol 37 (4): 491-506, 2002.
- Furuichi Y: Premature aging and predisposition to cancers caused by mutations in RecQ family helicases. Ann N Y Acad Sci 928: 121-31, 2001.
- Lebel M: Werner syndrome: genetic and molecular basis of a premature aging disorder. Cell Mol Life Sci 58 (7): 857-67, 2001.
- Bohr VA, Brosh RM, von Kobbe C, et al.: Pathways defective in the human premature aging disease Werner syndrome. Biogerontology 3 (1-2): 89-94, 2002.
- Chen L, Oshima J: Werner Syndrome. J Biomed Biotechnol 2 (2): 46-54, 2002.
- Opresko PL, Cheng WH, von Kobbe C, et al.: Werner syndrome and the function of the Werner protein; what they can teach us about the molecular aging process. Carcinogenesis 24 (5): 791-802, 2003.
- Pirzio LM, Pichierri P, Bignami M, et al.: Werner syndrome helicase activity is essential in maintaining fragile site stability. J Cell Biol 180 (2): 305-14, 2008.
- Crabbe L, Jauch A, Naeger CM, et al.: Telomere dysfunction as a cause of genomic instability in Werner syndrome. Proc Natl Acad Sci U S A 104 (7): 2205-10, 2007.
- Friedrich K, Lee L, Leistritz DF, et al.: WRN mutations in Werner syndrome patients: genomic rearrangements, unusual intronic mutations and ethnic-specific alterations. Hum Genet 128 (1): 103-11, 2010.
- Matsumoto T, Imamura O, Yamabe Y, et al.: Mutation and haplotype analyses of the Werner's syndrome gene based on its genomic structure: genetic epidemiology in the Japanese population. Hum Genet 100 (1): 123-30, 1997.
- Satoh M, Imai M, Sugimoto M, et al.: Prevalence of Werner's syndrome heterozygotes in Japan. Lancet 353 (9166): 1766, 1999.
- Moser MJ, Oshima J, Monnat RJ: WRN mutations in Werner syndrome. Hum Mutat 13 (4): 271-9, 1999.
- Goto M, Yamabe Y, Shiratori M, et al.: Immunological diagnosis of Werner syndrome by down-regulated and truncated gene products. Hum Genet 105 (4): 301-7, 1999.
- Tagliabue E, Fargnoli MC, Gandini S, et al.: MC1R gene variants and non-melanoma skin cancer: a pooled-analysis from the M-SKIP project. Br J Cancer 113 (2): 354-63, 2015.
- Ferrucci LM, Cartmel B, Molinaro AM, et al.: Host phenotype characteristics and MC1R in relation to early-onset basal cell carcinoma. J Invest Dermatol 132 (4): 1272-9, 2012.
- Chen AC, Martin AJ, Choy B, et al.: A Phase 3 Randomized Trial of Nicotinamide for Skin-Cancer Chemoprevention. N Engl J Med 373 (17): 1618-26, 2015.
- Tamura D, DiGiovanna JJ, Khan SG, et al.: Living with xeroderma pigmentosum: comprehensive photoprotection for highly photosensitive patients. Photodermatol Photoimmunol Photomed 30 (2-3): 146-52, 2014 Apr-Jun.
- Tamura D, DiGiovanna JJ, Kraemer KH: Xeroderma pigmentosum. In: Lebwohl MG, Birth-Jones J, Heymann WR, et al., eds.: Treatment of Skin Disease: Comprehensive Therapeutic Strategies. 3rd ed. Saunders Elsevier, 2010, pp 789-92.
- Kraemer KH, DiGiovanna JJ, Moshell AN, et al.: Prevention of skin cancer in xeroderma pigmentosum with the use of oral isotretinoin. N Engl J Med 318 (25): 1633-7, 1988.
- DiGiovanna JJ: Retinoid chemoprevention in the high-risk patient. J Am Acad Dermatol 39 (2 Pt 3): S82-5, 1998.
- DiGiovanna J: Oral isotretinoin chemoprevention of skin cancer in xeroderma pigmentosum. J Eur Acad Derm Venereol 5 (Suppl 1): 27, 1995.
- Otley CC, Stasko T, Tope WD, et al.: Chemoprevention of nonmelanoma skin cancer with systemic retinoids: practical dosing and management of adverse effects. Dermatol Surg 32 (4): 562-8, 2006.
- Mellerio JE, Robertson SJ, Bernardis C, et al.: Management of cutaneous squamous cell carcinoma in patients with epidermolysis bullosa: best clinical practice guidelines. Br J Dermatol 174 (1): 56-67, 2016.
- Yarosh D, Klein J, O'Connor A, et al.: Effect of topically applied T4 endonuclease V in liposomes on skin cancer in xeroderma pigmentosum: a randomised study. Xeroderma Pigmentosum Study Group. Lancet 357 (9260): 926-9, 2001.
- Boussen H, Zwik J, Mili-Boussen I, et al.: [Therapeutic results of 5-fluorouracil in multiple and unresectable facial carcinoma secondary to xeroderma pigmentosum] Therapie 56 (6): 751-4, 2001 Nov-Dec.
- Sarasin A: Progress and prospects of xeroderma pigmentosum therapy. Adv Exp Med Biol 637: 144-51, 2008.
- Paganelli A, Giordano E, Fiorentini C, et al.: Surgical management and oncological follow-up of cutaneous squamous cell carcinomas arising in epidermolysis bullosa patients. Int J Dermatol 61 (10): 1171-1174, 2022.
- Mellerio JE, Weiner M, Denyer JE, et al.: Medical management of epidermolysis bullosa: Proceedings of the IInd International Symposium on Epidermolysis Bullosa, Santiago, Chile, 2005. Int J Dermatol 46 (8): 795-800, 2007.
- Hammersen J, Neuner A, Wild F, et al.: Attenuation of Severe Generalized Junctional Epidermolysis Bullosa by Systemic Treatment with Gentamicin. Dermatology 235 (4): 315-322, 2019.
- Wagner JE, Ishida-Yamamoto A, McGrath JA, et al.: Bone marrow transplantation for recessive dystrophic epidermolysis bullosa. N Engl J Med 363 (7): 629-39, 2010.
- El-Darouti M, Fawzy M, Amin I, et al.: Treatment of dystrophic epidermolysis bullosa with bone marrow non-hematopoeitic stem cells: a randomized controlled trial. Dermatol Ther 29 (2): 96-100, 2016 Mar-Apr.
- Hainzl S, Peking P, Kocher T, et al.: COL7A1 Editing via CRISPR/Cas9 in Recessive Dystrophic Epidermolysis Bullosa. Mol Ther 25 (11): 2573-2584, 2017.
- Shinkuma S, Guo Z, Christiano AM: Site-specific genome editing for correction of induced pluripotent stem cells derived from dominant dystrophic epidermolysis bullosa. Proc Natl Acad Sci U S A 113 (20): 5676-81, 2016.
- Siprashvili Z, Nguyen NT, Gorell ES, et al.: Safety and Wound Outcomes Following Genetically Corrected Autologous Epidermal Grafts in Patients With Recessive Dystrophic Epidermolysis Bullosa. JAMA 316 (17): 1808-1817, 2016.
- Webber BR, Osborn MJ, McElroy AN, et al.: CRISPR/Cas9-based genetic correction for recessive dystrophic epidermolysis bullosa. NPJ Regen Med 1: , 2016.
- Mosallaei D, Hao M, Antaya RJ, et al.: Molecular and Clinical Outcomes After Intravenous Gentamicin Treatment for Patients With Junctional Epidermolysis Bullosa Caused by Nonsense Variants. JAMA Dermatol 158 (4): 366-374, 2022.
- Guide SV, Gonzalez ME, Bağcı IS, et al.: Trial of Beremagene Geperpavec (B-VEC) for Dystrophic Epidermolysis Bullosa. N Engl J Med 387 (24): 2211-2219, 2022.
Melanoma
Introducción
Se han identificado factores genéticos infrecuentes de penetrancia alta y factores genéticos comunes de penetrancia baja para el melanoma; cerca del 5 % al 10 % de todos los melanomas surgen en familias con múltiples casos. Sin embargo, una fracción significativa de estas familias no tiene variantes patogénicas detectables de genes de susceptibilidad específicos. La frecuencia de estudio de las familias con múltiples casos y las variantes genéticas específicas que se identifican difiere bastante entre poblaciones y regiones geográficas. En un estudio poblacional grande se concluyó que CDKN2A, un gen de susceptibilidad de penetrancia alta, no contribuye de manera importante a la incidencia de melanoma.[
El melanoma también se presenta en otras partes del cuerpo, como el ojo y el encéfalo. Para obtener más información sobre el melanoma en el ojo, consultar
Factores de riesgo del melanoma
Esta sección se centra en los factores de riesgo en las personas con un aumento del riesgo hereditario de presentar melanoma. Para obtener más información sobre los factores de riesgo de melanoma en la población general, consultar
Exposición solar
La exposición al sol está bien establecida como un factor etiológico importante en todos los tipos de cáncer de piel, aunque sus efectos difieren según el tipo de cáncer. La relación entre la exposición al sol, el uso de protector solar y el desarrollo de cáncer de piel es compleja. Esta relación se complica por un factor de confusión negativo (es decir, las personas que son muy sensibles al sol suelen evitar de manera deliberada las actividades que los exponen a la luz solar directa, y es más probable que usen protector solar cuando se exponen al sol). Estas personas tienen una susceptibilidad genética al desarrollo de cáncer de piel en virtud de su fenotipo cutáneo y, por lo tanto, pueden presentar cáncer de piel independientemente de la cantidad de exposición a la luz solar o el factor de protección solar del filtro solar.[
Características pigmentarias
Las características pigmentarias son determinantes importantes de la susceptibilidad al melanoma. Hay una correlación inversa entre el riesgo de melanoma y el color de la piel que va de la piel más clara a la piel más oscura. Los grupos étnicos de piel oscura tienen un riesgo muy bajo de melanoma en las superficies pigmentadas de la piel; sin embargo, estas personas pueden presentar melanoma en superficies acrales menos pigmentadas (palmas de las manos, plantas de los pies y lechos ungueales) con la misma frecuencia que quienes tienen piel clara. En las personas de piel relativamente clara, el color de la piel se modifica por la genética y el comportamiento. El gen del receptor de la melanocortina 1 (MC1R) es uno de los principales genes que controlan la pigmentación. Para obtener más información, consultar la sección
Desde el punto de vista clínico, se evalúan varias características pigmentarias para calcular el riesgo de melanoma y otros tipos de cáncer de piel. Entre ellos, se encuentran los siguientes:
- Tipo de piel de Fitzpatrick. Los siguientes 6 fenotipos cutáneos se definieron a partir de la respuesta de la piel a la exposición solar al comienzo del verano.[
10 ]- Tipo I: Piel muy clara que siempre se quema y nunca se broncea.
- Tipo II: Piel clara que siempre se quema y a veces se broncea.
- Tipo III: Piel de pigmentación intermedia que a veces se quema y siempre se broncea.
- Tipo IV: Piel trigueña que casi nunca se quema y siempre se broncea.
- Tipo V: Piel morena moderadamente pigmentada que nunca se quema y siempre se broncea.
- Tipo VI: Piel oscura muy pigmentada que nunca se quema y siempre se broncea.
- Número de nevos o densidad de nevos.
- Nevos atípicos o anormales.
- Pecas.
Nevos o nevoides
Los nevos (lunares) son lesiones pigmentadas benignas y circunscritas en la piel o mucosas que se forman por acumulación de melanocitos. Los pacientes con múltiples nevos exhiben un aumento del riesgo de melanoma. Aunque hay evidencia de que tanto la presencia de múltiples nevos como de múltiples nevos atípicos se asocia con aumento del riesgo de melanoma, en la mayoría de los estudios se observó un riesgo más alto de melanoma en presencia de nevos atípicos.[
El fenotipo de múltiples nevos tiene modificadores familiares y ambientales. El número de nevos aumenta con la exposición solar durante la niñez.[
Historia familiar
Por lo general, la historia familiar de melanoma aumenta el riesgo de melanoma casi al doble. En un estudio de un registro de cáncer familiar se evaluaron cerca de 20 000 personas con melanoma y se encontró una razón de incidencia estandarizada (RIE) de 2,62 para la descendencia de personas con melanoma y de 2,94 para hermanos o hermanas.[
En un estudio sobre la heredabilidad del cáncer en 80 309 gemelos monocigóticos y 123 382 gemelos dicigóticos, se observó que los NMSC tienen una heredabilidad del 58 % (IC 95 %, 43–73%), lo que indica que casi la mitad del riesgo de este cáncer se debe a factores hereditarios.[
Se encontró que el gen de susceptibilidad al melanoma hereditario, CDKN2A, está alterado en cerca del 14 % al 43 % de las familias con 3 o más casos de melanoma. Hasta la fecha, no se han identificado variantes patogénicas en más de la mitad de las familias con múltiples casos de melanoma.[
La definición de un grupo familiar de melanoma varía según la región geográfica en todo el mundo, debido a la función que desempeña la radiación ultravioleta (UV) en la patogénesis del melanoma. En regiones de gran insolación (regiones con exposición solar alta), se necesitan 3 o más miembros de la familia afectados para definir un grupo familiar afectado. En regiones con niveles más bajos de luz solar ambiental, se considera que 2 o más miembros de la familia afectados son suficientes para definir un grupo familiar. Para obtener más información sobre los motivos para considerar una prueba genética de melanoma, consulte la sección
Antecedentes personales de melanoma
Un melanoma anterior acarrea un riesgo alto de presentar otros melanomas primarios, en especial para las personas con los factores de riesgo más comunes de melanoma, como un fenotipo cutáneo o historia familiar compatible, una variante patogénica del gen CDKN2A, una gran cantidad de exposición al sol en la niñez y numerosos nevos atípicos. En el entorno del cáncer esporádico, cerca del 5 % de los pacientes con melanoma presentan más de un cáncer primario, mientras que en el entorno familiar la estimación correspondiente es del 30 %. Esta tasa mayor de la esperada de múltiples cánceres primarios del mismo órgano es una característica común de los síndromes de susceptibilidad hereditaria al cáncer; representa un hallazgo clínico que debería elevar el nivel de sospecha de que el melanoma de determinado paciente se relaciona con una predisposición genética al cáncer de piel subyacente. El riesgo de un melanoma primario secundario después del diagnóstico de un primer melanoma primario es de alrededor del 5 %, y es más alto en hombres y pacientes mayores.[
Antecedentes personales de carcinoma de células basales o de carcinoma de células escamosas
El antecedente de un carcinoma de células basales (CCB) o carcinoma de células escamosas (CCE) también se asocia con aumento del riesgo de un melanoma posterior.[
Principales genes asociados con el melanoma
CDKN2A/p16yp14/ARF
El principal gen relacionado con el melanoma es CDKN2A/p16, el inhibidor de la cinasa 2A dependiente de ciclina, que se encuentra en el cromosoma 9p21. Este gen tiene varios nombres (MTS1, INK4 y MLM) y es frecuente que se conozca por el nombre de la proteína que codifica, p16. Es un regulador ascendente de la vía del gen del retinoblastoma, que actúa a través del complejo formado por la ciclina D1 y la cinasa dependiente de ciclina 4. Este gen supresor de tumores se ha estudiado de manera intensiva en familias con múltiples casos de melanoma y en series poblacionales de este tipo de cáncer. CDKN2A controla el avance de las células por el ciclo celular y proporciona un mecanismo de control para mantener las células dañadas en el punto de control G1/S de manera que se haga la reparación del daño del DNA antes de la replicación celular. La pérdida de la función de los genes supresores de tumores, como el CDKN2A, es un paso crítico en la carcinogénesis de muchos sistemas tumorales.
CDKN2A codifica dos proteínas, p16INK4a y p14ARF, con función inhibitoria de la senescencia celular. La proteína que se produce cuando se transcribe el marco de lectura alternativo (ARF) para el exón 1, en lugar del marco de lectura estándar, ejerce sus efectos biológicos en la vía p53. Su efecto es de interrupción del ciclo celular en los puestos de control G1 y G2/M, complementando el bloqueo de la progresión de G1/S de p16, lo que facilita la reparación celular del daño en el DNA.
Las variantes patogénicas de CDKN2A explican entre el 35 % y el 40 % de los melanomas familiares [
En un estudio de 587 personas con un melanoma primario único o MPM se encontraron variantes patogénicas de CDKN2A en el 19 % de las personas con un familiar con MPM en comparación con el 4,4 % en las personas con un melanoma primario único.[
Según el diseño del estudio y la población de interés, la penetrancia del melanoma en presencia de variantes patogénicas de CDKN2A varía bastante. En un estudio de 80 casos múltiples de melanoma se demostró que la penetrancia varía por país, una observación que se atribuyó a diferencias grandes en la exposición solar.[
En un estudio se notificó una tasa de incidencia de melanoma de 9,9 por 1000 años-persona en 354 FPG y 2,1 por 1000 años-persona en 391 FSG de probandos con una variante patogénica Leiden p16 (c.225-243del19) de CDKN2A (IC de 95 % 7,4–13,3 y 1,2–3,8, respectivamente). Estos datos indican una tasa de melanoma mucho más alta que la de la población general (aumento de 12,9 veces en la incidencia) para los FSG que no se han hecho pruebas y que tienen un familiar portador de una variante patogénica del gen CDKN2A.[
En un estudio se compararon las características clínicas de 7695 personas con melanoma (182 pacientes con una variante patogénica del gen CDKN2A y 7513 personas sin una variante patogénica del gen CDKN2A). En los resultados se encontró que las personas con una variante patogénica del gen CDKN2A fueron significativamente más jóvenes en el momento del diagnóstico de melanoma (media de edad en el momento del diagnóstico para las personas con una variante patogénica del gen CDKN2A vs personas sin una variante patogénica del gen CDKN2A, 39,0 vs. 54,3 años; P < 0,001). Las personas con una variante patogénica del gen CDKN2A también exhibieron un aumento de la probabilidad de presentar un segundo melanoma después de 5 años en comparación con el grupo de control (tasa de incidencia acumulada a 5 años para los portadores de variantes del gen CDKN2A de un 23 %; tasa de incidencia acumulada a 5 años para las personas del grupo de control de un 2,3 %).[
Los portadores de variantes patogénicas de CDKN2A tienen melanomas parecidos a los melanomas esporádicos. En un estudio grande se compararon las características patológicas entre los portadores de CDKN2A y las personas con melanoma esporádico y se encontraron algunas diferencias significativas, con una tendencia baja de aumento de la pigmentación entre los portadores de variantes patogénicas.[
Se han encontrado variantes patogénicas en el exón 1ß de CDKN2A (p14ARF) en una proporción pequeña de familias negativas para variantes patogénicas p16INK4a. En un estudio de 94 familias italianas con 2 o más casos de melanoma, el 3,2 % de las familias tenían variantes de p14ARF.[
Existen modelos para predecir si una persona tiene una variante patogénica de CDKN2A.[
CDKN2A, fenotipos cutáneos y otros cánceres diferentes al melanoma
En un estudio del Melanoma Genetics Consortium (GenoMEL) con 1641 familiares de probandos con melanoma, se encontró que quienes exhibían una variante patogénica del gen CDKN2A tenían más probabilidad de tener nevos atípicos que los familiares no portadores de la variante de CDKN2A (oportunidad relativa [OR], 1,65; IC 95 %, 1,18–2,28).[
En los resultados del estudio Genes, Environment, and Melanoma (GEM) se observó que los FPG de portadores de variantes patogénicas de CDKN2A con melanoma tienen un aumento del riesgo de cerca del 50 % de presentar otros tipos de cáncer en comparación con los FPG de otros pacientes con melanoma.[
En algunos estudios se ha identificado variantes germinales patogénicas de CDKN2A en personas con sarcoma, pero el número de casos es muy pequeño como para determinar que haya una asociación de este gen con el riesgo de sarcoma.[
Cáncer de páncreas
Un subgrupo de familias portadoras de variantes patogénicas de CDKN2A también exhiben aumento del riesgo de cáncer de páncreas.[
En una revisión de 110 familias con múltiples casos de cáncer de páncreas, se encontraron 18 con asociaciones entre cáncer de páncreas y melanoma.[
Síndrome de melanoma-astrocitoma
El síndrome de melanoma-astrocitoma es otro fenotipo causado por variantes patogénicas de CDKN2A. La sospecha de la existencia de este trastorno se describió por primera vez en 1993.[
CDK4 y CDK6
Las cinasas dependientes de ciclina cumplen funciones importantes en la progresión de las células de la fase G1 a la fase S. CDK4 y CDK6 en combinación con las cinasas asociadas a la ciclina D aceleran el funcionamiento del ciclo celular. La fosforilación de la proteína del retinoblastoma (Rb) en G1 mediada por las cinasas dependientes de ciclina libera factores de transcripción, lo que induce la expresión génica y cambios metabólicos que anteceden a la replicación del DNA; esto permite que la célula avance a través del ciclo celular. Estos genes son de importancia conceptual porque se encuentran en la misma vía de señalización que CDKN2A.
Las variantes germinales patogénicas de CDK4 son muy infrecuentes, solo se han encontrado en unas pocas familias extensas con melanoma.[
A pesar de que las variantes germinales de CDK6 exhiben similitud funcional a CDK4, no se han identificado en ninguna familia extensa con melanoma.[
Genes de mantenimiento de los telómeros
Telomerasa transcriptasa inversa (TERT)
Si bien las variantes somáticas activadoras del gen TERT suelen encontrarse en múltiples tipos de cáncer, incluso en el melanoma esporádico, las variantes patogénicas de la línea germinan del gen TERT pocas veces se identifican en familias con melanoma.[
La frecuencia de las variantes promotoras del gen TERT en familias con melanoma no se ha investigado bien, pero en un estudio de 273 familias con 3 o más casos de melanoma solo se identificó una familia (con 7 casos de melanoma) que portaba una variante promotora c.-57 T>G en TERT.[
La patogenicidad de rs2853669, una variante específica del gen TERT, todavía está por interpretarse debido a la alta prevalencia en la población general. La prevalencia estimada de esta variante en la población general es del 25 % al 29 %. En un estudio de 106 casos familiares de melanoma (definidos como por lo menos 2 casos de melanoma o MPM en el probando) se encontró que el 47 % de los casos de MPM y el 58 % de los casos de melanoma familiar portaban una variante del promotor de TERT.[
POT1
El uso de secuenciación de exoma y genoma en miembros de familias con melanoma hereditario llevó a la identificación de variantes patogénicas de cambio de sentido del gen POT1, que se manifiestan con enfermedad en muchos estudios.[
En un estudio de 290 casos de melanoma familiar (definidos como familias con al menos 2 casos de melanoma) de Estados Unidos, Italia y España, se identificaron 16 portadores de POT1 en 10 familias. Fue más probable que los melanomas en portadores de variantes del gen POT1 exhibieran características morfológicas spitzoides (P < 0,001) que los melanomas de cohortes de portadores de variantes de CDKN2A, variantes de CDK4 o grupos de no portadores. Esto se presentó incluso en los melanomas diagnosticados a edades similares en las cohortes con portadores de variantes del gen CDK4, CDKN2A y POT1. Además, fue más probable que los melanomas en portadores de POT1 presentaran en los tumores linfocitos infiltrantes en cantidad moderada o alta (P < 0,001).[
ACDyTERF2IP
En un estudio, se usó secuenciación de última generación para evaluar a 510 familias con melanoma y determinar si tenían variantes patogénicas de genes del complejo de la shelterina, que protege los extremos de los cromosomas. En 6 familias se encontraron variantes del gen ACD, y en 4 familias se encontraron variantes del gen TERF2IP.[
Genes de reparación del DNA
Los pacientes de xeroderma pigmentoso (XP) con reparación defectuosa del DNA presentan un aumento de más de 1000 veces del riesgo de desarrollar melanoma. A estos pacientes se les diagnostica melanoma a una edad significativamente más temprana que a las personas de la población general; en promedio, el melanoma se diagnóstica a los 22 años en pacientes con XP.[
Los polimorfismos genéticos asociados a los genes de reparación del DNA se vinculan con un leve aumento en el riesgo de melanoma en la población general.[
Proteína 1 asociada a BRCA1 (BAP1)
De manera reciente, se ha implicado el gen BAP1 en casos de melanoma esporádico y hereditario.[
En otros estudios se reportaron variantes patogénicas de BAP1. En una familia con múltiples casos de melanoma, se describió la presencia de una variante patogénica de cambio de sentido de BAP1 (p.Leu570Val). Esta variante de cambio de sentido afectó el empalme y produjo una proteína truncada. En esta familia también se presentaron casos de melanoma uveal y paraganglioma.[
En un estudio de simulación de Markov se obtuvo una estimación de la supervivencia y repercusiones económicas de los exámenes a portadores de variantes patogénicas de BAP1 para detectar los cuatro tipos de cáncer que se asocian de manera más común con el síndrome de predisposición de BAP1 (cáncer renal, melanoma uveal, melanoma cutáneo y mesotelioma). Los investigadores encontraron que la vigilancia resultaba rentable con un costo cercano a $1265 por año de vida ganado. La supervivencia también mejoró con la vigilancia asociada a BAP1 (50,2 % de las muertes vinculadas con BAP1 se presentaron en el grupo que no se sometió a vigilancia, mientras que solo el 35,4 % de las muertes relacionadas con BAP1 se presentaron en el grupo sometido a vigilancia). La estimación del estudio fue que solo 171 muertes entre 10 000 personas del grupo de vigilancia fueron a causa de melanoma cutáneo, mientras que 768 de las muertes entre 10 000 personas del grupo de control no sometido a vigilancia se debieron a melanoma cutáneo.[
Para obtener información sobre la detección de las variantes patogénicas de BAP1 y la vigilancia correspondiente, consultar la sección
Posibles regiones de susceptibilidad al melanoma familiar
En los estudios de genoma completo se han identificado varios locus adicionales de melanoma familiar. Se identificó un locus de susceptibilidad al melanoma en 1p22, mediante un análisis de ligamiento en 49 familias australianas que tenían al menos 3 casos de melanoma que eran negativos para variantes patogénicas de CDKN2A o CDK4.[
Varios GWAS indicaron que es posible que exista un locus de riesgo de melanoma en el cromosoma 20q11 (OR, 1,27).[
Se han encontrado otros locus de riesgo en los cromosomas 2, 5, 6, 7, 9, 10, 11, 15, 16 y 22.[
Una base de datos pública, MelGene, mantiene listas de variantes identificadas mediante GWAS, que se han relacionado con riesgo de melanoma. MelGene también incluye una red y las potenciales relaciones funcionales entre estos genes y sus variantes.[
9q21 yGOLM1
Cuando se obtuvieron los primeros datos de asociación entre las variantes patogénicas de CDKN2A y el riesgo de melanoma, quedó claro que estas variantes no explicaban todos los tumores de melanoma en los que se pudo demostrar la pérdida de heterocigosidad de 9p21. De hecho, el 51 % de los casos informativos tenía deleciones que no abarcaban variantes somáticas de CDKN2A.[
Genes secundarios (modificadores genéticos) en el melanoma
MC1R
El gen MC1R, también conocido como el receptor hormonal estimulante de melanocitos alfa, se encuentra en el cromosoma 8. Las variantes patogénicas de pérdida de función, de las que hay al menos 10, se asocian no solo con el pelo rojo, la piel clara y la pobre capacidad de bronceado, sino también con aumento del riesgo de cáncer de manera independiente del efecto sobre la pigmentación cutánea.[
Se ha propuesto un sistema de puntuación para los polimorfismos de MC1R con el fin de identificar las asociaciones entre el grado de deterioro funcional en la vía de la melanogénesis, las características clínicas de los pacientes y la presentación clínica del melanoma. El sistema de clasificación inicial designó las variantes del gen MC1R con asociación fuerte con el pelo rojo y la piel clara como variantes fuertes (R) (OR, 63,3 IC 95 %, 31,9–139,6) y las variantes del gen MC1R que presentaron una asociación débil con pelo rojo y piel clara como variantes débiles (r) (OR, 5,1; IC 95 %, 2,5–11,3).[
Las variantes del gen MC1R se asocian con aumento del riesgo de los 3 tipos de cáncer de piel. Sin embargo, cuando se añade la información del genotipo de MC1R a la información de las predicciones del riesgo de cáncer de piel (que se basan en edad, sexo y densidad de melanina cutánea) solo mejora un poco la predicción del riesgo.[
En varios estudios se trató de cuantificar el incremento de la incidencia de melanoma en personas con variantes del gen MC1R. En un estudio de Australia con 1267 personas, se encontró que quienes presentaban un fenotipo R/R y más de 20 nevos presentaban un aumento del riesgo de melanoma de 25 veces en comparación con las personas que tenían una variante natural de MC1R y entre 0 y 4 nevos. El riesgo absoluto de melanoma (a los 75 años) fue del 23,3 % en los hombres con genotipos R/R de MC1R y más de 20 nevos. De manera similar, el riesgo absoluto de melanoma (a los 75 años) fue del 19,3% en mujeres con genotipos R/R MC1R y más de 20 nevos.[
En un estudio de 1791 personas se evaluó si las variantes del gen MC1R afectan el riesgo de melanoma de manera diferente en hombres y mujeres. Ser portador de 2 o más variantes del gen MC1R se asoció con aumento del riesgo tanto en mujeres (OR, 2,65; IC 95 %, 1,86–3,79; P = 0,001) como en hombres (OR, 1,65; IC 95 %, 1,14–2,38; P = 0,007). En un análisis multivariante (que incluyó otros factores de riesgo como pecas, arrugas, quemaduras solares y lentigos solares), la asociación entre el riesgo de melanoma y las variantes del gen MC1R fue significativa en las mujeres, pero no en los hombres.[
Las variantes del gen MC1R también modifican el riesgo de melanoma en personas con variantes patogénicas de CDKN2A. En un estudio de 815 portadores de variantes patogénicas de CDKN2A se buscaron 4 variantes frecuentes de MC1R no sinónimas y se encontró que tener una variante duplica el riesgo de melanoma, mientras que portar 2 o más variantes aumenta el riesgo casi 6 veces.[
Además de los estudios en los que se evalúa la relación entre las variantes germinales y las variantes del gen MC1R, varios grupos han evaluado si las variantes del gen MC1R se asocian con variantes somáticas de BRAF. En los estudios se indica que tal vez hay una asociación entre las variantes del gen MC1R y las mutaciones somáticas BRAF V600E.[
Otros genes de la pigmentación
Las variantes patogénicas de los genes del albinismo también explican una pequeña proporción de los casos de melanoma familiar. Por ejemplo, se observaron variantes del gen TYRP1, TYR y OCA2 con mayor frecuencia en un estudio de personas con melanoma cutáneo familiar en comparación con los controles poblacionales.[
MITF
Con la secuenciación del genoma completo se identificó la variante E318K del gen del factor de transcripción asociado a microftalmia (MITF) en una familia con 7 casos de melanoma.[
Otros genes de susceptibilidad al cáncer
BRCA1yBRCA2
El Breast Cancer Linkage Consortium encontró que las variantes patogénicas de BRCA2 se asociaban con aumento del riesgo de melanoma (RR, 2,58; IC 95 %, 1,3–5,2).[
CHEK2
Algunos estudios han evaluado otros genes de susceptibilidad al cáncer que aumentan el riesgo de melanoma. En una revisión de 6 estudios, en su mayoría, retrospectivos pequeños, sobre CHEK2, un gen que aumenta moderadamente el riesgo de cáncer de mama y otros cánceres, no se observó relación firme con el riesgo de melanoma.[
Síndrome de Li-Fraumeni (TP53)
En estudios longitudinales y retrospectivos de personas con cáncer de piel y síndrome de Li-Fraumeni (SLF) se encontró un riesgo acumulado del 36,3 % al 44,6 % para cualquier tipo de cáncer de piel a la edad de 70 años.[
ATM
La ataxia telangiectasia (AT) es una afección genética autosómica recesiva causada por variantes patogénicas en el gen de la ataxia mutado (ATM). La proteína ATM es una cinasa parecida a fosfoinosítidos 3-cinasas que es responsable de la regulación de la proliferación de células nuevas.[
En un estudio de cohorte grande se investigó el riesgo de cáncer en portadores de variantes del gen ATM (personas con una variante patogénica de ATM). Estas personas presentaron un riesgo bajo a moderado de melanoma (OR, 1,46; IC 95 %, 1,18–1,81).[
Alrededor del 0,5 % de la población general es portadora de variantes patogénicas del gen ATM.[
Síndrome de hamartoma tumoralPTEN(incluso el síndrome de Cowden)
El síndrome de Cowden y el síndrome de Bannayan-Riley-Ruvalcaba (BRRS) forman parte de un grupo de afecciones conocidas en conjunto como síndromes de hamartoma tumoral PTEN (PHTS). El término PHTS se refiere a cualquier paciente con una variante patogénica del gen PTEN, sin importar el cuadro clínico inicial.[
El riesgo de melanoma en los portadores de PTEN es controversial. En un estudio del International Cowden Consortium (ICC) con 100 pacientes, se diagnosticó melanoma a 4 mujeres y 4 hombres, cuando solo se anticipaba menos de 1 caso de melanoma; en los resultados se observó una RIE de 28,3 para las mujeres (IC 95 %, 7,6–35,4) y de 39,4 para los hombres (IC 95 %, 10,6–100,9) (P < 0,001).[
Evaluación del riesgo de melanoma
A los pacientes que tienen antecedentes personales de melanoma o nevos displásicos se les debe pedir que proporcionen información sobre la historia familiar de melanoma y otros tipos de cáncer para detectar el melanoma familiar. Es importante registrar la edad de los familiares en el momento del diagnóstico y la confirmación patológica, si se dispone de ella. La presencia de MPM en la misma persona también brinda un indicio sobre una susceptibilidad genética subyacente. Cerca del 30 % de las personas afectadas en familias extensas con melanoma hereditario tienen más de un melanoma primario, en comparación con un 4 % de los pacientes con melanoma esporádico.[
Hay varios modelos de predicción del riesgo de melanoma que se pueden usar en personas sin antecedentes personales de melanoma.[
Pruebas genéticas
Se dispone de pruebas clínicas para identificar variantes germinales patogénicas de genes asociados con el melanoma hereditario MC1R, BAP1, BRCA2, CDK4, CDKN2A, MITF, TERT y POT1. Varios laboratorios en los Estados Unidos y en el extranjero ofrecen análisis de secuenciación del DNA de todas las regiones codificadoras de estos genes, así como análisis de deleción y duplicación. A menos que exista una variante patogénica conocida en una familia, a menudo se realizan pruebas en un panel de múltiples genes, en lugar de una secuenciación de gen único. El NCCN recomienda que se considere el asesoramiento genético y las pruebas de CDKN2A si los antecedentes personales o familiares de una persona se corresponden con una de dos opciones: 1) 3 o más melanomas cutáneos invasivos, o 2) una combinación de melanoma invasivo, cáncer de páncreas y astrocitomas. A veces también se necesitan pruebas multigénicas cuando una persona tiene antecedentes familiares de melanoma y otros cánceres, como melanoma uveal, astrocitoma, mesotelioma, cáncer de mama, cáncer de páncreas y cáncer de riñón.[
Intervenciones
Población de alto riesgo
Atención médica a miembros de familias con predisposición al melanoma
Las personas con riesgo alto, como los familiares de primer y segundo grado en familias con predisposición al melanoma, deben recibir educación sobre la protección solar y los signos de alarma de melanoma.[
Las biopsias de las lesiones cutáneas en la población de alto riesgo se deben obtener con los mismos criterios que los utilizados para las lesiones en la población general. No se recomienda la extirpación preventiva de nevos sin características clínicas preocupantes. Las razones de esto son prácticas: muchas personas en estas familias tienen un gran número de nevos, y la eliminación completa de todos los nevos atípicos no es posible porque continúan apareciendo nuevos nevos. Además, puede pasar que las personas con mayor susceptibilidad al melanoma presenten un cáncer de novo, sin una lesión precursora como un nevo.[
Nivel de evidencia: 5
En la actualidad, la quimioprevención del melanoma en personas de alto riesgo sigue siendo un área de investigación activa; sin embargo, no se recomiendan medicamentos para la reducción del riesgo de melanoma en este momento.
Nivel de evidencia: 5
Detección sistemática y vigilancia en portadores de variantes patogénicas deBAP1
En la actualidad no hay recomendaciones estándar para la detección sistemática y el abordaje de los pacientes con variantes germinales patogénicas de BAP1. Dos grupos de expertos han emitido orientaciones sobre los protocolos para la detección sistemática del cáncer en portadores de variantes de BAP1, ambos grupos están de acuerdo en que los pacientes deben vigilarse de manera regular para detectar melanoma uveal, melanoma cutáneo y cáncer renal.[
Nivel de evidencia: 5
Detección sistemática del cáncer de páncreas en portadores de variantes patogénicas endeCDKN2A
La detección sistemática del cáncer de páncreas en portadores de variantes patogénicas del gen CDKN2A sigue siendo un área de investigación y controversia. Actualmente, no hay métodos con eficacia comprobada para la detección sistemática del cáncer de páncreas en la población general. Sin embargo, los grupos de expertos recomiendan el uso de métodos de detección radiográfica en poblaciones específicas de riesgo alto. La NCCN recomienda que todos los pacientes con variantes patogénicas de CDKN2A se sometan a vigilancia de cáncer de páncreas con ecografía endoscópica e imágenes por resonancia magnética con colangiopancreatografía por resonancia magnética (IRM/CPRM) del abdomen, sin importar si cuentan con una historia familiar de cáncer de páncreas.[
Las personas con variantes patogénicas de CDKN2A son más propensas a obtener beneficio de la vigilancia del cáncer de páncreas. En un estudio se demostró que los portadores de variantes de CDKN2A con adenocarcinoma pancreático detectado por vigilancia tienen una tasa de supervivencia a 5 años del 24 % en comparación con tasas del 4 % al 7 % en las personas con adenocarcinomas pancreáticos esporádicos.[
Los biomarcadores séricos del cáncer de páncreas también son un área de investigación activa en esta población de riesgo alto. Sin embargo, los grupos que formulan las directrices no han aprobado el uso de biomarcadores séricos para identificar el cáncer de páncreas.
En estudios en curso se continúa investigando lo que implica una detección sistemática del cáncer de páncreas óptima para las personas con variantes patogénicas de CDKN2A y en otras personas con riesgo genético o familiar de cáncer de páncreas.
Nivel de evidencia: 3
Población general
En los siguientes resúmenes del PDQ se abordan las intervenciones de prevención, examen de detección y tratamiento para el melanoma en la población general (es decir, los pacientes que no tienen una predisposición genética al melanoma):
-
Prevención del cáncer de piel -
Exámenes de detección del cáncer de piel -
Tratamiento del melanoma
Referencias:
- Berwick M, Orlow I, Hummer AJ, et al.: The prevalence of CDKN2A germ-line mutations and relative risk for cutaneous malignant melanoma: an international population-based study. Cancer Epidemiol Biomarkers Prev 15 (8): 1520-5, 2006.
- Rosso S, Zanetti R, Martinez C, et al.: The multicentre south European study 'Helios'. II: Different sun exposure patterns in the aetiology of basal cell and squamous cell carcinomas of the skin. Br J Cancer 73 (11): 1447-54, 1996.
- Berwick M: Counterpoint: sunscreen use is a safe and effective approach to skin cancer prevention. Cancer Epidemiol Biomarkers Prev 16 (10): 1923-4, 2007.
- Scherer D, Kumar R: Genetics of pigmentation in skin cancer--a review. Mutat Res 705 (2): 141-53, 2010.
- Cust AE, Drummond M, Kanetsky PA, et al.: Assessing the Incremental Contribution of Common Genomic Variants to Melanoma Risk Prediction in Two Population-Based Studies. J Invest Dermatol 138 (12): 2617-2624, 2018.
- Miles JA, Orlow I, Kanetsky PA, et al.: Relationship of Chromosome Arm 10q Variants to Occurrence of Multiple Primary Melanoma in the Population-Based Genes, Environment, and Melanoma (GEM) Study. J Invest Dermatol 139 (6): 1410-1412, 2019.
- Gu F, Chen TH, Pfeiffer RM, et al.: Combining common genetic variants and non-genetic risk factors to predict risk of cutaneous melanoma. Hum Mol Genet 27 (23): 4145-4156, 2018.
- Landi MT, Bishop DT, MacGregor S, et al.: Genome-wide association meta-analyses combining multiple risk phenotypes provide insights into the genetic architecture of cutaneous melanoma susceptibility. Nat Genet 52 (5): 494-504, 2020.
- Sordillo JE, Kraft P, Wu AC, et al.: Quantifying the Polygenic Contribution to Cutaneous Squamous Cell Carcinoma Risk. J Invest Dermatol 138 (7): 1507-1510, 2018.
- Fitzpatrick TB: The validity and practicality of sun-reactive skin types I through VI. Arch Dermatol 124 (6): 869-71, 1988.
- Roush GC, Nordlund JJ, Forget B, et al.: Independence of dysplastic nevi from total nevi in determining risk for nonfamilial melanoma. Prev Med 17 (3): 273-9, 1988.
- Halpern AC, Guerry D, Elder DE, et al.: Dysplastic nevi as risk markers of sporadic (nonfamilial) melanoma. A case-control study. Arch Dermatol 127 (7): 995-9, 1991.
- Garbe C, Büttner P, Weiss J, et al.: Risk factors for developing cutaneous melanoma and criteria for identifying persons at risk: multicenter case-control study of the Central Malignant Melanoma Registry of the German Dermatological Society. J Invest Dermatol 102 (5): 695-9, 1994.
- Tucker MA, Halpern A, Holly EA, et al.: Clinically recognized dysplastic nevi. A central risk factor for cutaneous melanoma. JAMA 277 (18): 1439-44, 1997.
- Marghoob AA, Kopf AW, Rigel DS, et al.: Risk of cutaneous malignant melanoma in patients with 'classic' atypical-mole syndrome. A case-control study. Arch Dermatol 130 (8): 993-8, 1994.
- Newton-Bishop JA, Chang YM, Iles MM, et al.: Melanocytic nevi, nevus genes, and melanoma risk in a large case-control study in the United Kingdom. Cancer Epidemiol Biomarkers Prev 19 (8): 2043-54, 2010.
- Azizi E, Iscovich J, Pavlotsky F, et al.: Use of sunscreen is linked with elevated naevi counts in Israeli school children and adolescents. Melanoma Res 10 (5): 491-8, 2000.
- Oliveria SA, Satagopan JM, Geller AC, et al.: Study of Nevi in Children (SONIC): baseline findings and predictors of nevus count. Am J Epidemiol 169 (1): 41-53, 2009.
- Elder DE, Goldman LI, Goldman SC, et al.: Dysplastic nevus syndrome: a phenotypic association of sporadic cutaneous melanoma. Cancer 46 (8): 1787-94, 1980.
- Lynch HT, Frichot BC, Lynch JF: Familial atypical multiple mole-melanoma syndrome. J Med Genet 15 (5): 352-6, 1978.
- Cannon-Albright LA, Meyer LJ, Goldgar DE, et al.: Penetrance and expressivity of the chromosome 9p melanoma susceptibility locus (MLM). Cancer Res 54 (23): 6041-4, 1994.
- Brandt A, Sundquist J, Hemminki K: Risk of incident and fatal melanoma in individuals with a family history of incident or fatal melanoma or any cancer. Br J Dermatol 165 (2): 342-8, 2011.
- Wei EX, Li X, Nan H: Having a first-degree relative with melanoma increases lifetime risk of melanoma, squamous cell carcinoma, and basal cell carcinoma. J Am Acad Dermatol 81 (2): 489-499, 2019.
- Ward SV, Dowty JG, Webster RJ, et al.: The aggregation of early-onset melanoma in young Western Australian families. Cancer Epidemiol 39 (3): 346-52, 2015.
- Chen T, Hemminki K, Kharazmi E, et al.: Multiple primary (even in situ) melanomas in a patient pose significant risk to family members. Eur J Cancer 50 (15): 2659-67, 2014.
- Fallah M, Pukkala E, Sundquist K, et al.: Familial melanoma by histology and age: joint data from five Nordic countries. Eur J Cancer 50 (6): 1176-83, 2014.
- Mucci LA, Hjelmborg JB, Harris JR, et al.: Familial Risk and Heritability of Cancer Among Twins in Nordic Countries. JAMA 315 (1): 68-76, 2016.
- Olsen CM, Carroll HJ, Whiteman DC: Familial melanoma: a meta-analysis and estimates of attributable fraction. Cancer Epidemiol Biomarkers Prev 19 (1): 65-73, 2010.
- Hemminki K, Zhang H, Czene K: Incidence trends and familial risks in invasive and in situ cutaneous melanoma by sun-exposed body sites. Int J Cancer 104 (6): 764-71, 2003.
- Goldstein AM, Chan M, Harland M, et al.: High-risk melanoma susceptibility genes and pancreatic cancer, neural system tumors, and uveal melanoma across GenoMEL. Cancer Res 66 (20): 9818-28, 2006.
- Bishop JN, Harland M, Bishop DT: The genetics of melanoma. Br J Hosp Med (Lond) 67 (6): 299-304, 2006.
- Pissa M, Helkkula T, Appelqvist F, et al.: CDKN2A genetic testing in melanoma-prone families in Sweden in the years 2015-2020: implications for novel national recommendations. Acta Oncol 60 (7): 888-896, 2021.
- Bruno W, Dalmasso B, Barile M, et al.: Predictors of germline status for hereditary melanoma: 5 years of multi-gene panel testing within the Italian Melanoma Intergroup. ESMO Open 7 (4): 100525, 2022.
- Potjer TP, Bollen S, Grimbergen AJEM, et al.: Multigene panel sequencing of established and candidate melanoma susceptibility genes in a large cohort of Dutch non-CDKN2A/CDK4 melanoma families. Int J Cancer 144 (10): 2453-2464, 2019.
- Goggins WB, Tsao H: A population-based analysis of risk factors for a second primary cutaneous melanoma among melanoma survivors. Cancer 97 (3): 639-43, 2003.
- Slingluff CL, Vollmer RT, Seigler HF: Multiple primary melanoma: incidence and risk factors in 283 patients. Surgery 113 (3): 330-9, 1993.
- Giles G, Staples M, McCredie M, et al.: Multiple primary melanomas: an analysis of cancer registry data from Victoria and New South Wales. Melanoma Res 5 (6): 433-8, 1995.
- Begg CB, Orlow I, Hummer AJ, et al.: Lifetime risk of melanoma in CDKN2A mutation carriers in a population-based sample. J Natl Cancer Inst 97 (20): 1507-15, 2005.
- Chen T, Fallah M, Försti A, et al.: Risk of Next Melanoma in Patients With Familial and Sporadic Melanoma by Number of Previous Melanomas. JAMA Dermatol 151 (6): 607-15, 2015.
- Marghoob AA, Slade J, Salopek TG, et al.: Basal cell and squamous cell carcinomas are important risk factors for cutaneous malignant melanoma. Screening implications. Cancer 75 (2 Suppl): 707-14, 1995.
- Nugent Z, Demers AA, Wiseman MC, et al.: Risk of second primary cancer and death following a diagnosis of nonmelanoma skin cancer. Cancer Epidemiol Biomarkers Prev 14 (11 Pt 1): 2584-90, 2005.
- Rosenberg CA, Khandekar J, Greenland P, et al.: Cutaneous melanoma in postmenopausal women after nonmelanoma skin carcinoma: the Women's Health Initiative Observational Study. Cancer 106 (3): 654-63, 2006.
- Karagas MR, Greenberg ER, Mott LA, et al.: Occurrence of other cancers among patients with prior basal cell and squamous cell skin cancer. Cancer Epidemiol Biomarkers Prev 7 (2): 157-61, 1998.
- Chen J, Ruczinski I, Jorgensen TJ, et al.: Nonmelanoma skin cancer and risk for subsequent malignancy. J Natl Cancer Inst 100 (17): 1215-22, 2008.
- Aoude LG, Gartside M, Johansson P, et al.: Prevalence of Germline BAP1, CDKN2A, and CDK4 Mutations in an Australian Population-Based Sample of Cutaneous Melanoma Cases. Twin Res Hum Genet 18 (2): 126-33, 2015.
- Márquez-Rodas I, Martín González M, Nagore E, et al.: Frequency and characteristics of familial melanoma in Spain: the FAM-GEM-1 Study. PLoS One 10 (4): e0124239, 2015.
- Nikolaou V, Kang X, Stratigos A, et al.: Comprehensive mutational analysis of CDKN2A and CDK4 in Greek patients with cutaneous melanoma. Br J Dermatol 165 (6): 1219-22, 2011.
- Borroni RG, Manganoni AM, Grassi S, et al.: Genetic counselling and high-penetrance susceptibility gene analysis reveal the novel CDKN2A p.D84V (c.251A>T) mutation in melanoma-prone families from Italy. Melanoma Res 27 (2): 97-103, 2017.
- Pellegrini C, Maturo MG, Martorelli C, et al.: Characterization of melanoma susceptibility genes in high-risk patients from Central Italy. Melanoma Res 27 (3): 258-267, 2017.
- Maubec E, Chaudru V, Mohamdi H, et al.: Familial melanoma: clinical factors associated with germline CDKN2A mutations according to the number of patients affected by melanoma in a family. J Am Acad Dermatol 67 (6): 1257-64, 2012.
- Borg A, Johannsson U, Johannsson O, et al.: Novel germline p16 mutation in familial malignant melanoma in southern Sweden. Cancer Res 56 (11): 2497-500, 1996.
- Borg A, Sandberg T, Nilsson K, et al.: High frequency of multiple melanomas and breast and pancreas carcinomas in CDKN2A mutation-positive melanoma families. J Natl Cancer Inst 92 (15): 1260-6, 2000.
- Hashemi J, Bendahl PO, Sandberg T, et al.: Haplotype analysis and age estimation of the 113insR CDKN2A founder mutation in Swedish melanoma families. Genes Chromosomes Cancer 31 (2): 107-16, 2001.
- Ciotti P, Struewing JP, Mantelli M, et al.: A single genetic origin for the G101W CDKN2A mutation in 20 melanoma-prone families. Am J Hum Genet 67 (2): 311-9, 2000.
- Liu L, Dilworth D, Gao L, et al.: Mutation of the CDKN2A 5' UTR creates an aberrant initiation codon and predisposes to melanoma. Nat Genet 21 (1): 128-32, 1999.
- Pollock PM, Spurr N, Bishop T, et al.: Haplotype analysis of two recurrent CDKN2A mutations in 10 melanoma families: evidence for common founders and independent mutations. Hum Mutat 11 (6): 424-31, 1998.
- Larre Borges A, Borges AL, Cuéllar F, et al.: CDKN2A mutations in melanoma families from Uruguay. Br J Dermatol 161 (3): 536-41, 2009.
- de Ávila AL, Krepischi AC, Moredo LF, et al.: Germline CDKN2A mutations in Brazilian patients of hereditary cutaneous melanoma. Fam Cancer 13 (4): 645-9, 2014.
- Bruno W, Pastorino L, Ghiorzo P, et al.: Multiple primary melanomas (MPMs) and criteria for genetic assessment: MultiMEL, a multicenter study of the Italian Melanoma Intergroup. J Am Acad Dermatol 74 (2): 325-32, 2016.
- Li C, Liu T, Tavtigian SV, et al.: Targeted germline sequencing of patients with three or more primary melanomas reveals high rate of pathogenic variants. Melanoma Res 30 (3): 247-251, 2020.
- Bishop DT, Demenais F, Goldstein AM, et al.: Geographical variation in the penetrance of CDKN2A mutations for melanoma. J Natl Cancer Inst 94 (12): 894-903, 2002.
- Cust AE, Harland M, Makalic E, et al.: Melanoma risk for CDKN2A mutation carriers who are relatives of population-based case carriers in Australia and the UK. J Med Genet 48 (4): 266-72, 2011.
- Santillan AA, Cherpelis BS, Glass LF, et al.: Management of familial melanoma and nonmelanoma skin cancer syndromes. Surg Oncol Clin N Am 18 (1): 73-98, viii, 2009.
- Yang XR, Pfeiffer RM, Wheeler W, et al.: Identification of modifier genes for cutaneous malignant melanoma in melanoma-prone families with and without CDKN2A mutations. Int J Cancer 125 (12): 2912-7, 2009.
- Chaudru V, Lo MT, Lesueur F, et al.: Protective effect of copy number polymorphism of glutathione S-transferase T1 gene on melanoma risk in presence of CDKN2A mutations, MC1R variants and host-related phenotypes. Fam Cancer 8 (4): 371-7, 2009.
- van der Rhee JI, Boonk SE, Putter H, et al.: Surveillance of second-degree relatives from melanoma families with a CDKN2A germline mutation. Cancer Epidemiol Biomarkers Prev 22 (10): 1771-7, 2013.
- van der Rhee JI, Krijnen P, Gruis NA, et al.: Clinical and histologic characteristics of malignant melanoma in families with a germline mutation in CDKN2A. J Am Acad Dermatol 65 (2): 281-8, 2011.
- Goldstein AM, Stidd KC, Yang XR, et al.: Pediatric melanoma in melanoma-prone families. Cancer 124 (18): 3715-3723, 2018.
- Pedace L, De Simone P, Castori M, et al.: Clinical features predicting identification of CDKN2A mutations in Italian patients with familial cutaneous melanoma. Cancer Epidemiol 35 (6): e116-20, 2011.
- Sargen MR, Kanetsky PA, Newton-Bishop J, et al.: Histologic features of melanoma associated with CDKN2A genotype. J Am Acad Dermatol 72 (3): 496-507.e7, 2015.
- Taylor NJ, Handorf EA, Mitra N, et al.: Phenotypic and Histopathological Tumor Characteristics According to CDKN2A Mutation Status among Affected Members of Melanoma Families. J Invest Dermatol 136 (5): 1066-9, 2016.
- Dalmasso B, Pastorino L, Ciccarese G, et al.: CDKN2A germline mutations are not associated with poor survival in an Italian cohort of melanoma patients. J Am Acad Dermatol 80 (5): 1263-1271, 2019.
- Helgadottir H, Höiom V, Tuominen R, et al.: Germline CDKN2A Mutation Status and Survival in Familial Melanoma Cases. J Natl Cancer Inst 108 (11): , 2016.
- Eskandarpour M, Hashemi J, Kanter L, et al.: Frequency of UV-inducible NRAS mutations in melanomas of patients with germline CDKN2A mutations. J Natl Cancer Inst 95 (11): 790-8, 2003.
- Zebary A, Omholt K, van Doorn R, et al.: Somatic BRAF and NRAS mutations in familial melanomas with known germline CDKN2A status: a GenoMEL study. J Invest Dermatol 134 (1): 287-290, 2014.
- Jovanovic B, Egyhazi S, Eskandarpour M, et al.: Coexisting NRAS and BRAF mutations in primary familial melanomas with specific CDKN2A germline alterations. J Invest Dermatol 130 (2): 618-20, 2010.
- Helgadottir H, Ghiorzo P, van Doorn R, et al.: Efficacy of novel immunotherapy regimens in patients with metastatic melanoma with germline CDKN2A mutations. J Med Genet 57 (5): 316-321, 2020.
- Binni F, Antigoni I, De Simone P, et al.: Novel and recurrent p14 mutations in Italian familial melanoma. Clin Genet 77 (6): 581-6, 2010.
- Tan X, Anzick SL, Khan SG, et al.: Chimeric negative regulation of p14ARF and TBX1 by a t(9;22) translocation associated with melanoma, deafness, and DNA repair deficiency. Hum Mutat 34 (9): 1250-9, 2013.
- Niendorf KB, Goggins W, Yang G, et al.: MELPREDICT: a logistic regression model to estimate CDKN2A carrier probability. J Med Genet 43 (6): 501-6, 2006.
- Wang W, Niendorf KB, Patel D, et al.: Estimating CDKN2A carrier probability and personalizing cancer risk assessments in hereditary melanoma using MelaPRO. Cancer Res 70 (2): 552-9, 2010.
- Taylor NJ, Mitra N, Goldstein AM, et al.: Germline Variation at CDKN2A and Associations with Nevus Phenotypes among Members of Melanoma Families. J Invest Dermatol 137 (12): 2606-2612, 2017.
- Helgadottir H, Tuominen R, Olsson H, et al.: Cancer risks and survival in patients with multiple primary melanomas: Association with family history of melanoma and germline CDKN2A mutation status. J Am Acad Dermatol 77 (5): 893-901, 2017.
- Mukherjee B, Delancey JO, Raskin L, et al.: Risk of non-melanoma cancers in first-degree relatives of CDKN2A mutation carriers. J Natl Cancer Inst 104 (12): 953-6, 2012.
- Potrony M, Puig-Butillé JA, Aguilera P, et al.: Increased prevalence of lung, breast, and pancreatic cancers in addition to melanoma risk in families bearing the cyclin-dependent kinase inhibitor 2A mutation: implications for genetic counseling. J Am Acad Dermatol 71 (5): 888-95, 2014.
- Helgadottir H, Höiom V, Jönsson G, et al.: High risk of tobacco-related cancers in CDKN2A mutation-positive melanoma families. J Med Genet 51 (8): 545-52, 2014.
- Sargen MR, Helgadottir H, Yang XR, et al.: Impact of Transcript (p16/p14ARF) Alteration on Cancer Risk in CDKN2A Germline Pathogenic Variant Carriers. JNCI Cancer Spectr 6 (6): , 2022.
- Jouenne F, Chauvot de Beauchene I, Bollaert E, et al.: Germline CDKN2A/P16INK4A mutations contribute to genetic determinism of sarcoma. J Med Genet 54 (9): 607-612, 2017.
- Chan SH, Lim WK, Michalski ST, et al.: Germline hemizygous deletion of CDKN2A-CDKN2B locus in a patient presenting with Li-Fraumeni syndrome. NPJ Genom Med 1: 16015, 2016.
- Goldstein AM, Fraser MC, Struewing JP, et al.: Increased risk of pancreatic cancer in melanoma-prone kindreds with p16INK4 mutations. N Engl J Med 333 (15): 970-4, 1995.
- Whelan AJ, Bartsch D, Goodfellow PJ: Brief report: a familial syndrome of pancreatic cancer and melanoma with a mutation in the CDKN2 tumor-suppressor gene. N Engl J Med 333 (15): 975-7, 1995.
- Lindor NM, McMaster ML, Lindor CJ, et al.: Concise handbook of familial cancer susceptibility syndromes - second edition. J Natl Cancer Inst Monogr (38): 1-93, 2008.
- de Snoo FA, Bishop DT, Bergman W, et al.: Increased risk of cancer other than melanoma in CDKN2A founder mutation (p16-Leiden)-positive melanoma families. Clin Cancer Res 14 (21): 7151-7, 2008.
- Goldstein AM: Familial melanoma, pancreatic cancer and germline CDKN2A mutations. Hum Mutat 23 (6): 630, 2004.
- Vasen HF, Gruis NA, Frants RR, et al.: Risk of developing pancreatic cancer in families with familial atypical multiple mole melanoma associated with a specific 19 deletion of p16 (p16-Leiden). Int J Cancer 87 (6): 809-11, 2000.
- McWilliams RR, Bamlet WR, Rabe KG, et al.: Association of family history of specific cancers with a younger age of onset of pancreatic adenocarcinoma. Clin Gastroenterol Hepatol 4 (9): 1143-7, 2006.
- Goldstein AM, Chan M, Harland M, et al.: Features associated with germline CDKN2A mutations: a GenoMEL study of melanoma-prone families from three continents. J Med Genet 44 (2): 99-106, 2007.
- Goldstein AM, Struewing JP, Chidambaram A, et al.: Genotype-phenotype relationships in U.S. melanoma-prone families with CDKN2A and CDK4 mutations. J Natl Cancer Inst 92 (12): 1006-10, 2000.
- Bartsch DK, Sina-Frey M, Lang S, et al.: CDKN2A germline mutations in familial pancreatic cancer. Ann Surg 236 (6): 730-7, 2002.
- Harinck F, Kluijt I, van der Stoep N, et al.: Indication for CDKN2A-mutation analysis in familial pancreatic cancer families without melanomas. J Med Genet 49 (6): 362-5, 2012.
- Zhen DB, Rabe KG, Gallinger S, et al.: BRCA1, BRCA2, PALB2, and CDKN2A mutations in familial pancreatic cancer: a PACGENE study. Genet Med 17 (7): 569-77, 2015.
- Bartsch DK, Langer P, Habbe N, et al.: Clinical and genetic analysis of 18 pancreatic carcinoma/melanoma-prone families. Clin Genet 77 (4): 333-41, 2010.
- Kaufman DK, Kimmel DW, Parisi JE, et al.: A familial syndrome with cutaneous malignant melanoma and cerebral astrocytoma. Neurology 43 (9): 1728-31, 1993.
- Azizi E, Friedman J, Pavlotsky F, et al.: Familial cutaneous malignant melanoma and tumors of the nervous system. A hereditary cancer syndrome. Cancer 76 (9): 1571-8, 1995.
- Randerson-Moor JA, Harland M, Williams S, et al.: A germline deletion of p14(ARF) but not CDKN2A in a melanoma-neural system tumour syndrome family. Hum Mol Genet 10 (1): 55-62, 2001.
- Vanneste R, Smith E, Graham G: Multiple neurofibromas as the presenting feature of familial atypical multiple malignant melanoma (FAMMM) syndrome. Am J Med Genet A 161A (6): 1425-31, 2013.
- Petty EM, Bolognia JL, Bale AE, et al.: Cutaneous malignant melanoma and atypical moles associated with a constitutional rearrangement of chromosomes 5 and 9. Am J Med Genet 45 (1): 77-80, 1993.
- Petronzelli F, Sollima D, Coppola G, et al.: CDKN2A germline splicing mutation affecting both p16(ink4) and p14(arf) RNA processing in a melanoma/neurofibroma kindred. Genes Chromosomes Cancer 31 (4): 398-401, 2001.
- Bahuau M, Vidaud D, Jenkins RB, et al.: Germ-line deletion involving the INK4 locus in familial proneness to melanoma and nervous system tumors. Cancer Res 58 (11): 2298-303, 1998.
- Zuo L, Weger J, Yang Q, et al.: Germline mutations in the p16INK4a binding domain of CDK4 in familial melanoma. Nat Genet 12 (1): 97-9, 1996.
- Soufir N, Avril MF, Chompret A, et al.: Prevalence of p16 and CDK4 germline mutations in 48 melanoma-prone families in France. The French Familial Melanoma Study Group. Hum Mol Genet 7 (2): 209-16, 1998.
- Molven A, Grimstvedt MB, Steine SJ, et al.: A large Norwegian family with inherited malignant melanoma, multiple atypical nevi, and CDK4 mutation. Genes Chromosomes Cancer 44 (1): 10-8, 2005.
- Veinalde R, Ozola A, Azarjana K, et al.: Analysis of Latvian familial melanoma patients shows novel variants in the noncoding regions of CDKN2A and that the CDK4 mutation R24H is a founder mutation. Melanoma Res 23 (3): 221-6, 2013.
- Puntervoll HE, Yang XR, Vetti HH, et al.: Melanoma prone families with CDK4 germline mutation: phenotypic profile and associations with MC1R variants. J Med Genet 50 (4): 264-70, 2013.
- Puntervoll HE, Molven A, Akslen LA: Frequency of somatic BRAF mutations in melanocytic lesions from patients in a CDK4 melanoma family. Pigment Cell Melanoma Res 27 (1): 149-51, 2014.
- Sargen MR, Pfeiffer RM, Yang XR, et al.: Variation in Cutaneous Patterns of Melanomagenesis According to Germline CDKN2A/CDK4 Status in Melanoma-Prone Families. J Invest Dermatol 140 (1): 174-181.e3, 2020.
- Shennan MG, Badin AC, Walsh S, et al.: Lack of germline CDK6 mutations in familial melanoma. Oncogene 19 (14): 1849-52, 2000.
- Huang FW, Hodis E, Xu MJ, et al.: Highly recurrent TERT promoter mutations in human melanoma. Science 339 (6122): 957-9, 2013.
- Horn S, Figl A, Rachakonda PS, et al.: TERT promoter mutations in familial and sporadic melanoma. Science 339 (6122): 959-61, 2013.
- Zaremba A, Meier F, Schlein C, et al.: Clinical and pathological characteristics of familial melanoma with germline TERT promoter variants. Pigment Cell Melanoma Res 35 (6): 573-586, 2022.
- Harland M, Petljak M, Robles-Espinoza CD, et al.: Germline TERT promoter mutations are rare in familial melanoma. Fam Cancer 15 (1): 139-44, 2016.
- Potrony M, Puig-Butille JA, Ribera-Sola M, et al.: POT1 germline mutations but not TERT promoter mutations are implicated in melanoma susceptibility in a large cohort of Spanish melanoma families. Br J Dermatol 181 (1): 105-113, 2019.
- Reference SNP (refSNP) Cluster Report: rs2853669. In: Database of Short Genetic Variations (dbSNP) [Database]. Bethesda, MD: National Center for Biotechnology Information, 2018.
Available online. Last accessed April 25, 2024. - Shi J, Yang XR, Ballew B, et al.: Rare missense variants in POT1 predispose to familial cutaneous malignant melanoma. Nat Genet 46 (5): 482-6, 2014.
- Robles-Espinoza CD, Harland M, Ramsay AJ, et al.: POT1 loss-of-function variants predispose to familial melanoma. Nat Genet 46 (5): 478-81, 2014.
- Simonin-Wilmer I, Ossio R, Leddin EM, et al.: Population-based analysis of POT1 variants in a cutaneous melanoma case-control cohort. J Med Genet 60 (7): 692-696, 2023.
- Sargen MR, Calista D, Elder DE, et al.: Histologic features of melanoma associated with germline mutations of CDKN2A, CDK4, and POT1 in melanoma-prone families from the United States, Italy, and Spain. J Am Acad Dermatol 83 (3): 860-869, 2020.
- Aoude LG, Pritchard AL, Robles-Espinoza CD, et al.: Nonsense mutations in the shelterin complex genes ACD and TERF2IP in familial melanoma. J Natl Cancer Inst 107 (2): , 2015.
- Bradford PT, Goldstein AM, Tamura D, et al.: Cancer and neurologic degeneration in xeroderma pigmentosum: long term follow-up characterises the role of DNA repair. J Med Genet 48 (3): 168-76, 2011.
- Kraemer KH, Lee MM, Scotto J: DNA repair protects against cutaneous and internal neoplasia: evidence from xeroderma pigmentosum. Carcinogenesis 5 (4): 511-4, 1984.
- Kraemer KH, Lee MM, Andrews AD, et al.: The role of sunlight and DNA repair in melanoma and nonmelanoma skin cancer. The xeroderma pigmentosum paradigm. Arch Dermatol 130 (8): 1018-21, 1994.
- Blankenburg S, König IR, Moessner R, et al.: Assessment of 3 xeroderma pigmentosum group C gene polymorphisms and risk of cutaneous melanoma: a case-control study. Carcinogenesis 26 (6): 1085-90, 2005.
- Xu Y, Jiao G, Wei L, et al.: Current evidences on the XPG Asp1104His polymorphism and melanoma susceptibility: a meta-analysis based on case-control studies. Mol Genet Genomics 290 (1): 273-9, 2015.
- Walpole S, Pritchard AL, Cebulla CM, et al.: Comprehensive Study of the Clinical Phenotype of Germline BAP1 Variant-Carrying Families Worldwide. J Natl Cancer Inst 110 (12): 1328-1341, 2018.
- Harbour JW, Onken MD, Roberson ED, et al.: Frequent mutation of BAP1 in metastasizing uveal melanomas. Science 330 (6009): 1410-3, 2010.
- Wiesner T, Obenauf AC, Murali R, et al.: Germline mutations in BAP1 predispose to melanocytic tumors. Nat Genet 43 (10): 1018-21, 2011.
- Soura E, Eliades PJ, Shannon K, et al.: Hereditary melanoma: Update on syndromes and management: Emerging melanoma cancer complexes and genetic counseling. J Am Acad Dermatol 74 (3): 411-20; quiz 421-2, 2016.
- Njauw CN, Kim I, Piris A, et al.: Germline BAP1 inactivation is preferentially associated with metastatic ocular melanoma and cutaneous-ocular melanoma families. PLoS One 7 (4): e35295, 2012.
- Abdel-Rahman MH, Pilarski R, Cebulla CM, et al.: Germline BAP1 mutation predisposes to uveal melanoma, lung adenocarcinoma, meningioma, and other cancers. J Med Genet 48 (12): 856-9, 2011.
- Carbone M, Ferris LK, Baumann F, et al.: BAP1 cancer syndrome: malignant mesothelioma, uveal and cutaneous melanoma, and MBAITs. J Transl Med 10: 179, 2012.
- Testa JR, Cheung M, Pei J, et al.: Germline BAP1 mutations predispose to malignant mesothelioma. Nat Genet 43 (10): 1022-5, 2011.
- Popova T, Hebert L, Jacquemin V, et al.: Germline BAP1 mutations predispose to renal cell carcinomas. Am J Hum Genet 92 (6): 974-80, 2013.
- Aoude LG, Wadt K, Bojesen A, et al.: A BAP1 mutation in a Danish family predisposes to uveal melanoma and other cancers. PLoS One 8 (8): e72144, 2013.
- O'Shea SJ, Robles-Espinoza CD, McLellan L, et al.: A population-based analysis of germline BAP1 mutations in melanoma. Hum Mol Genet 26 (4): 717-728, 2017.
- Lalloo F, Kulkarni A, Chau C, et al.: Clinical practice guidelines for the diagnosis and surveillance of BAP1 tumour predisposition syndrome. Eur J Hum Genet 31 (11): 1261-1269, 2023.
- Wadt K, Choi J, Chung JY, et al.: A cryptic BAP1 splice mutation in a family with uveal and cutaneous melanoma, and paraganglioma. Pigment Cell Melanoma Res 25 (6): 815-8, 2012.
- Rai K, Pilarski R, Cebulla CM, et al.: Comprehensive review of BAP1 tumor predisposition syndrome with report of two new cases. Clin Genet 89 (3): 285-94, 2016.
- Cheung M, Kadariya Y, Talarchek J, et al.: Germline BAP1 mutation in a family with high incidence of multiple primary cancers and a potential gene-environment interaction. Cancer Lett 369 (2): 261-5, 2015.
- Walpole S, Hayward NK, Pritchard AL, et al.: Microsimulation Model for Evaluating the Cost-Effectiveness of Surveillance in BAP1 Pathogenic Variant Carriers. JCO Clin Cancer Inform 5: 143-154, 2021.
- Gillanders E, Juo SH, Holland EA, et al.: Localization of a novel melanoma susceptibility locus to 1p22. Am J Hum Genet 73 (2): 301-13, 2003.
- Walker GJ, Indsto JO, Sood R, et al.: Deletion mapping suggests that the 1p22 melanoma susceptibility gene is a tumor suppressor localized to a 9-Mb interval. Genes Chromosomes Cancer 41 (1): 56-64, 2004.
- Teerlink C, Farnham J, Allen-Brady K, et al.: A unique genome-wide association analysis in extended Utah high-risk pedigrees identifies a novel melanoma risk variant on chromosome arm 10q. Hum Genet 131 (1): 77-85, 2012.
- Höiom V, Tuominen R, Hansson J: Genome-wide linkage analysis of Swedish families to identify putative susceptibility loci for cutaneous malignant melanoma. Genes Chromosomes Cancer 50 (12): 1076-84, 2011.
- Tuominen R, Jönsson G, Enerbäck C, et al.: Investigation of a putative melanoma susceptibility locus at chromosome 3q29. Cancer Genet 207 (3): 70-4, 2014.
- Potrony M, Puig-Butille JA, Farnham JM, et al.: Genome-wide linkage analysis in Spanish melanoma-prone families identifies a new familial melanoma susceptibility locus at 11q. Eur J Hum Genet 26 (8): 1188-1193, 2018.
- Gudbjartsson DF, Sulem P, Stacey SN, et al.: ASIP and TYR pigmentation variants associate with cutaneous melanoma and basal cell carcinoma. Nat Genet 40 (7): 886-91, 2008.
- Maccioni L, Rachakonda PS, Scherer D, et al.: Variants at chromosome 20 (ASIP locus) and melanoma risk. Int J Cancer 132 (1): 42-54, 2013.
- Kanetsky PA, Swoyer J, Panossian S, et al.: A polymorphism in the agouti signaling protein gene is associated with human pigmentation. Am J Hum Genet 70 (3): 770-5, 2002.
- Landi MT, Kanetsky PA, Tsang S, et al.: MC1R, ASIP, and DNA repair in sporadic and familial melanoma in a Mediterranean population. J Natl Cancer Inst 97 (13): 998-1007, 2005.
- McMeniman EK, Duffy DL, Jagirdar K, et al.: The interplay of sun damage and genetic risk in Australian multiple and single primary melanoma cases and controls. Br J Dermatol 183 (2): 357-366, 2020.
- Bishop DT, Demenais F, Iles MM, et al.: Genome-wide association study identifies three loci associated with melanoma risk. Nat Genet 41 (8): 920-5, 2009.
- Brown KM, Macgregor S, Montgomery GW, et al.: Common sequence variants on 20q11.22 confer melanoma susceptibility. Nat Genet 40 (7): 838-40, 2008.
- Falchi M, Bataille V, Hayward NK, et al.: Genome-wide association study identifies variants at 9p21 and 22q13 associated with development of cutaneous nevi. Nat Genet 41 (8): 915-9, 2009.
- Fernandez LP, Milne RL, Pita G, et al.: SLC45A2: a novel malignant melanoma-associated gene. Hum Mutat 29 (9): 1161-7, 2008.
- Kocarnik JM, Park SL, Han J, et al.: Replication of associations between GWAS SNPs and melanoma risk in the Population Architecture Using Genomics and Epidemiology (PAGE) Study. J Invest Dermatol 134 (7): 2049-52, 2014.
- Law MH, Bishop DT, Lee JE, et al.: Genome-wide meta-analysis identifies five new susceptibility loci for cutaneous malignant melanoma. Nat Genet 47 (9): 987-95, 2015.
- Gerstenblith MR, Shi J, Landi MT: Genome-wide association studies of pigmentation and skin cancer: a review and meta-analysis. Pigment Cell Melanoma Res 23 (5): 587-606, 2010.
- Athanasiadis EI, Antonopoulou K, Chatzinasiou F, et al.: A Web-based database of genetic association studies in cutaneous melanoma enhanced with network-driven data exploration tools. Database (Oxford) 2014: , 2014.
- Ohta M, Berd D, Shimizu M, et al.: Deletion mapping of chromosome region 9p21-p22 surrounding the CDKN2 locus in melanoma. Int J Cancer 65 (6): 762-7, 1996.
- Teerlink CC, Huff C, Stevens J, et al.: A Nonsynonymous Variant in the GOLM1 Gene in Cutaneous Malignant Melanoma. J Natl Cancer Inst 110 (12): 1380-1385, 2018.
- Box NF, Duffy DL, Chen W, et al.: MC1R genotype modifies risk of melanoma in families segregating CDKN2A mutations. Am J Hum Genet 69 (4): 765-73, 2001.
- Scherer D, Nagore E, Bermejo JL, et al.: Melanocortin receptor 1 variants and melanoma risk: a study of 2 European populations. Int J Cancer 125 (8): 1868-75, 2009.
- Kanetsky PA, Panossian S, Elder DE, et al.: Does MC1R genotype convey information about melanoma risk beyond risk phenotypes? Cancer 116 (10): 2416-28, 2010.
- Tagliabue E, Fargnoli MC, Gandini S, et al.: MC1R gene variants and non-melanoma skin cancer: a pooled-analysis from the M-SKIP project. Br J Cancer 113 (2): 354-63, 2015.
- Williams PF, Olsen CM, Hayward NK, et al.: Melanocortin 1 receptor and risk of cutaneous melanoma: a meta-analysis and estimates of population burden. Int J Cancer 129 (7): 1730-40, 2011.
- Puig-Butillé JA, Carrera C, Kumar R, et al.: Distribution of MC1R variants among melanoma subtypes: p.R163Q is associated with lentigo maligna melanoma in a Mediterranean population. Br J Dermatol 169 (4): 804-11, 2013.
- Pasquali E, García-Borrón JC, Fargnoli MC, et al.: MC1R variants increased the risk of sporadic cutaneous melanoma in darker-pigmented Caucasians: a pooled-analysis from the M-SKIP project. Int J Cancer 136 (3): 618-31, 2015.
- Duffy DL, Box NF, Chen W, et al.: Interactive effects of MC1R and OCA2 on melanoma risk phenotypes. Hum Mol Genet 13 (4): 447-61, 2004.
- Davies JR, Randerson-Moor J, Kukalizch K, et al.: Inherited variants in the MC1R gene and survival from cutaneous melanoma: a BioGenoMEL study. Pigment Cell Melanoma Res 25 (3): 384-94, 2012.
- Peña-Vilabelda MM, García-Casado Z, Requena C, et al.: Clinical characteristics of patients with cutaneous melanoma according to variants in the melanocortin 1 receptor gene. Actas Dermosifiliogr 105 (2): 159-71, 2014.
- Taylor NJ, Reiner AS, Begg CB, et al.: Inherited variation at MC1R and ASIP and association with melanoma-specific survival. Int J Cancer 136 (11): 2659-67, 2015.
- Lira FE, Podlipnik S, Potrony M, et al.: Inherited MC1R variants in patients with melanoma are associated with better survival in women. Br J Dermatol 182 (1): 138-146, 2020.
- Dwyer T, Stankovich JM, Blizzard L, et al.: Does the addition of information on genotype improve prediction of the risk of melanoma and nonmelanoma skin cancer beyond that obtained from skin phenotype? Am J Epidemiol 159 (9): 826-33, 2004.
- Han J, Kraft P, Colditz GA, et al.: Melanocortin 1 receptor variants and skin cancer risk. Int J Cancer 119 (8): 1976-84, 2006.
- Cust AE, Goumas C, Vuong K, et al.: MC1R genotype as a predictor of early-onset melanoma, compared with self-reported and physician-measured traditional risk factors: an Australian case-control-family study. BMC Cancer 13: 406, 2013.
- Duffy DL, Lee KJ, Jagirdar K, et al.: High naevus count and MC1R red hair alleles contribute synergistically to increased melanoma risk. Br J Dermatol 181 (5): 1009-1016, 2019.
- Pellegrini C, Botta F, Massi D, et al.: MC1R variants in childhood and adolescent melanoma: a retrospective pooled analysis of a multicentre cohort. Lancet Child Adolesc Health 3 (5): 332-342, 2019.
- Wendt J, Mueller C, Rauscher S, et al.: Contributions by MC1R Variants to Melanoma Risk in Males and Females. JAMA Dermatol 154 (7): 789-795, 2018.
- van der Poel LAJ, Bergman W, Gruis NA, et al.: The role of MC1R gene variants and phenotypical features in predicting high nevus count. Melanoma Res 30 (5): 511-514, 2020.
- Demenais F, Mohamdi H, Chaudru V, et al.: Association of MC1R variants and host phenotypes with melanoma risk in CDKN2A mutation carriers: a GenoMEL study. J Natl Cancer Inst 102 (20): 1568-83, 2010.
- Fargnoli MC, Gandini S, Peris K, et al.: MC1R variants increase melanoma risk in families with CDKN2A mutations: a meta-analysis. Eur J Cancer 46 (8): 1413-20, 2010.
- Helsing P, Nymoen DA, Rootwelt H, et al.: MC1R, ASIP, TYR, and TYRP1 gene variants in a population-based series of multiple primary melanomas. Genes Chromosomes Cancer 51 (7): 654-61, 2012.
- Fargnoli MC, Fargnoli MC, Pike K, et al.: MC1R variants increase risk of melanomas harboring BRAF mutations. J Invest Dermatol 128 (10): 2485-90, 2008.
- Guida M, Strippoli S, Ferretta A, et al.: Detrimental effects of melanocortin-1 receptor (MC1R) variants on the clinical outcomes of BRAF V600 metastatic melanoma patients treated with BRAF inhibitors. Pigment Cell Melanoma Res 29 (6): 679-687, 2016.
- Hacker E, Olsen CM, Kvaskoff M, et al.: Histologic and Phenotypic Factors and MC1R Status Associated with BRAF(V600E), BRAF(V600K), and NRAS Mutations in a Community-Based Sample of 414 Cutaneous Melanomas. J Invest Dermatol 136 (4): 829-837, 2016.
- Thomas NE, Edmiston SN, Kanetsky PA, et al.: Associations of MC1R Genotype and Patient Phenotypes with BRAF and NRAS Mutations in Melanoma. J Invest Dermatol 137 (12): 2588-2598, 2017.
- Goldstein AM, Xiao Y, Sampson J, et al.: Rare germline variants in known melanoma susceptibility genes in familial melanoma. Hum Mol Genet 26 (24): 4886-4895, 2017.
- Yokoyama S, Woods SL, Boyle GM, et al.: A novel recurrent mutation in MITF predisposes to familial and sporadic melanoma. Nature 480 (7375): 99-103, 2011.
- Sturm RA, Fox C, McClenahan P, et al.: Phenotypic characterization of nevus and tumor patterns in MITF E318K mutation carrier melanoma patients. J Invest Dermatol 134 (1): 141-9, 2014.
- Berwick M, MacArthur J, Orlow I, et al.: MITF E318K's effect on melanoma risk independent of, but modified by, other risk factors. Pigment Cell Melanoma Res 27 (3): 485-8, 2014.
- Ciccarese G, Dalmasso B, Bruno W, et al.: Clinical, pathological and dermoscopic phenotype of MITF p.E318K carrier cutaneous melanoma patients. J Transl Med 18 (1): 78, 2020.
- Guhan SM, Artomov M, McCormick S, et al.: Cancer risks associated with the germline MITF(E318K) variant. Sci Rep 10 (1): 17051, 2020.
- Carlo M, Schroeder A, Mukherjee Y, et al.: Germline mutations in hereditary renal cell carcinoma (RCC) genes among 32,240 patients with all cancer types. [Abstract] J Clin Oncol 41 (16): 4559, 2023. Also
available online . Last accessed November 13, 2024. - Cancer risks in BRCA2 mutation carriers. The Breast Cancer Linkage Consortium. J Natl Cancer Inst 91 (15): 1310-6, 1999.
- Moran A, O'Hara C, Khan S, et al.: Risk of cancer other than breast or ovarian in individuals with BRCA1 and BRCA2 mutations. Fam Cancer 11 (2): 235-42, 2012.
- van Asperen CJ, Brohet RM, Meijers-Heijboer EJ, et al.: Cancer risks in BRCA2 families: estimates for sites other than breast and ovary. J Med Genet 42 (9): 711-9, 2005.
- Kadouri L, Temper M, Grenader T, et al.: Absence of founder BRCA1 and BRCA2 mutations in cutaneous malignant melanoma patients of Ashkenazi origin. Fam Cancer 8 (1): 29-32, 2009.
- Gumaste PV, Penn LA, Cymerman RM, et al.: Skin cancer risk in BRCA1/2 mutation carriers. Br J Dermatol 172 (6): 1498-506, 2015.
- Johansson PA, Nathan V, Bourke LM, et al.: Evaluation of the contribution of germline variants in BRCA1 and BRCA2 to uveal and cutaneous melanoma. Melanoma Res 29 (5): 483-490, 2019.
- Bui AN, LeBoeuf NR, Nambudiri VE: Skin cancer risk in CHEK2 mutation carriers. J Eur Acad Dermatol Venereol 35 (2): 353-359, 2021.
- Weischer M, Heerfordt IM, Bojesen SE, et al.: CHEK2*1100delC and risk of malignant melanoma: Danish and German studies and meta-analysis. J Invest Dermatol 132 (2): 299-303, 2012.
- Hatton JN, Sargen MR, Frone MN, et al.: Spectrum and Incidence of Skin Cancer among Individuals with Li-Fraumeni Syndrome. J Invest Dermatol 142 (9): 2534-2537.e1, 2022.
- Nieuwenburg SA, Adan F, Ruijs MWG, et al.: Cumulative risk of skin cancer in patients with Li-Fraumeni syndrome. Fam Cancer 19 (4): 347-351, 2020.
- Lesueur F, Easton DF, Renault AL, et al.: First international workshop of the ATM and cancer risk group (4-5 December 2019). Fam Cancer 21 (2): 211-227, 2022.
- Taylor AM, Lam Z, Last JI, et al.: Ataxia telangiectasia: more variation at clinical and cellular levels. Clin Genet 87 (3): 199-208, 2015.
- Hall MJ, Bernhisel R, Hughes E, et al.: Germline Pathogenic Variants in the Ataxia Telangiectasia Mutated (ATM) Gene are Associated with High and Moderate Risks for Multiple Cancers. Cancer Prev Res (Phila) 14 (4): 433-440, 2021.
- Mester J, Eng C: When overgrowth bumps into cancer: the PTEN-opathies. Am J Med Genet C Semin Med Genet 163C (2): 114-21, 2013.
- Pilarski R, Eng C: Will the real Cowden syndrome please stand up (again)? Expanding mutational and clinical spectra of the PTEN hamartoma tumour syndrome. J Med Genet 41 (5): 323-6, 2004.
- Eng C: PTEN Hamartoma Tumor Syndrome (PHTS). In: Adam MP, Feldman J, Mirzaa GM, et al., eds.: GeneReviews. University of Washington, Seattle, 1993-2024, pp.
Available online . Last accessed November 13, 2024. - Pilarski R, Burt R, Kohlman W, et al.: Cowden syndrome and the PTEN hamartoma tumor syndrome: systematic review and revised diagnostic criteria. J Natl Cancer Inst 105 (21): 1607-16, 2013.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 1.2023. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2022.
Available online with free registration. Last accessed June 24, 2024. - Bubien V, Bonnet F, Brouste V, et al.: High cumulative risks of cancer in patients with PTEN hamartoma tumour syndrome. J Med Genet 50 (4): 255-63, 2013.
- Tan MH, Mester JL, Ngeow J, et al.: Lifetime cancer risks in individuals with germline PTEN mutations. Clin Cancer Res 18 (2): 400-7, 2012.
- Nieuwenhuis MH, Kets CM, Murphy-Ryan M, et al.: Cancer risk and genotype-phenotype correlations in PTEN hamartoma tumor syndrome. Fam Cancer 13 (1): 57-63, 2014.
- Greene MH: The genetics of hereditary melanoma and nevi. 1998 update. Cancer 86 (11 Suppl): 2464-77, 1999.
- Olsen CM, Neale RE, Green AC, et al.: Independent validation of six melanoma risk prediction models. J Invest Dermatol 135 (5): 1377-84, 2015.
- Cho E, Rosner BA, Feskanich D, et al.: Risk factors and individual probabilities of melanoma for whites. J Clin Oncol 23 (12): 2669-75, 2005.
- Fears TR, Guerry D, Pfeiffer RM, et al.: Identifying individuals at high risk of melanoma: a practical predictor of absolute risk. J Clin Oncol 24 (22): 3590-6, 2006.
- Hampel H, Bennett RL, Buchanan A, et al.: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 17 (1): 70-87, 2015.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Melanoma: Cutaneous. Version 3.2022. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2022.
Available online with free registration. Last accessed June 24, 2024. - Kefford RF, Newton Bishop JA, Bergman W, et al.: Counseling and DNA testing for individuals perceived to be genetically predisposed to melanoma: A consensus statement of the Melanoma Genetics Consortium. J Clin Oncol 17 (10): 3245-51, 1999.
- Hansson J, Bergenmar M, Hofer PA, et al.: Monitoring of kindreds with hereditary predisposition for cutaneous melanoma and dysplastic nevus syndrome: results of a Swedish preventive program. J Clin Oncol 25 (19): 2819-24, 2007.
- Salerni G, Carrera C, Lovatto L, et al.: Benefits of total body photography and digital dermatoscopy ("two-step method of digital follow-up") in the early diagnosis of melanoma in patients at high risk for melanoma. J Am Acad Dermatol 67 (1): e17-27, 2012.
- Freedberg KA, Geller AC, Miller DR, et al.: Screening for malignant melanoma: A cost-effectiveness analysis. J Am Acad Dermatol 41 (5 Pt 1): 738-45, 1999.
- Pissa M, Lapins J, Sköldmark C, et al.: Melanoma-specific survival before and after inclusion in a familial melanoma dermatologic surveillance program in CDKN2A mutation carriers and non-carriers. J Eur Acad Dermatol Venereol 37 (2): 284-292, 2023.
- Tucker MA, Fraser MC, Goldstein AM, et al.: A natural history of melanomas and dysplastic nevi: an atlas of lesions in melanoma-prone families. Cancer 94 (12): 3192-209, 2002.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 3.2024. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023.
Available online with free registration. Last accessed November 13, 2024. - Overbeek KA, Levink IJM, Koopmann BDM, et al.: Long-term yield of pancreatic cancer surveillance in high-risk individuals. Gut 71 (6): 1152-1160, 2022.
- Goggins M, Overbeek KA, Brand R, et al.: Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium. Gut 69 (1): 7-17, 2020.
- Vasen H, Ibrahim I, Ponce CG, et al.: Benefit of Surveillance for Pancreatic Cancer in High-Risk Individuals: Outcome of Long-Term Prospective Follow-Up Studies From Three European Expert Centers. J Clin Oncol 34 (17): 2010-9, 2016.
Síndromes relacionados con tipos raros de cáncer de piel
Síndrome de Brooke-Spiegler, tricoepitelioma múltiple familiar y cilindromatosis familiar
El síndrome de Brooke-Spiegler (SBS), la cilindromatosis familiar y el tricoepitelioma múltiple familiar (MFT) son síndromes autosómicos dominantes con características clínicas superpuestas y variación alélica.[
Se piensa que estos síndromes representan manifestaciones fenotípicas diferentes de la misma enfermedad, porque se han identificado variantes patogénicas de CYLD en16q12-q13 en personas con cada uno de estos síndromes.[
Dado el potencial de agrandamiento progresivo, el abordaje preferido para los cilindromas es la ablación cuando los tumores son pequeños y de fácil manejo. La electrocirugía o la cirugía micrográfica de Mohs son opciones de terapia, aunque la extirpación de lesiones grandes quizás exija injertos cutáneos para obtener cicatrización.[
Nivel de evidencia: 4
Carcinoma sebáceo
Síndrome de Muir-Torre y síndrome de Lynch
Las neoplasias sebáceas cutáneas a veces se asocian con el síndrome de Muir-Torre (MTS). Se han descrito múltiples tipos de tumores sebáceos, como los adenomas sebáceos, los epiteliomas, los carcinomas, los queratoacantomas y los CCB con diferenciación sebácea, en el MTS. Este síndrome es una variación del síndrome de cáncer colorrectal no polipósico o síndrome de Lynch, que produce aparición sincrónica o metacrónica de por lo menos una neoplasia cutánea sebácea y una neoplasia visceral. Las neoplasias viscerales pueden originarse a nivel digestivo (colon y recto, estómago, intestino delgado, hígado y vías biliares) o urogenital (endometrio y vejiga). Estas neoplasias malignas suelen presentar un fenotipo menos maligno que los casos equivalentes de tumores no relacionados con el MTS.[
Si bien se ha indicado con frecuencia que la hiperplasia sebácea no se asocia con el MTS, cualquier lesión sebácea con características histológicas atípicas o dificultad para la clasificación justifica exploración inmediata de los antecedentes del paciente y su historia familiar. Se justifica atención especial cuando los pacientes con neoplasias sebáceas se derivan al genetista médico o gastroenterólogo para las evaluaciones del síndrome de Lynch. Si bien la mayoría de los pacientes con MTS reciben el diagnóstico de una neoplasia maligna visceral antes de presentar una neoplasia maligna cutánea, el 22 % de los pacientes primero presenta la neoplasia sebácea cutánea. Esta situación brinda la oportunidad de detectar las neoplasias viscerales.[
Nivel de evidencia: 3
Síndrome de Lynch y otros factores de riesgo de cáncer de piel
En múltiples estudios se ha indicado que las personas con síndrome de Lynch tienen un riesgo más alto de neoplasias cutáneas. En un estudio de 607 personas con síndrome de Lynch (mediana de edad en el momento de la prueba genética de 50 años) se encontró que el 21 % tenía una neoplasia cutánea, casi un tercio de aquellos con más de un tipo histológico.[
Leiomiomatosis hereditaria y carcinoma de células renales
Aunque los tumores de músculo liso cutáneos (leiomiomas) no son en sí mismos una forma de cáncer de piel, la presencia de múltiples leiomiomas cutáneos se relaciona con cáncer de células renales (CCR) en pacientes que tienen un síndrome hereditario conocido como leiomiomatosis hereditaria y cáncer de células renales (HLRCC). Este síndrome se vincula con variantes patogénicas germinales del gen FH. Los leiomiomas cutáneos se presentan en forma de pápulas y nódulos firmes, rosados o de color marrón rojizo, en el tronco y las extremidades y, en ocasiones, en la cara. Aparecen a una mediana de edad de 25 años (intervalo de edad, 10–47 años) y tienden a aumentar de tamaño y número con la edad. Las lesiones son sensibles al tacto suave o al frío y, con menos frecuencia, son dolorosas. La intensidad del dolor se correlaciona con la gravedad del compromiso cutáneo.[
Referencias:
- Bowen S, Gill M, Lee DA, et al.: Mutations in the CYLD gene in Brooke-Spiegler syndrome, familial cylindromatosis, and multiple familial trichoepithelioma: lack of genotype-phenotype correlation. J Invest Dermatol 124 (5): 919-20, 2005.
- Burrows NP, Jones RR, Smith NP: The clinicopathological features of familial cylindromas and trichoepitheliomas (Brooke-Spiegler syndrome): a report of two families. Clin Exp Dermatol 17 (5): 332-6, 1992.
- Rajan N, Langtry JA, Ashworth A, et al.: Tumor mapping in 2 large multigenerational families with CYLD mutations: implications for disease management and tumor induction. Arch Dermatol 145 (11): 1277-84, 2009.
- Young AL, Kellermayer R, Szigeti R, et al.: CYLD mutations underlie Brooke-Spiegler, familial cylindromatosis, and multiple familial trichoepithelioma syndromes. Clin Genet 70 (3): 246-9, 2006.
- Welch JP, Wells RS, Kerr CB: Ancell-Spiegler cylindromas (turban tumours) and Brooke-Fordyce Trichoepitheliomas: evidence for a single genetic entity. J Med Genet 5 (1): 29-35, 1968.
- Saggar S, Chernoff KA, Lodha S, et al.: CYLD mutations in familial skin appendage tumours. J Med Genet 45 (5): 298-302, 2008.
- Harada H, Hashimoto K, Ko MS: The gene for multiple familial trichoepithelioma maps to chromosome 9p21. J Invest Dermatol 107 (1): 41-3, 1996.
- Rajan N, Trainer AH, Burn J, et al.: Familial cylindromatosis and brooke-spiegler syndrome: a review of current therapeutic approaches and the surgical challenges posed by two affected families. Dermatol Surg 35 (5): 845-52, 2009.
- Schwartz RA, Torre DP: The Muir-Torre syndrome: a 25-year retrospect. J Am Acad Dermatol 33 (1): 90-104, 1995.
- Cohen PR, Kohn SR, Kurzrock R: Association of sebaceous gland tumors and internal malignancy: the Muir-Torre syndrome. Am J Med 90 (5): 606-13, 1991.
- Cerosaletti KM, Lange E, Stringham HM, et al.: Fine localization of the Nijmegen breakage syndrome gene to 8q21: evidence for a common founder haplotype. Am J Hum Genet 63 (1): 125-34, 1998.
- Mangold E, Pagenstecher C, Leister M, et al.: A genotype-phenotype correlation in HNPCC: strong predominance of msh2 mutations in 41 patients with Muir-Torre syndrome. J Med Genet 41 (7): 567-72, 2004.
- Mathiak M, Rütten A, Mangold E, et al.: Loss of DNA mismatch repair proteins in skin tumors from patients with Muir-Torre syndrome and MSH2 or MLH1 germline mutations: establishment of immunohistochemical analysis as a screening test. Am J Surg Pathol 26 (3): 338-43, 2002.
- Mangold E, Rahner N, Friedrichs N, et al.: MSH6 mutation in Muir-Torre syndrome: could this be a rare finding? Br J Dermatol 156 (1): 158-62, 2007.
- Arnold A, Payne S, Fisher S, et al.: An individual with Muir-Torre syndrome found to have a pathogenic MSH6 gene mutation. Fam Cancer 6 (3): 317-21, 2007.
- Murphy HR, Armstrong R, Cairns D, et al.: Muir-Torre Syndrome: expanding the genotype and phenotype--a further family with a MSH6 mutation. Fam Cancer 7 (3): 255-7, 2008.
- Aziz S, O'Sullivan H, Heelan K, et al.: Characterization of sebaceous and non-sebaceous cutaneous manifestations in patients with lynch syndrome: a systematic review. Fam Cancer 22 (2): 167-175, 2023.
- Plocharczyk EF, Frankel WL, Hampel H, et al.: Mismatch repair protein deficiency is common in sebaceous neoplasms and suggests the importance of screening for Lynch syndrome. Am J Dermatopathol 35 (2): 191-5, 2013.
- Kattapuram M, Shabet C, Austin S, et al.: A retrospective cohort study of genetic referral and diagnosis of Lynch syndrome in patients with cutaneous sebaceous lesions. Fam Cancer 22 (3): 295-301, 2023.
- Akhtar S, Oza KK, Khan SA, et al.: Muir-Torre syndrome: case report of a patient with concurrent jejunal and ureteral cancer and a review of the literature. J Am Acad Dermatol 41 (5 Pt 1): 681-6, 1999.
- Entius MM, Keller JJ, Drillenburg P, et al.: Microsatellite instability and expression of hMLH-1 and hMSH-2 in sebaceous gland carcinomas as markers for Muir-Torre syndrome. Clin Cancer Res 6 (5): 1784-9, 2000.
- Zhong CS, Horiguchi M, Uno H, et al.: Clinical factors associated with skin neoplasms in individuals with Lynch syndrome in a longitudinal observational cohort. J Am Acad Dermatol 88 (6): 1282-1290, 2023.
- Adan F, Crijns MB, Zandstra WSE, et al.: Cumulative risk of skin tumours in patients with Lynch syndrome. Br J Dermatol 179 (2): 522-523, 2018.
- Toro JR, Nickerson ML, Wei MH, et al.: Mutations in the fumarate hydratase gene cause hereditary leiomyomatosis and renal cell cancer in families in North America. Am J Hum Genet 73 (1): 95-106, 2003.
Aspectos psicosociales del melanoma familiar
Introducción
En esta sección se revisan las publicaciones que tratan sobre la reducción del riesgo y las conductas de detección temprana en personas con riesgo elevado de melanoma por una historia familiar de esta enfermedad, y en personas de familias que se hicieron pruebas de variantes patogénicas de riesgo alto de melanoma. En la revisión también se aborda la percepción del riesgo y la comunicación en personas con riesgo elevado de melanoma.
Interés y aceptación de las pruebas genéticas de riesgo de melanoma
En pocos estudios se examinó la motivación y el interés en la prueba genética para el riesgo de melanoma. En resumen, los resultados son los siguientes:
- Interés alto, pero no universal, en la prueba genética.[
1 ,2 ,3 ] - Beneficios articulados de la prueba en personas con riesgo elevado.[
1 ,2 ,4 ] - Cierta carencia de un análisis de las posibles limitaciones de las pruebas o de las razones para abstenerse de la prueba.[
1 ,2 ,3 ]
En Australia, en un estudio cualitativo (N = 40) se encontró que casi todos los participantes con historia familiar significativa con melanoma tenían interés en someterse a la prueba genética.[
En un estudio holandés se examinó el interés en la prueba para CDKN2A (variante patogénica Leiden p16). De las 510 cartas enviadas a miembros de 18 familias con resultados positivos para Leiden p16 de un consultorio para lesiones pigmentadas en Leiden University Medical Center de los Países Bajos, 488 personas respondieron asistiendo a una consulta para someterse a un examen físico y otros 15 familiares acompañaron a estas personas. De estas personas que consultaron, 403 fueron elegibles para asesoramiento genético. En total, 184 personas asistieron al asesoramiento y 141 optaron por hacerse la prueba genética. Después de la consulta de orientación, 94 personas devolvieron un cuestionario completo. La edad avanzada predijo un interés más alto en la prueba genética; las razones para hacerse las pruebas fueron conocer el riesgo personal (57 %) y conocer el riesgo de un hijo o hija que porta la variante patogénica (69 %). La mayoría de los participantes (88 %) opinaron que la prueba genética contribuiría al diagnóstico dentro de su familia. Sin embargo, algunas personas (40 %) comentaron que no esperaban recibir información sobre riesgo de cáncer de páncreas, y la mitad de los participantes (49 %) expresaron aumento de la preocupación sobre la posibilidad de presentar cáncer de páncreas.[
En un estudio australiano de 121 personas con una historia familiar significativa de melanoma, los participantes completaron cuestionarios antes del asesoramiento y la prueba genética.[
Pruebas en la niñez
En una revisión sistemática se analizaron 3 estudios que examinaban las actitudes de los participantes sobre si se debía realizar una prueba genética de melanoma hereditario en menores.[
Conocimiento y reducción del riesgo en personas con un riesgo familiar elevado de melanoma
Se han llevado a cabo varios estudios en los que se examina la reducción del riesgo mediante la adopción de conductas de protección solar (incluso el uso de protector solar y ropa protectora, y la búsqueda de sombra) en personas con historia familiar de melanoma. En general, estos estudios indican una adopción y mantenimiento irregulares de estos comportamientos. La mayoría de estos estudios se han llevado a cabo con poblaciones de consultorios que podrían ser más propensas a implementar conductas de reducción del riesgo y de detección que otras personas con un perfil de riesgo similar de la población general.[
En una población sueca se entrevistaron 87 adultos jóvenes con nevos displásicos con respecto a sus conductas de protección solar. El 70 % estimó que su riesgo de melanoma era igual o inferior al riesgo general de la población sueca, y un tercio notificó que tomaba el sol a menudo.[
En un estudio centrado en 68 menores (17 años o menos) sobrevivientes de melanoma, se demostró que, aunque las tasas generales de conductas de protección solar eran altas (cerca del 80 %), las tasas de quemaduras solares también fueron altas (49 %).[
En otro estudio del Reino Unido se examinaron las tasas de quemaduras solares en 170 personas con historia familiar de melanoma y se compararon con las tasas de 140 controles emparejados por edad, sexo y ubicación geográfica. De los pacientes con historia familiar de melanoma, el 31 % notificó quemaduras solares en el verano anterior (en comparación con 41 % de los controles); las familias con melanoma notificaron mejores conductas de protección solar que los controles en general. En los controles y en los pacientes con historia familiar de melanoma, los varones más jóvenes tenían más probabilidades de notificar quemaduras solares recientes; además, en los controles y los pacientes con una historia familiar de melanoma, los familiares con síndrome de lunar atípico y confianza en su capacidad para prevenir el melanoma mostraron un mejor grado de protección solar.[
En un estudio retrospectivo internacional de una cohorte grande (547 familias, 2047 personas) de melanoma familiar (GenoMEL) se examinó la exposición solar de manera longitudinal y las conductas de protección solar en diferentes cohortes de nacimiento. Los investigadores encontraron que la exposición solar había sido similar en todas las cohortes de nacimiento. El uso de protector solar aumentó a lo largo de la vida de los participantes y el uso fue más frecuente en las cohortes de nacimiento más recientes. No se encontraron diferencias en los antecedentes de exposición al sol, uso de protector solar o de cámaras de bronceado entre las personas con melanoma y aquellas que no tenían este tipo de cáncer. Sin embargo, las conductas de protección solar aumentaron después de que los participantes recibieron el diagnóstico de melanoma.[
En un estudio cualitativo de 20 FPG de pacientes con melanoma de un consultorio de riesgo alto vinculado a la University of Arizona, se identificaron necesidades insatisfechas en cuanto a la comunicación sobre el estado de riesgo durante la consulta médica, entre ellas, una mayor congruencia en la comunicación, educación para los pacientes sobre la importancia de la historia familiar para definir el estado de riesgo, y necesidades y deseo de recibir un asesoramiento más profundo (por ejemplo, la aplicación repetida de protector solar y el uso de ropa con factor de protección ultravioleta).[
En un estudio prospectivo se examinó el interés en los desenlaces conductuales y psicosociales a los 3 meses relacionados con la divulgación de los resultados de la prueba de variantes patogénicas de riesgo alto para el melanoma en 19 personas (3 portadores de CDKN2A).[
Comportamientos de detección en personas con un riesgo familiar elevado de melanoma
En varios estudios se examinaron las conductas de detección temprana en personas con un riesgo más alto de melanoma. En una muestra estadounidense de 404 hermanos y hermanas de una población de pacientes con melanoma atendida en un consultorio, solo el 42 % de las personas había asistido a una consulta de dermatología en su vida; el 62 % se había hecho un autoexamen cutáneo; el 27 % se había sometido a un examen médico de la piel; y solo el 54 % usaban protector solar de manera rutinaria. El sexo femenino se relacionó con mayor uso de protector solar y las personas mayores de 50 años tenían más probabilidades de haberse sometido a un examen médico de la piel. Se encontró una relación fuerte entre asistir a consulta de dermatología y los 3 desenlaces (autoexamen de la piel, examen médico y uso de protector solar).[
En un estudio transversal de Australia con 120 personas de familias con una variante patogénica del gen CDKN2A conocida, se encontró que en los últimos 12 meses, el 50 % notificó haberse hecho por lo menos 4 autoexámenes de la piel, y 43 % se había sometido al menos a 1 examen clínico de la piel. En contraste, el 15 % no se había realizado un autoexamen de la piel en los últimos 12 meses, y el 27 % nunca se había hecho un examen clínico de la piel. Las conductas sobre exámenes de detección del cáncer de piel se correlacionaron con tener antecedentes de melanoma, una recomendación médica e intenciones conductuales más fuertes. Otras correlaciones para el autoexamen cutáneo fueron la confianza en la habilidad para protegerse del sol, la percepción de la eficacia del tratamiento con melanoma y la angustia específica por el melanoma. El riesgo percibido de presentar melanoma no se relacionó de manera significativa con las conductas de detección del cáncer de piel.[
En una revisión sistemática se proporcionó un resumen descriptivo de los resultados de comportamiento (conductas de protección solar, autoexamen de piel y examen clínico de la piel) relacionados con la prueba genética del riesgo de melanoma hereditario. Aunque se presentaron algunas diferencias entre los estudios, en más de la mitad de los estudios se encontró que una variante patogénica hereditaria se asociaba con aumento del cumplimiento (o las intenciones) con las recomendaciones de prevención y detección del melanoma. No se encontró disminución en las conductas de protección solar en las personas no portadoras de la variante.[
Estudios de intervención
Algunos estudios de intervención se enfocan en el conocimiento del melanoma, la protección solar y los exámenes de detección en familiares de pacientes con melanoma. En un estudio de una población atendida en un consultorio, un grupo de hermanos y hermanas de pacientes se asignaron al azar a una intervención que incluía mensajes telefónicos y materiales impresos personalizados sobre las recomendaciones de reducción del riesgo y exámenes de detección. El grupo de atención habitual recibió una recomendación estándar durante la consulta médica sobre la notificación del diagnóstico a los familiares del paciente. En el grupo de intervención se observaron mejoras en el conocimiento sobre el melanoma, confianza en que debían solicitar una consulta por dermatología para someterse a un examen de detección, y mejora más significativa en las prácticas de autoexamen de la piel en comparación con los participantes de control después de 12 meses; en ambos grupos se duplicó el número de exámenes médicos después de 12 meses; no hubo cambios en el uso de protector solar en ninguno de los grupos.[
En otro estudio, se asignó al azar a 443 familiares de pacientes con melanoma a un grupo de atención genérica y uno de una intervención adaptada que constaba ya fuera de 3 correos impresos (no personalizados y personalizados) o 1 sesión telefónica de orientación (no personalizada y personalizada). En general, en el grupo de intervención personalizada se observó un aumento casi al doble de la frecuencia de los exámenes clínicos de toda la piel en una consulta de atención primaria en comparación con la intervención genérica. Sin embargo, no se observaron diferencias en los autoexámenes cutáneos en los grupos de intervención. En contraste con el estudio previo, en el que no se observaron mejoras en las conductas de protección solar,[
Resultados psicosociales del asesoramiento genético y la prueba genética
En una revisión sistemática se examinaron varios resultados psicosociales en personas de alto riesgo sometidas a una prueba genética de melanoma y que participaron en estudios cuyos resultados se publicaron entre 1995 y 2020.[
Referencias:
- Bränström R, Kasparian NA, Affleck P, et al.: Perceptions of genetic research and testing among members of families with an increased risk of malignant melanoma. Eur J Cancer 48 (16): 3052-62, 2012.
- Kasparian NA, Meiser B, Butow PN, et al.: Anticipated uptake of genetic testing for familial melanoma in an Australian sample: An exploratory study. Psychooncology 16 (1): 69-78, 2007.
- de Snoo FA, Riedijk SR, van Mil AM, et al.: Genetic testing in familial melanoma: uptake and implications. Psychooncology 17 (8): 790-6, 2008.
- Loescher LJ, Crist JD, Siaki LA: Perceived intrafamily melanoma risk communication. Cancer Nurs 32 (3): 203-10, 2009 May-Jun.
- Kasparian NA, Butow PN, Meiser B, et al.: High- and average-risk individuals' beliefs about, and perceptions of, malignant melanoma: an Australian perspective. Psychooncology 17 (3): 270-9, 2008.
- Primiero CA, Yanes T, Finnane A, et al.: A Systematic Review on the Impact of Genetic Testing for Familial Melanoma II: Psychosocial Outcomes and Attitudes. Dermatology 237 (5): 816-826, 2021.
- Shuk E, Burkhalter JE, Baguer CF, et al.: Factors associated with inconsistent sun protection in first-degree relatives of melanoma survivors. Qual Health Res 22 (7): 934-45, 2012.
- Bergenmar M, Brandberg Y: Sunbathing and sun-protection behaviors and attitudes of young Swedish adults with hereditary risk for malignant melanoma. Cancer Nurs 24 (5): 341-50, 2001.
- Manne S, Fasanella N, Connors J, et al.: Sun protection and skin surveillance practices among relatives of patients with malignant melanoma: prevalence and predictors. Prev Med 39 (1): 36-47, 2004.
- Azzarello LM, Dessureault S, Jacobsen PB: Sun-protective behavior among individuals with a family history of melanoma. Cancer Epidemiol Biomarkers Prev 15 (1): 142-5, 2006.
- Glenn BA, Bastani R, Chang LC, et al.: Sun protection practices among children with a family history of melanoma: a pilot study. J Cancer Educ 27 (4): 731-7, 2012.
- Newton Bishop JA, Gruis NA: Genetics: what advice for patients who present with a family history of melanoma? Semin Oncol 34 (6): 452-9, 2007.
- Lacson JCA, Zamani SA, Froes LAR, et al.: Birth cohort-specific trends of sun-related behaviors among individuals from an international consortium of melanoma-prone families. BMC Public Health 21 (1): 692, 2021.
- Loescher LJ, Crist JD, Cranmer L, et al.: Melanoma high-risk families' perceived health care provider risk communication. J Cancer Educ 24 (4): 301-7, 2009.
- Christensen KD, Roberts JS, Shalowitz DI, et al.: Disclosing individual CDKN2A research results to melanoma survivors: interest, impact, and demands on researchers. Cancer Epidemiol Biomarkers Prev 20 (3): 522-9, 2011.
- Geller AC, Emmons K, Brooks DR, et al.: Skin cancer prevention and detection practices among siblings of patients with melanoma. J Am Acad Dermatol 49 (4): 631-8, 2003.
- Azzarello LM, Jacobsen PB: Factors influencing participation in cutaneous screening among individuals with a family history of melanoma. J Am Acad Dermatol 56 (3): 398-406, 2007.
- Coups EJ, Manne SL, Jacobsen PB, et al.: Skin surveillance intentions among family members of patients with melanoma. BMC Public Health 11: 866, 2011.
- Kasparian NA, McLoone JK, Meiser B, et al.: Skin cancer screening behaviours among individuals with a strong family history of malignant melanoma. Br J Cancer 103 (10): 1502-9, 2010.
- Primiero CA, Yanes T, Finnane A, et al.: A Systematic Review on the Impact of Genetic Testing for Familial Melanoma I: Primary and Secondary Preventative Behaviours. Dermatology 237 (5): 806-815, 2021.
- Geller AC, Emmons KM, Brooks DR, et al.: A randomized trial to improve early detection and prevention practices among siblings of melanoma patients. Cancer 107 (4): 806-14, 2006.
- Manne S, Jacobsen PB, Ming ME, et al.: Tailored versus generic interventions for skin cancer risk reduction for family members of melanoma patients. Health Psychol 29 (6): 583-93, 2010.
Actualizaciones más recientes a este resumen (03 / 14 / 2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre la genética del cáncer de piel. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Genética del cáncer de piel son:
- Kathleen A. Calzone, PhD, RN, AGN-BC, FAAN (National Cancer Institute)
- Joanne Marie Jeter, MD (City of Hope)
- Kelly Carter Nelson, MD, FAAD (M.D. Anderson Cancer Center at University of Texas)
- Suzanne C. O'Neill, PhD (Georgetown University)
- John M. Quillin, PhD, MPH, MS (Virginia Commonwealth University)
- Charite Ricker, MS, CGC (University of Southern California)
- Amanda Ewart Toland, PhD, FACMG (The Ohio State University)
- Catharine Wang, PhD, MSc (Boston University School of Public Health)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como "En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]".
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre la genética del cáncer. PDQ Genética del cáncer de piel. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del
Última revisión: 2025-03-14
Esta información no reemplaza el consejo de un médico. Ignite Healthwise, LLC, niega toda garantía y responsabilidad por el uso de esta información. El uso que usted haga de esta información implica que usted acepta los
Healthwise, Healthwise para cada decisión de la salud, y el logo de Healthwise son marcas de fábrica de Ignite Healthwise, LLC.
Page Footer
Quiero...
Audiencia
Sitios seguros para miembros
Información sobre The Cigna Group
Aviso legal
Los planes individuales y familiares de seguro médico y dental están asegurados por Cigna Health and Life Insurance Company (CHLIC), Cigna HealthCare of Arizona, Inc., Cigna HealthCare of Illinois, Inc., Cigna HealthCare of Georgia, Inc., Cigna HealthCare of North Carolina, Inc., Cigna HealthCare of South Carolina, Inc. y Cigna HealthCare of Texas, Inc. Los planes de beneficios de salud y de seguro de salud de grupo están asegurados o administrados por CHLIC, Connecticut General Life Insurance Company (CGLIC) o sus afiliadas (puedes ver
Todas las pólizas de seguros y los planes de beneficios de grupo contienen exclusiones y limitaciones. Para conocer la disponibilidad, los costos y detalles completos de la cobertura, comunícate con un agente autorizado o con un representante de ventas de Cigna. Este sitio web no está dirigido a los residentes de New Mexico.