Comprar planes
Comprar tu propia cobertura
Planes a través de tu empleador
Conoce sobre los beneficios médicos, dentales, de farmacia y voluntarios que tu empleador puede ofrecer.
Aprender
¿Vives o trabajas fuera del país?
Tratamiento de los tumores de estroma gastrointestinal (PDQ®) : Tratamiento - información para profesionales de salud [NCI]
Esta información es producida y suministrada por el Instituto Nacional del Cáncer (NCI, por sus siglas en inglés). La información en este tema puede haber cambiado desde que se escribió. Para la información más actual, comuníquese con el Instituto Nacional del Cáncer a través del Internet en la página web http://cancer.gov o llame al 1-800-4-CANCER.
Información general sobre los tumores de estroma gastrointestinal
Incidencia
Aunque comprenden menos del 1 % de todos los tumores gastrointestinales (GI), los tumores de estroma gastrointestinal (GIST o GIST) son los tumores mesenquimatosos más comunes del aparato digestivo.[
No se conoce la verdadera incidencia, en parte porque los tumores pequeños de crecimiento lento (es decir, <1 cm) no son evidentes desde el punto de vista clínico o no se incluyen en los registros de cáncer.[
La mayoría de los GIST son esporádicos, pero hay formas familiares poco frecuentes que se relacionan con la neurofibromatosis de tipo 1 (NF1) o variantes hereditarias de KIT y SDH.[
Cuadro clínico inicial
Los tumores de estroma gastrointestinal (GIST) se presentan en cualquier parte del aparato digestivo, pero con mayor frecuencia se encuentran en el estómago o el intestino delgado. En el American Joint Committee on Cancer (AJCC) Cancer Staging Manual se enumeran las siguientes distribuciones aproximadas:[
- Estómago (60 %).
- Intestino delgado, yeyuno e íleon (30 %).
- Duodeno (5 %).
- Recto (3 %).
- Colon (1 %).
- Esófago (<1 %).
- Tumores diseminados sin tumor primario conocido (poco frecuente).
- Epiplón o mesenterio (poco frecuente).
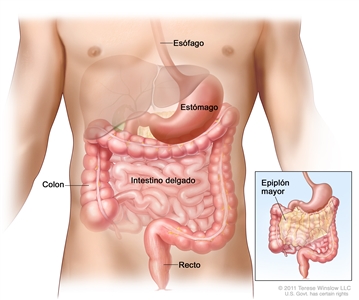
Los GIST varían en tamaño, desde menos de 1 cm hasta más de 40 cm, con un tamaño promedio de alrededor de 5 cm cuando se diagnostican mediante evaluación clínica. Por lo general, surgen dentro de la pared muscular del aparato digestivo.[
El cuadro clínico inicial de los pacientes con GIST varía según los siguientes aspectos:[
- Localización anatómica.
- Tamaño del tumor.
- Tasa de crecimiento tumoral.
Los signos y síntomas de GIST son los siguientes:
- Hemorragia gastrointestinal (presentación más habitual), que tal vez sea aguda (melena o hematemesis) o crónica, y produce anemia.
- Rotura tumoral aguda.
- Obstrucción gastrointestinal.
- Dolor.
- Disfagia.
- Saciedad precoz.
Es posible encontrar por casualidad lesiones más pequeñas durante una cirugía, estudio radiológico o endoscopia. Se desconoce la evolución natural de estos tumores incidentales y la frecuencia de progresión a enfermedad sintomática. Es posible que un reservorio sustancial de GIST pequeños no progrese a estadios sintomáticos.
Los sitios comunes de metástasis incluyen la diseminación hepática y peritoneal dentro de la cavidad abdominal. En los adultos, el compromiso de los ganglios linfáticos y la diseminación a los pulmones u otros sitios extraabdominales es infrecuente.[
En algunos pacientes se notificó hipotiroidismo paraneoplásico consuntivo poco frecuente (debido a la sobreexpresión de una enzima inactivadora tiroidea).[
En el ámbito pediátrico, los GIST se suelen relacionar con la pérdida de SDH en la línea germinal. El comportamiento clínico se distingue por la localización gástrica, evolución menos activa, presentación multifocal y metástasis en los ganglios linfáticos. La pérdida germinal de SDH también se relaciona con cáncer de riñón hereditario, paragangliomas y otros tumores.[
Evaluación diagnóstica
Los tumores de estroma gastrointestinal (GIST) se deben incluir en el diagnóstico diferencial de cualquier neoplasia maligna no epitelial intraabdominal. Las intervenciones diagnósticas estándar incluyen los siguientes procedimientos:[
- Tomografía computarizada (TC).
- Imágenes por resonancia magnética (IRM).
- Tomografía por emisión de positrones (TEP).
- Endoscopia.
La ecografía endoscópica con biopsia por aspiración con aguja fina es útil para la detección de los GIST en el aparato digestivo superior, ya que la mayoría de los tumores surgen debajo de la capa mucosa y crecen de manera endofítica. Se prefiere la biopsia por aguja fina guiada por ecografía endoscópica a la biopsia percutánea, debido al riesgo de hemorragia tumoral y diseminación peritoneal.[
Pronóstico
Los factores pronósticos de los GIST no metastásicos son los siguientes:
- Índice mitótico.
- Tamaño del tumor.
- Localización del tumor (gástrico, no gástrico, rectal).
- Rotura tumoral.
- Características de las imágenes.
Alrededor del 20 % al 25 % de los GIST gástricos y del 40 % al 50 % de los GIST de intestino delgado son agresivos desde el punto de vista clínico.[
También se reconoce que la rotura tumoral empeora de manera notable la supervivencia sin recidiva.[
| Índice mitótico (mitosis/CGA) | Tamaño del tumor (cm) | Tasa de metástasis (%) | Riesgo de enfermedad progresiva |
|---|---|---|---|
| GIST = tumores de estroma gastrointestinal; CGA = campo de gran aumento. | |||
| a Adaptado de Miettinen et al[ |
|||
| ≤5 por 50 | ≤2 | 0 | Ninguno |
| >2 a ≤5 | 1,9 | Muy bajo | |
| >5 a ≤10 | 3,6 | Bajo | |
| >10 | 12 | Moderado | |
| >5 por 50 | ≤2 | 0 | Ninguno |
| >2 a ≤5 | 16 | Moderado | |
| >5 a ≤10 | 55 | Alto | |
| >10 | 86 | Alto | |
| Índice mitótico (mitosis/CGA) | Tamaño (cm) | Tasa de metástasis (%) | Riesgo de enfermedad progresiva |
|---|---|---|---|
| GIST = tumores de estroma gastrointestinal; CGA = campo de gran aumento. | |||
| a Adaptado de Miettinen et al[ |
|||
| ≤5 por 50 | ≤2 | 0 | Ninguno |
| >2 a ≤5 | 1,9–8,5 | Bajo | |
| >5 a ≤10 | 24 | Datos insuficientes–Moderado | |
| >10 | 34–52 | Alto | |
| >5 por 50 | ≤2 | 50–54 | Datos insuficientes–Alto |
| >2 a ≤5 | 50–73 | Alto | |
| >5 a ≤10 | 85 | Alto | |
| >10 | 71–90 | Alto | |
Seguimiento
Respuesta al tratamiento
La TC, la TEP con flúor F 18-fludesoxiglucosa (18F-FDG) y la IRM se usan para controlar los efectos de la terapia sistémica en pacientes con enfermedad irresecable, metastásica o recidivante.[
Se debe realizar una TEP inicial antes del tratamiento con un inhibidor de tirosina–cinasas (ITC) en los pacientes que se supervisarán con una TEP con 18F-FDG para determinar la respuesta. Es posible que las imágenes realizadas mediante TEP detecten la actividad del imatinib en los GIST mucho antes que las imágenes con TC, con disminución de la avidez tumoral detectada tan pronto como 24 horas después de la primera dosis. Por lo tanto, la TEP quizás sea una modalidad diagnóstica útil para la evaluación muy temprana de la respuesta a la terapia con imatinib y para detectar la resistencia a los ITC.[
Vigilancia de la enfermedad metastásica o recidivante
No se ha estudiado la modalidad ni la frecuencia óptimas para la vigilancia de la enfermedad metastásica o recidivante en pacientes sometidos a resección de GIST. En función de la probabilidad de recidiva, las recomendaciones de seguimiento se derivan de la opinión de expertos y del análisis clínico.
Para los pacientes con enfermedad localizada tratados con cirugía, los programas de seguimiento de rutina quizás varíen según las instituciones y dependen del estado de riesgo del tumor.[
Referencias:
- Judson I, Demetri G: Advances in the treatment of gastrointestinal stromal tumours. Ann Oncol 18 (Suppl 10): x20-4, 2007.
- Miettinen M, Lasota J: Gastrointestinal stromal tumors--definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch 438 (1): 1-12, 2001.
- Miettinen M, Sarlomo-Rikala M, Lasota J: Gastrointestinal stromal tumors: recent advances in understanding of their biology. Hum Pathol 30 (10): 1213-20, 1999.
- Ma GL, Murphy JD, Martinez ME, et al.: Epidemiology of gastrointestinal stromal tumors in the era of histology codes: results of a population-based study. Cancer Epidemiol Biomarkers Prev 24 (1): 298-302, 2015.
- Søreide K, Sandvik OM, Søreide JA, et al.: Global epidemiology of gastrointestinal stromal tumours (GIST): A systematic review of population-based cohort studies. Cancer Epidemiol 40: 39-46, 2016.
- Kawanowa K, Sakuma Y, Sakurai S, et al.: High incidence of microscopic gastrointestinal stromal tumors in the stomach. Hum Pathol 37 (12): 1527-35, 2006.
- Agaimy A, Wünsch PH, Hofstaedter F, et al.: Minute gastric sclerosing stromal tumors (GIST tumorlets) are common in adults and frequently show c-KIT mutations. Am J Surg Pathol 31 (1): 113-20, 2007.
- Benesch M, Wardelmann E, Ferrari A, et al.: Gastrointestinal stromal tumors (GIST) in children and adolescents: A comprehensive review of the current literature. Pediatr Blood Cancer 53 (7): 1171-9, 2009.
- Joensuu H, Hohenberger P, Corless CL: Gastrointestinal stromal tumour. Lancet 382 (9896): 973-83, 2013.
- Gastrointestinal stromal tumor. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 523–9.
- Corless CL, Heinrich MC: Molecular pathobiology of gastrointestinal stromal sarcomas. Annu Rev Pathol 3: 557-86, 2008.
- Casali PG, Dei Tos AP, Gronchi A: Gastrointestinal stromal tumor. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. 11th ed. Wolters Kluwer, 2019, pp 895-906.
- Miettinen M, Lasota J: Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 130 (10): 1466-78, 2006.
- DeMatteo RP, Lewis JJ, Leung D, et al.: Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg 231 (1): 51-8, 2000.
- Maynard MA, Marino-Enriquez A, Fletcher JA, et al.: Thyroid hormone inactivation in gastrointestinal stromal tumors. N Engl J Med 370 (14): 1327-34, 2014.
- Janeway KA, Pappo A: Treatment guidelines for gastrointestinal stromal tumors in children and young adults. J Pediatr Hematol Oncol 34 (Suppl 2): S69-72, 2012.
- Miettinen M, Lasota J, Sobin LH: Gastrointestinal stromal tumors of the stomach in children and young adults: a clinicopathologic, immunohistochemical, and molecular genetic study of 44 cases with long-term follow-up and review of the literature. Am J Surg Pathol 29 (10): 1373-81, 2005.
- Nickl NJ: Gastrointestinal stromal tumors: new progress, new questions. Curr Opin Gastroenterol 20 (5): 482-7, 2004.
- Vander Noot MR, Eloubeidi MA, Chen VK, et al.: Diagnosis of gastrointestinal tract lesions by endoscopic ultrasound-guided fine-needle aspiration biopsy. Cancer 102 (3): 157-63, 2004.
- Joensuu H: Gastrointestinal stromal tumor (GIST). Ann Oncol 17 (Suppl 10): x280-6, 2006.
- Miettinen M, Sobin LH, Lasota J: Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 29 (1): 52-68, 2005.
- Miettinen M, Makhlouf H, Sobin LH, et al.: Gastrointestinal stromal tumors of the jejunum and ileum: a clinicopathologic, immunohistochemical, and molecular genetic study of 906 cases before imatinib with long-term follow-up. Am J Surg Pathol 30 (4): 477-89, 2006.
- Miettinen M, Kopczynski J, Makhlouf HR, et al.: Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the duodenum: a clinicopathologic, immunohistochemical, and molecular genetic study of 167 cases. Am J Surg Pathol 27 (5): 625-41, 2003.
- Miettinen M, Furlong M, Sarlomo-Rikala M, et al.: Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the rectum and anus: a clinicopathologic, immunohistochemical, and molecular genetic study of 144 cases. Am J Surg Pathol 25 (9): 1121-33, 2001.
- Miettinen M, Lasota J: Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol 23 (2): 70-83, 2006.
- Hohenberger P, Ronellenfitsch U, Oladeji O, et al.: Pattern of recurrence in patients with ruptured primary gastrointestinal stromal tumour. Br J Surg 97 (12): 1854-9, 2010.
- Hølmebakk T, Bjerkehagen B, Boye K, et al.: Definition and clinical significance of tumour rupture in gastrointestinal stromal tumours of the small intestine. Br J Surg 103 (6): 684-691, 2016.
- Joensuu H: Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol 39 (10): 1411-9, 2008.
- Chun HJ, Byun JY, Chun KA, et al.: Gastrointestinal leiomyoma and leiomyosarcoma: CT differentiation. J Comput Assist Tomogr 22 (1): 69-74, 1998 Jan-Feb.
- Levy AD, Remotti HE, Thompson WM, et al.: Gastrointestinal stromal tumors: radiologic features with pathologic correlation. Radiographics 23 (2): 283-304, 456; quiz 532, 2003 Mar-Apr.
- Ghanem N, Altehoefer C, Furtwängler A, et al.: Computed tomography in gastrointestinal stromal tumors. Eur Radiol 13 (7): 1669-78, 2003.
- Burkill GJ, Badran M, Al-Muderis O, et al.: Malignant gastrointestinal stromal tumor: distribution, imaging features, and pattern of metastatic spread. Radiology 226 (2): 527-32, 2003.
- Laurini JA, et al.: Protocol For the Examination of Resection Specimens From Patients With Gastrointestinal Stromal Tumor (GIST) Version 4.2.0.0. College of American Pathologists, 2021.
Available online . Last accessed December 13, 2024. - Demetri GD, Benjamin RS, Blanke CD, et al.: NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 5 (Suppl 2): S1-29; quiz S30, 2007.
- Casali PG, Jost L, Reichardt P, et al.: Gastrointestinal stromal tumors: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 19 (Suppl 2): ii35-8, 2008.
Clasificación celular y molecular de los tumores de estroma gastrointestinal
Los tumores de estroma gastrointestinal (GIST) surgen en células intersticiales de Cajal (CIC) o en sus precursores similares a células madre.[
Los GIST se componen de células fusiformes (70 %), células epitelioides (20 %) o células fusiformes y epitelioides mezcladas (10 %).[
Alrededor del 85 % de los GIST contienen variantes oncogénicas en 1 de los 2 receptores tirosina–cinasa (RTK):[
- KIT.
- PDGFRA.
La activación constitutiva de cualquiera de estos RTK desempeña una función central en la patogénesis de los GIST.[
Cerca del 95 % de los GIST expresan el antígeno CD117, un epítopo de KIT RTK que expresan las CIC.[
Los subtipos de GIST son los siguientes:
- GIST con variantes de KIT. Aproximadamente el 80 % de todos los GIST contienen una variante del gen KIT que produce una activación constitutiva.[
10 ] El gen KIT se encuentra en 4q12-13, en la vecindad de genes que codifican el RTK PDGFRA y el RTK receptor 2 del factor de crecimiento endotelial vascular (VEGFR2).[19 ] En el caso de los GIST, se observaron variantes en 5 exones diferentes de KIT: exón 11 (67 %), exón 9 (10 %) y exones 8, 13 y 17 (3 %).[10 ,20 ] Por lo general, los GIST son heterocigotos para una variante específica, pero la pérdida del alelo natural restante de KIT se presenta en alrededor del 8 % al 15 % de los tumores y a veces se relaciona con la progresión maligna.[20 ,21 ,22 ] Las variantes de KIT presentan distribuciones anatómicas diferenciadas: exón 8 (intestino delgado), exón 9 (intestino delgado y colon) y exones 11, 13 y 17 (todos los sitios).[10 ] Los tumores que tienen una variante de KIT expresan la proteína cinasa C θ (PKCθ) y DOG1, una característica distintiva de los tumores mesenquimatosos.[17 ,18 ,23 ] - GIST con variantes de PDGFRA. Cerca del 5 % al 8 % de los GIST hospedan una variante de PDGFRA, un elemento homólogo cercano a KIT con similares dominios extracelulares y citoplasmáticos.[
12 ] Los GIST con variante de PDGFRA pueden diferir de los GIST con variante de KIT de varias maneras, incluso una predilección marcada por el estómago, características morfológicas epitelioides, estroma mixoide, pleomorfismo nuclear y expresión variable de CD117.[23 ,24 ,25 ,26 ,27 ,28 ] Del mismo modo que un GIST con variantes de KIT, los tumores con variantes de PDGFRA expresan la PKCθ y DOG1.[17 ,18 ,24 ] La variante de PDGFRA se presenta con mayor frecuencia en el exón 18 (80–90 %) y es una variante en D842V (62 %) o fuera de D842V (27 %). Las variantes PDGFRA D842V confieren resistencia a la terapia con imatinib.[29 ] - GIST negativo para KIT. En alrededor del 5 % de los GIST, el resultado del estudio inmunohistoquímico (IHQ) para CD117 es completamente negativo o dudoso. En estos casos, es posible que el estudio IHQ carezca de sensibilidad suficiente como para detectar pequeñas cantidades de una variante de cinasa .[
10 ] Cerca del 30 % de estos tumores hospedan variantes patogénicas del gen PDGFRA, mientras que más de la mitad tienen variantes de KIT.[10 ,24 ,25 ,28 ] - GIST con KIT o PDGFRA de tipo natural. Los llamados GIST de tipo natural comprenden cerca del 12 % al 15 % de todos los GIST. En estos tumores, no se han identificado variantes de KIT o PDGFRA detectables. Muchos de estos tumores tienen deficiencia de SDH o están relacionados con NF1.
- Los GIST con deficiencia de SDH se caracterizan por la pérdida de función de una o más enzimas dentro de la familia SDH (SDHA–D, denominadas colectivamente SDHx), ya sea por una variante, como en el síndrome de Carney-Stratakis, o por inactivación epigenética, como en la tríada de Carney (GIST epitelioides gástricos, paraganglioma extrarrenal y condroma pulmonar). Los GIST con deficiencia de SDH se identifican mediante el estudio IHQ por la ausencia de SDHB. Los GIST con deficiencia de SDH suelen encontrarse en pacientes más jóvenes, por lo general, son multifocales y se presentan en el estómago. También suelen tener una evolución poco activa y responden de manera precaria a la terapia con inhibidores de tirosina–cinasas.[
13 ,14 ,15 ,30 ] - Los GIST relacionados con la NF1 tienen propensión a ser multicéntricos dentro del aparato digestivo y exhiben morfología de células fusiformes. Por lo general, expresan el antígeno CD117, pero no hospedan variantes de KIT ni PDGFRA.[
13 ] El curso clínico suele ser de bajo grado de malignidad. - Otras variantes observadas en los GIST con KIT o PDGFRA de tipo natural incluyen BRAF V600E [
31 ,32 ] y variantes de NTRK.[33 ]
- Los GIST con deficiencia de SDH se caracterizan por la pérdida de función de una o más enzimas dentro de la familia SDH (SDHA–D, denominadas colectivamente SDHx), ya sea por una variante, como en el síndrome de Carney-Stratakis, o por inactivación epigenética, como en la tríada de Carney (GIST epitelioides gástricos, paraganglioma extrarrenal y condroma pulmonar). Los GIST con deficiencia de SDH se identifican mediante el estudio IHQ por la ausencia de SDHB. Los GIST con deficiencia de SDH suelen encontrarse en pacientes más jóvenes, por lo general, son multifocales y se presentan en el estómago. También suelen tener una evolución poco activa y responden de manera precaria a la terapia con inhibidores de tirosina–cinasas.[
- GIST familiar. Se identificaron alrededor de dos docenas de grupos familiares con variantes hereditarias de KIT o PDGFRA. La penetrancia en esos grupos es alta y los miembros más afectados presentan uno o más GIST en la edad madura; sin embargo, en muchos pacientes, los tumores siguen un curso benigno.[
10 ]
Referencias:
- Hirota S, Isozaki K, Moriyama Y, et al.: Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 279 (5350): 577-80, 1998.
- Kindblom LG, Remotti HE, Aldenborg F, et al.: Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 152 (5): 1259-69, 1998.
- Wang L, Vargas H, French SW: Cellular origin of gastrointestinal stromal tumors: a study of 27 cases. Arch Pathol Lab Med 124 (10): 1471-5, 2000.
- Sircar K, Hewlett BR, Huizinga JD, et al.: Interstitial cells of Cajal as precursors of gastrointestinal stromal tumors. Am J Surg Pathol 23 (4): 377-89, 1999.
- Maeda H, Yamagata A, Nishikawa S, et al.: Requirement of c-kit for development of intestinal pacemaker system. Development 116 (2): 369-75, 1992.
- Huizinga JD, Thuneberg L, Klüppel M, et al.: W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity. Nature 373 (6512): 347-9, 1995.
- Torihashi S, Nishi K, Tokutomi Y, et al.: Blockade of kit signaling induces transdifferentiation of interstitial cells of cajal to a smooth muscle phenotype. Gastroenterology 117 (1): 140-8, 1999.
- Corless CL, Fletcher JA, Heinrich MC: Biology of gastrointestinal stromal tumors. J Clin Oncol 22 (18): 3813-25, 2004.
- Gastrointestinal stromal tumor. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 523–9.
- Corless CL, Heinrich MC: Molecular pathobiology of gastrointestinal stromal sarcomas. Annu Rev Pathol 3: 557-86, 2008.
- Miettinen M, Lasota J: Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 130 (10): 1466-78, 2006.
- Heinrich MC, Corless CL, Duensing A, et al.: PDGFRA activating mutations in gastrointestinal stromal tumors. Science 299 (5607): 708-10, 2003.
- Andersson J, Sihto H, Meis-Kindblom JM, et al.: NF1-associated gastrointestinal stromal tumors have unique clinical, phenotypic, and genotypic characteristics. Am J Surg Pathol 29 (9): 1170-6, 2005.
- Agaimy A, Pelz AF, Corless CL, et al.: Epithelioid gastric stromal tumours of the antrum in young females with the Carney triad: a report of three new cases with mutational analysis and comparative genomic hybridization. Oncol Rep 18 (1): 9-15, 2007.
- Carney JA: Gastric stromal sarcoma, pulmonary chondroma, and extra-adrenal paraganglioma (Carney Triad): natural history, adrenocortical component, and possible familial occurrence. Mayo Clin Proc 74 (6): 543-52, 1999.
- Blay P, Astudillo A, Buesa JM, et al.: Protein kinase C theta is highly expressed in gastrointestinal stromal tumors but not in other mesenchymal neoplasias. Clin Cancer Res 10 (12 Pt 1): 4089-95, 2004.
- Duensing A, Joseph NE, Medeiros F, et al.: Protein Kinase C theta (PKCtheta) expression and constitutive activation in gastrointestinal stromal tumors (GISTs). Cancer Res 64 (15): 5127-31, 2004.
- West RB, Corless CL, Chen X, et al.: The novel marker, DOG1, is expressed ubiquitously in gastrointestinal stromal tumors irrespective of KIT or PDGFRA mutation status. Am J Pathol 165 (1): 107-13, 2004.
- Stenman G, Eriksson A, Claesson-Welsh L: Human PDGFA receptor gene maps to the same region on chromosome 4 as the KIT oncogene. Genes Chromosomes Cancer 1 (2): 155-8, 1989.
- Heinrich MC, Corless CL, Demetri GD, et al.: Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol 21 (23): 4342-9, 2003.
- O'Riain C, Corless CL, Heinrich MC, et al.: Gastrointestinal stromal tumors: insights from a new familial GIST kindred with unusual genetic and pathologic features. Am J Surg Pathol 29 (12): 1680-3, 2005.
- Antonescu CR, Besmer P, Guo T, et al.: Acquired resistance to imatinib in gastrointestinal stromal tumor occurs through secondary gene mutation. Clin Cancer Res 11 (11): 4182-90, 2005.
- Wasag B, Debiec-Rychter M, Pauwels P, et al.: Differential expression of KIT/PDGFRA mutant isoforms in epithelioid and mixed variants of gastrointestinal stromal tumors depends predominantly on the tumor site. Mod Pathol 17 (8): 889-94, 2004.
- Debiec-Rychter M, Wasag B, Stul M, et al.: Gastrointestinal stromal tumours (GISTs) negative for KIT (CD117 antigen) immunoreactivity. J Pathol 202 (4): 430-8, 2004.
- Medeiros F, Corless CL, Duensing A, et al.: KIT-negative gastrointestinal stromal tumors: proof of concept and therapeutic implications. Am J Surg Pathol 28 (7): 889-94, 2004.
- Sakurai S, Hasegawa T, Sakuma Y, et al.: Myxoid epithelioid gastrointestinal stromal tumor (GIST) with mast cell infiltrations: a subtype of GIST with mutations of platelet-derived growth factor receptor alpha gene. Hum Pathol 35 (10): 1223-30, 2004.
- Wardelmann E, Hrychyk A, Merkelbach-Bruse S, et al.: Association of platelet-derived growth factor receptor alpha mutations with gastric primary site and epithelioid or mixed cell morphology in gastrointestinal stromal tumors. J Mol Diagn 6 (3): 197-204, 2004.
- Pauls K, Merkelbach-Bruse S, Thal D, et al.: PDGFRalpha- and c-kit-mutated gastrointestinal stromal tumours (GISTs) are characterized by distinctive histological and immunohistochemical features. Histopathology 46 (2): 166-75, 2005.
- Corless CL, Schroeder A, Griffith D, et al.: PDGFRA mutations in gastrointestinal stromal tumors: frequency, spectrum and in vitro sensitivity to imatinib. J Clin Oncol 23 (23): 5357-64, 2005.
- Boikos SA, Pappo AS, Killian JK, et al.: Molecular Subtypes of KIT/PDGFRA Wild-Type Gastrointestinal Stromal Tumors: A Report From the National Institutes of Health Gastrointestinal Stromal Tumor Clinic. JAMA Oncol 2 (7): 922-8, 2016.
- Agaram NP, Wong GC, Guo T, et al.: Novel V600E BRAF mutations in imatinib-naive and imatinib-resistant gastrointestinal stromal tumors. Genes Chromosomes Cancer 47 (10): 853-9, 2008.
- Hostein I, Faur N, Primois C, et al.: BRAF mutation status in gastrointestinal stromal tumors. Am J Clin Pathol 133 (1): 141-8, 2010.
- Atiq MA, Davis JL, Hornick JL, et al.: Mesenchymal tumors of the gastrointestinal tract with NTRK rearrangements: a clinicopathological, immunophenotypic, and molecular study of eight cases, emphasizing their distinction from gastrointestinal stromal tumor (GIST). Mod Pathol 34 (1): 95-103, 2021.
Información sobre los estadios de los tumores de estroma gastrointestinal
En el American Joint Committee on Cancer (AJCC) Staging Manual se incluye un sistema de estadificación formal para los tumores de estroma gastrointestinal (GIST). No obstante, en la práctica, la estadificación del AJCC no se aplica de forma sistemática cuando la evaluación del riesgo se determina según las características clínicas que se indican en la sección
Referencias:
- Gastrointestinal stromal tumor. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 523–9.
Aspectos generales de las opciones de tratamiento de los tumores de estroma gastrointestinal
El tratamiento de los pacientes con tumores de estroma gastrointestinal (GIST) exige un esfuerzo multidisciplinario que implica una estrecha colaboración entre patólogos, oncólogos médicos, cirujanos y expertos en imaginología.[
Cirugía
La resección quirúrgica es la modalidad de tratamiento principal para los siguientes tipos de pacientes:[
- Aquellos con GIST primarios en quienes no se comprueba metástasis.
- Los que presentan tumores que son técnicamente resecables (por ejemplo, GIST que no requieren una gastrectomía, pancreatectomía u otra resección de órganos importantes propiamente dichas) si los riesgos de morbilidad son aceptables.
La vigilancia endoscópica es una opción para los pacientes con tumores de 2 cm o menos con un índice mitótico de 5 o menos por 50 campos de gran aumento. Las bajas tasas de progresión y metástasis en estos tumores hacen viable la vigilancia endoscópica en lugar de la resección quirúrgica.[
La meta del tratamiento quirúrgico es la resección macroscópica completa, con una pseudocápsula intacta y márgenes microscópicos negativos para compromiso tumoral.[
Si es viable desde el punto de vista anatómico, cada vez se realiza más cirugía laparoscópica en lugar de laparotomía. Los informes demuestran tasas más bajas de recidiva, hospitalizaciones más breves y menor morbilidad.[
La terapia neoadyuvante con imatinib se administra a pacientes con GIST grandes o de difícil acceso que se consideran marginalmente resecables. A menudo se observa una contracción tumoral significativa con la terapia dirigida, por lo que es posible que este abordaje evite una resección de un órgano importante o permita una cirugía con conservación de órganos. Es posible considerar la secuenciación genética para identificar variantes de sensibilidad o de resistencia antes de la terapia neoadyuvante con imatinib.
Para los pacientes con recidivas oligometastáticas (por ejemplo, implantes intraabdominales aislados o lesiones hepáticas solitarias), la resección quirúrgica se puede usar junto con inhibidores de tirosina–cinasas (ITC).[
Quimioterapia
Existe un acuerdo a nivel mundial acerca de que la quimioterapia estándar no tiene ninguna función en el tratamiento primario de los GIST.[
Antes del advenimiento de la terapia molecular dirigida con ITC, los esfuerzos para tratar los GIST con quimioterapia citotóxica convencional fueron en esencia inútiles.[
Terapia con inhibidores de tirosina–cinasas
Los inhibidores de tirosina–cinasas (ITC) inhiben los receptores tirosina–cinasa KIT o PDGFRA que funcionan de forma anómala y de esta manera causan una reducción rápida del crecimiento tumoral. El tratamiento con ITC se indica para pacientes con GIST irresecables, de resecabilidad limítrofe, metastásicos o recidivantes. También se indica como terapia adyuvante para los pacientes con GIST con riesgo alto de recidiva.
El ITC mesilato de imatinib se usa como terapia de primera línea para la mayoría de los pacientes con GIST con variante de KIT y PDGFRA.[
Por lo general, el imatinib no se administra a los pacientes con GIST con KIT o PDGFRA de tipo natural (es decir, GIST con deficiencia de SDH o relacionados con la neurofibromatosis de tipo 1 [NF1]) debido a las tasas altas de resistencia. Es posible que otros ITC (es decir, sunitinib o regorafenib) tengan alguna actividad, pero se recomienda a la mayoría de los pacientes que consideren inscribirse en ensayos clínicos, si son aptos.
Para obtener más información sobre la eficacia, la inocuidad y el tratamiento de la toxicidad del imatinib, o de otros fármacos en el entorno de la resistencia o intolerancia al imatinib, consultar las secciones
Radioterapia
Con poca frecuencia, la radioterapia tiene alguna función en el tratamiento de los pacientes con GIST. En ocasiones, se usa para paliar las metástasis dolorosas o en pacientes con tumores sangrantes irresecables.[
Referencias:
- Casali PG, Dei Tos AP, Gronchi A: Gastrointestinal stromal tumor. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. 11th ed. Wolters Kluwer, 2019, pp 895-906.
- Judson I, Demetri G: Advances in the treatment of gastrointestinal stromal tumours. Ann Oncol 18 (Suppl 10): x20-4, 2007.
- Miettinen M, Sobin LH, Lasota J: Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 29 (1): 52-68, 2005.
- Demetri GD, Benjamin RS, Blanke CD, et al.: NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 5 (Suppl 2): S1-29; quiz S30, 2007.
- Huguet KL, Rush RM, Tessier DJ, et al.: Laparoscopic gastric gastrointestinal stromal tumor resection: the mayo clinic experience. Arch Surg 143 (6): 587-90; discussion 591, 2008.
- Otani Y, Furukawa T, Yoshida M, et al.: Operative indications for relatively small (2-5 cm) gastrointestinal stromal tumor of the stomach based on analysis of 60 operated cases. Surgery 139 (4): 484-92, 2006.
- Novitsky YW, Kercher KW, Sing RF, et al.: Long-term outcomes of laparoscopic resection of gastric gastrointestinal stromal tumors. Ann Surg 243 (6): 738-45; discussion 745-7, 2006.
- Chen K, Zhou YC, Mou YP, et al.: Systematic review and meta-analysis of safety and efficacy of laparoscopic resection for gastrointestinal stromal tumors of the stomach. Surg Endosc 29 (2): 355-67, 2015.
- Kanda T, Masuzawa T, Hirai T, et al.: Surgery and imatinib therapy for liver oligometastasis of GIST: a study of Japanese Study Group on GIST. Jpn J Clin Oncol 47 (4): 369-372, 2017.
- Pawlik TM, Vauthey JN, Abdalla EK, et al.: Results of a single-center experience with resection and ablation for sarcoma metastatic to the liver. Arch Surg 141 (6): 537-43; discussion 543-4, 2006.
- Demetri GD, von Mehren M, Blanke CD, et al.: Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 347 (7): 472-80, 2002.
- Edmonson JH, Marks RS, Buckner JC, et al.: Contrast of response to dacarbazine, mitomycin, doxorubicin, and cisplatin (DMAP) plus GM-CSF between patients with advanced malignant gastrointestinal stromal tumors and patients with other advanced leiomyosarcomas. Cancer Invest 20 (5-6): 605-12, 2002.
- Plaat BE, Hollema H, Molenaar WM, et al.: Soft tissue leiomyosarcomas and malignant gastrointestinal stromal tumors: differences in clinical outcome and expression of multidrug resistance proteins. J Clin Oncol 18 (18): 3211-20, 2000.
- Blanke CD, Demetri GD, von Mehren M, et al.: Long-term results from a randomized phase II trial of standard- versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT. J Clin Oncol 26 (4): 620-5, 2008.
- Heinrich MC, Jones RL, von Mehren M, et al.: Avapritinib in advanced PDGFRA D842V-mutant gastrointestinal stromal tumour (NAVIGATOR): a multicentre, open-label, phase 1 trial. Lancet Oncol 21 (7): 935-946, 2020.
Tratamiento de los tumores de estroma gastrointestinal primarios resecables
Opciones de tratamiento para los tumores de estroma gastrointestinal primarios resecables
Las opciones de tratamiento para los tumores de estroma gastrointestinal primarios resecables son las siguientes:
-
Cirugía. -
Terapia posoperatoria con inhibidor de tirosina–cinasas (ITC) adyuvante. -
Imatinib .
-
Cirugía
Por lo general, los GIST que miden 2 cm o más se resecan mediante cirugía, mientras que el tratamiento de los GIST que se encuentran de manera casual y miden menos de 2 cm continúa siendo controvertido. No hay evidencia de que los pacientes se deban someter a una nueva escisión en casos en los que se logra una resección completa de toda la enfermedad macroscópica, pero en los que se observan márgenes positivos al microscopio. Es posible que la conducta expectante y la terapia adyuvante con imatinib sean apropiadas para estos pacientes.[
En general, es posible extirpar los GIST gástricos mediante resección en cuña laparoscópica, cuando sea viable desde el punto de vista técnico. Dado que los GIST afectan con poca frecuencia los ganglios linfáticos locorregionales, no se indica la disección de ganglios linfáticos a menos que haya compromiso ganglionar puesto de manifiesto clínicamente. Como estos tumores pueden tener pseudocápsulas frágiles, se debe tener cuidado para evitar la ruptura de la pseudocápsula durante la cirugía, lo que podría resultar en una diseminación peritoneal.
Terapia posoperatoria con ITC adyuvante
Imatinib
Los resultados de 3 estudios de fase III respaldan el uso de imatinib adyuvante postoperatorio para pacientes con GIST localizados totalmente resecados que presentan un riesgo alto de recidiva en función del tamaño del tumor, la localización tumoral, el índice mitótico y la presencia de rotura tumoral. [
Evidencia (estudios de fase III de imatinib posoperatorio):
- El ACOSOG Z9001 (NCT00041197) fue un ensayo aleatorizado de fase III con enmascaramiento doble y controlado con placebo de 713 pacientes con un GIST con variante de KIT completamente resecado que medía, al menos, 3 cm. Los pacientes se asignaron de manera aleatoria para recibir 400 mg de imatinib diarios (n = 359) o un placebo (n = 354) durante 1 año después de la resección quirúrgica.[
4 ]- Al cabo de una mediana de seguimiento de 19,7 meses, se presentó recidiva de la enfermedad o muerte en 30 pacientes (8,4 %) en el grupo de imatinib y 70 pacientes (19,8 %) en el grupo de placebo.
- La tasa de supervivencia sin recidiva (SSR) a 1 año fue del 98 % en los pacientes que recibieron imatinib (intervalo de confianza [IC] 95 %, 96–100 %) y del 83 % (IC 95 %, 78–88 %) en los pacientes que recibieron placebo (cociente de riesgos instantáneos [CRI], 0,35; IC 95 %, 0,22–0,53; P < 0,0001).[
4 ][Nivel de evidencia B1] No se observó ninguna diferencia en la supervivencia general (SG) (CRI, 0,66; IC 95 %, 0,22–2,03; P = 0,4714). - Se redujo o interrumpió la dosis debido a efectos adversos en el 14,5 % de los pacientes del grupo de imatinib y en el 2,8 % de los pacientes del grupo de placebo. Se presentaron eventos de grado 3 o 4 en el 30,9 % de los pacientes del grupo de imatinib y en el 18,3 % de los pacientes del grupo de placebo.
- El EORTC-62024 (NCT00103168) fue un ensayo sin anonimato de fase III de 908 pacientes que presentaban GIST con variante de KIT completamente resecados (margen R0 o R1) con riesgo intermedio o alto de recidiva. Los pacientes se asignaron de manera aleatoria para recibir 400 mg de imatinib diarios (n = 454) o se sometieron a observación (n = 454) durante 2 años.[
10 ]- Al cabo de una mediana de seguimiento de 4,7 años, las tasas de SSR mejoraron en los pacientes que recibieron imatinib, en comparación con los pacientes que se sometieron a observación a los 3 años (84 vs. 66 %) y 5 años (69 vs. 63 %) (orden logarítmico P < 0,001).[
10 ] [Nivel de evidencia B1] La tasa de SG a 5 años no difirió entre el grupo de imatinib y el grupo de observación (91,8 vs. 92,7 %). - La tasa de supervivencia sin fracaso terapéutico (desde el día de aleatorización hasta el inicio de un tratamiento sistémico nuevo o muerte) a 5 años del imatinib fue del 87 % en el grupo de imatinib y del 84 % en el grupo de observación (CRI, 0,79; IC 98,5 %, 0,50–1,25; P = 0,21).[
10 ][Nivel de evidencia B1] - En un análisis final al cabo de una mediana de seguimiento de 9,1 años, se observaron tasas de SSR del 70 % y 63 % a los 5 y 10 años, respectivamente, para los pacientes del grupo de imatinib, y tasas del 63 % y 61 % a los 5 y 10 años, respectivamente, para los pacientes del grupo de observación (CRI, 0,71; IC 95 %, 0,57–0,89; P = 0,002). No hubo ninguna diferencia en la SG entre los pacientes que recibieron imatinib y los pacientes que se sometieron a observación (93 vs. 92 % a los 5 años, 80 vs. 78 % a los 10 años; CRI, 0,88; IC 95 %, 0,65–1,21; P = 0, 43).[
9 ][Niveles de evidencia B1 y A1]
- Al cabo de una mediana de seguimiento de 4,7 años, las tasas de SSR mejoraron en los pacientes que recibieron imatinib, en comparación con los pacientes que se sometieron a observación a los 3 años (84 vs. 66 %) y 5 años (69 vs. 63 %) (orden logarítmico P < 0,001).[
- El SSG XVIII (NCT00116935) fue un ensayo sin anonimato de fase III de 400 pacientes con GIST de riesgo alto y resecados por completo. Los pacientes se asignaron de manera aleatoria para recibir 400 mg de imatinib diarios durante 1 año (n = 200) o 3 años (n = 200) después de la resección.[
5 ]- Después de una mediana de seguimiento de 54 meses, la tasa de SSR fue del 65,6 % en el grupo de 3 años y del 47,9 % en el grupo de 1 año (CRI, 0,46; IC 95 %, 0,32–0,65; P < 0,001).[
5 ][Nivel de evidencia B1] - La tasa de SG a 5 años fue del 92 % en el grupo de 3 años y del 81,7 % en el grupo de 1 año (CRI, 0,45; IC 95 %, 0,22–0,89; P = 0,02).[
5 ] - Aunque por lo general se toleraron bien en ambos grupos, los eventos de grado 3 o 4 se presentaron en el 32,8 % de los pacientes del grupo de 3 años y en el 20,1 % de los pacientes del grupo de 1 año. La interrupción del tratamiento se produjo en el 25,8 % de los pacientes del grupo de 3 años y en el 12,6 % de los pacientes del grupo de 1 año.
- En un análisis exploratorio a posteriori, se indicó que los pacientes con GIST con variante en el exón 11 de KIT obtuvieron un mayor beneficio de una duración más prolongada de la administración del imatinib (SSR a 5 años, 71,0 vs. 41,3 %; P < 0,001).[
6 ]
- Después de una mediana de seguimiento de 54 meses, la tasa de SSR fue del 65,6 % en el grupo de 3 años y del 47,9 % en el grupo de 1 año (CRI, 0,46; IC 95 %, 0,32–0,65; P < 0,001).[
Se desconoce la duración recomendada del tratamiento adyuvante; sin embargo, a partir de los resultados del estudio SSG XVIII, en la práctica, por lo general, se administra la terapia durante 3 años. Es importante señalar que la evidencia indica que el imatinib tal vez suprima el crecimiento de GIST, en lugar de ser citotóxico. Por lo tanto, es posible retrasar la recidiva al suprimir la enfermedad metastásica indetectable.[
La mayoría de los pacientes inician la terapia con imatinib a una dosis de 400 mg por día. Se recomienda la genotipificación molecular de los pacientes con GIST, ya que puede afectar el uso de imatinib adyuvante, así como la dosis óptima. Los pacientes cuyo tumor hospeda una variante en el exón 9 de KIT tal vez se beneficien de dosis más altas de imatinib (800 mg por día) según los datos del entorno metastásico.[
Aunque no es totalmente concluyente, hay alguna evidencia de fase II que respalda la continuación de la terapia con imatinib durante 5 años o más.
Evidencia (estudios de fase II de imatinib posoperatorio):
- El PERSIST-5 (NCT00867113) fue un ensayo de fase II de un solo grupo de 91 pacientes con GIST de riesgo alto completamente resecados. Los pacientes recibieron imatinib (400 mg diarios) hasta por 5 años.[
15 ][Nivel de evidencia C1]- La mediana de duración del tratamiento fue de 55,1 meses, pero con un intervalo amplio (0,5–60,6 meses). Solo 46 pacientes (51 %) completaron los 5 años de tratamiento. Por lo tanto, el 49 % de los pacientes suspendieron el tratamiento temprano debido a la elección del paciente (21 %), los efectos adversos (16 %) u otros motivos (12 %).
- Al cabo de una mediana de seguimiento de 19,6 meses, la tasa estimada de SSR a 5 años fue del 90 % (IC 95 %, 80–95 %). La tasa de SG fue del 95 % (IC 95 %, 86–99 %). De los pacientes, 7 (7,6 %) presentaron recidiva, 6 de las cuales se presentaron después de la interrupción del tratamiento.
- En un análisis retrospectivo pequeño de una sola institución se incluyó a 234 pacientes con GIST resecados con R0 con riesgo de moderado a alto de recidiva. En el estudio se evaluó el efecto de la duración diferente del imatinib posoperatorio en las tasas de SSR y SG a 5 años.[
13 ][Nivel de evidencia C1]- Al cabo de una mediana de seguimiento de 54 meses, la tasa de SSR a 5 años en todos los grupos fue del 76,2 %. La tasa de SG en todos los grupos fue del 83,4 %.
- En los pacientes de riesgo alto, la mayor duración de la terapia con imatinib se relacionó con tasas más altas de SSR (36,5 % en el grupo de 1 año, 68,7 % en el grupo de 1–3 años, 71,2 % en el grupo de 3–5 años y 90,8 % en el grupo de >5 años; P < 0,001). La duración más prolongada de la terapia con imatinib también se relacionó con tasas más altas de SG (36,7 % en el grupo de 1 año, 76,6 % en el grupo de 1–3 años, 84,0 % en el grupo de 3–5 años y 97,4 % en el grupo de >5 años; P < 0,001).
Ensayos clínicos en curso
Realizar una
Referencias:
- Demetri GD, Benjamin RS, Blanke CD, et al.: NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 5 (Suppl 2): S1-29; quiz S30, 2007.
- Otani Y, Furukawa T, Yoshida M, et al.: Operative indications for relatively small (2-5 cm) gastrointestinal stromal tumor of the stomach based on analysis of 60 operated cases. Surgery 139 (4): 484-92, 2006.
- DeMatteo RP, Owzar K, Antonescu CR, et al.: Efficacy of adjuvant imatinib mesylate following complete resection of localized, primary gastrointestinal stromal tumor (GIST) at high risk of recurrence: the U.S. Intergroup phase II trial ACOSOG Z9000. [Abstract] American Society of Clinical Oncology 2008 Gastrointestinal Cancers Symposium, 25-27 January 2008, Orlando, FL. A-8, 2008.
- Dematteo RP, Ballman KV, Antonescu CR, et al.: Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet 373 (9669): 1097-104, 2009.
- Joensuu H, Eriksson M, Sundby Hall K, et al.: One vs three years of adjuvant imatinib for operable gastrointestinal stromal tumor: a randomized trial. JAMA 307 (12): 1265-72, 2012.
- Joensuu H, Wardelmann E, Sihto H, et al.: Effect of KIT and PDGFRA Mutations on Survival in Patients With Gastrointestinal Stromal Tumors Treated With Adjuvant Imatinib: An Exploratory Analysis of a Randomized Clinical Trial. JAMA Oncol 3 (5): 602-609, 2017.
- Raut CP, Espat NJ, Maki RG, et al.: Extended treatment with adjuvant imatinib (IM) for patients (pts) with high-risk primary gastrointestinal stromal tumor (GIST): The PERSIST-5 study. [Abstract] J Clin Oncol 35 (Suppl 15): A-11009, 2017.
Also available online. Last accessed December 13, 2024. - DeMatteo RP, Ballman KV, Antonescu CR, et al.: Long-term results of adjuvant imatinib mesylate in localized, high-risk, primary gastrointestinal stromal tumor: ACOSOG Z9000 (Alliance) intergroup phase 2 trial. Ann Surg 258 (3): 422-9, 2013.
- Casali PG, Le Cesne A, Velasco AP, et al.: Final analysis of the randomized trial on imatinib as an adjuvant in localized gastrointestinal stromal tumors (GIST) from the EORTC Soft Tissue and Bone Sarcoma Group (STBSG), the Australasian Gastro-Intestinal Trials Group (AGITG), UNICANCER, French Sarcoma Group (FSG), Italian Sarcoma Group (ISG), and Spanish Group for Research on Sarcomas (GEIS)☆. Ann Oncol 32 (4): 533-541, 2021.
- Casali PG, Le Cesne A, Poveda Velasco A, et al.: Time to Definitive Failure to the First Tyrosine Kinase Inhibitor in Localized GI Stromal Tumors Treated With Imatinib As an Adjuvant: A European Organisation for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group Intergroup Randomized Trial in Collaboration With the Australasian Gastro-Intestinal Trials Group, UNICANCER, French Sarcoma Group, Italian Sarcoma Group, and Spanish Group for Research on Sarcomas. J Clin Oncol 33 (36): 4276-83, 2015.
- Joensuu H, Eriksson M, Sundby Hall K, et al.: Adjuvant Imatinib for High-Risk GI Stromal Tumor: Analysis of a Randomized Trial. J Clin Oncol 34 (3): 244-50, 2016.
- Blanke CD, DeMatteo RP: Duration of Adjuvant Therapy for Patients With Gastrointestinal Stromal Tumors: Where Is Goldilocks When We Need Her? JAMA Oncol 2 (6): 721-2, 2016.
- Lin JX, Chen QF, Zheng CH, et al.: Is 3-years duration of adjuvant imatinib mesylate treatment sufficient for patients with high-risk gastrointestinal stromal tumor? A study based on long-term follow-up. J Cancer Res Clin Oncol 143 (4): 727-734, 2017.
- Gastrointestinal Stromal Tumor Meta-Analysis Group (MetaGIST): Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumors: a meta-analysis of 1,640 patients. J Clin Oncol 28 (7): 1247-53, 2010.
- Raut CP, Espat NJ, Maki RG, et al.: Efficacy and Tolerability of 5-Year Adjuvant Imatinib Treatment for Patients With Resected Intermediate- or High-Risk Primary Gastrointestinal Stromal Tumor: The PERSIST-5 Clinical Trial. JAMA Oncol 4 (12): e184060, 2018.
Tratamiento de los tumores de estroma gastrointestinal primarios irresecables
Opciones de tratamiento para los tumores de estroma gastrointestinal primarios irresecables
Las opciones de tratamiento para los tumores de estroma gastrointestinal (GIST) primarios irresecables son las siguientes:
-
Terapia neoadyuvante con inhibidor de tirosina–cinasas (ITC). -
Imatinib .
-
Terapia neoadyuvante con ITC
Imatinib
Es posible usar imatinib neoadyuvante en pacientes con GIST primarios muy grandes o GIST pequeños mal posicionados (considerados irresecables sin riesgo de morbilidad significativa o déficit funcional, como la necesidad de una gastrectomía, pancreatectomía u otra resección de órganos importante propiamente dichas) hasta que la terapia quirúrgica sea viable; esto último puede demorar hasta 6 a 12 meses.[
Evidencia (estudios de fase II de imatinib neoadyuvante):
- El RTOG-0132/ACRIN-6665 (NCT00028002) fue un estudio de fase II de un solo grupo de 52 pacientes con GIST primarios (n = 30) o GIST metastásicos operables (n = 22). Los pacientes recibieron imatinib preoperatorio (600 mg diarios) durante 8 a 12 semanas, seguido de imatinib posoperatorio durante al menos 2 años.[
3 ][Nivel de evidencia C3]- Entre los pacientes con GIST primarios, un 83 % presentó enfermedad estable y un 7 % tuvo una respuesta parcial. Entre los pacientes con GIST metastásicos, un 91 % presentó enfermedad estable, un 4,5 % tuvo una respuesta parcial y un 4,5 % presentó progresión de la enfermedad.
- Al cabo de una mediana de seguimiento de 36 meses, la tasa de SSP a 2 años fue del 83 % en los pacientes con GIST primarios y del 77 % en los pacientes con GIST metastásicos. La tasa de SG fue del 93 % en los pacientes con GIST primarios y del 91 % en los pacientes con GIST metastásicos.
- El 77 % de los pacientes con GIST primarios y el 58 % de los pacientes con GIST metastásicos se sometieron a resecciones R0. De los pacientes, 5 (10 %) presentaron enfermedad irresecable.
- Por lo general, el imatinib se toleró bien, aunque el 35 % de los pacientes presentaron efectos adversos de grado 3 a 5. La mediana de duración preoperatoria del imatinib fue de 65 días y la mediana de tiempo de interrupción del imatinib antes de la cirugía fue de 2 días.
- En un estudio de fase II de un solo grupo realizado en Asia, participaron 53 pacientes evaluables con GIST gástricos de más de 10 cm. Los pacientes recibieron imatinib preoperatorio (400 mg diarios) durante 6 a 9 meses, seguidos de imatinib posoperatorio durante al menos 1 año.[
4 ][Nivel de evidencia C3]- De los pacientes, 46 (87 %) recibieron por lo menos 6 meses de imatinib preoperatorio y 50 pacientes se sometieron a gastrectomía en última instancia. La mediana de duración del imatinib preoperatorio fue de 26 semanas. Los efectos adversos de grado 3 a 4 más comunes fueron neutropenia y exantema.
- La tasa de respuesta objetiva fue del 62 % y la reducción máxima se presentó con mayor frecuencia a las 24 semanas (63 % de los pacientes). La tasa de resección R0 fue del 91 % en general, y al menos la mitad del estómago se conservó en el 79 % de los pacientes.
- Al cabo de una mediana de seguimiento de 32 meses, la tasa de SSP a 2 años fue del 89 % y la tasa de SG fue del 98 %.
Si se planea un ITC preoperatorio, se debe considerar una biopsia para confirmar el diagnóstico y, quizás, la caracterización molecular. Es posible que el análisis mutacional ayude a descartar las variantes no sensibles antes de iniciar la terapia de citorreducción con imatinib. La biopsia y el perfil molecular quizás también determinen si un tumor hospeda una variante en el exón 9 de KIT, que requiera un aumento de la dosis inicial de imatinib.[
Si se indica, el imatinib neoadyuvante se inicia a dosis de 400 mg por día en la mayoría de los pacientes. Es posible ofrecer a los pacientes con GIST con variante en el exón 9 de KIT una dosis más alta (800 mg por día) según los datos del entorno avanzado.[
Ensayos clínicos en curso
Realizar una
Referencias:
- Demetri GD, Benjamin RS, Blanke CD, et al.: NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 5 (Suppl 2): S1-29; quiz S30, 2007.
- Bonvalot S, Eldweny H, Péchoux CL, et al.: Impact of surgery on advanced gastrointestinal stromal tumors (GIST) in the imatinib era. Ann Surg Oncol 13 (12): 1596-603, 2006.
- Eisenberg BL, Harris J, Blanke CD, et al.: Phase II trial of neoadjuvant/adjuvant imatinib mesylate (IM) for advanced primary and metastatic/recurrent operable gastrointestinal stromal tumor (GIST): early results of RTOG 0132/ACRIN 6665. J Surg Oncol 99 (1): 42-7, 2009.
- Kurokawa Y, Yang HK, Cho H, et al.: Phase II study of neoadjuvant imatinib in large gastrointestinal stromal tumours of the stomach. Br J Cancer 117 (1): 25-32, 2017.
- Andtbacka RH, Ng CS, Scaife CL, et al.: Surgical resection of gastrointestinal stromal tumors after treatment with imatinib. Ann Surg Oncol 14 (1): 14-24, 2007.
- Katz D, Segal A, Alberton Y, et al.: Neoadjuvant imatinib for unresectable gastrointestinal stromal tumor. Anticancer Drugs 15 (6): 599-602, 2004.
- Raut CP, Posner M, Desai J, et al.: Surgical management of advanced gastrointestinal stromal tumors after treatment with targeted systemic therapy using kinase inhibitors. J Clin Oncol 24 (15): 2325-31, 2006.
- Scaife CL, Hunt KK, Patel SR, et al.: Is there a role for surgery in patients with "unresectable" cKIT+ gastrointestinal stromal tumors treated with imatinib mesylate? Am J Surg 186 (6): 665-9, 2003.
- Machlenkin S, Pinsk I, Tulchinsky H, et al.: The effect of neoadjuvant Imatinib therapy on outcome and survival after rectal gastrointestinal stromal tumour. Colorectal Dis 13 (10): 1110-5, 2011.
- Rutkowski P, Gronchi A, Hohenberger P, et al.: Neoadjuvant imatinib in locally advanced gastrointestinal stromal tumors (GIST): the EORTC STBSG experience. Ann Surg Oncol 20 (9): 2937-43, 2013.
- Cavnar MJ, Wang L, Balachandran VP, et al.: Rectal Gastrointestinal Stromal Tumor (GIST) in the Era of Imatinib: Organ Preservation and Improved Oncologic Outcome. Ann Surg Oncol 24 (13): 3972-3980, 2017.
- Tielen R, Verhoef C, van Coevorden F, et al.: Surgical management of rectal gastrointestinal stromal tumors. J Surg Oncol 107 (4): 320-3, 2013.
- Debiec-Rychter M, Sciot R, Le Cesne A, et al.: KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. Eur J Cancer 42 (8): 1093-103, 2006.
- Casali PG, Blay JY, Abecassis N, et al.: Gastrointestinal stromal tumours: ESMO-EURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 33 (1): 20-33, 2022.
- Gastrointestinal Stromal Tumor Meta-Analysis Group (MetaGIST): Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumors: a meta-analysis of 1,640 patients. J Clin Oncol 28 (7): 1247-53, 2010.
- Van den Abbeele AD, Gatsonis C, de Vries DJ, et al.: ACRIN 6665/RTOG 0132 phase II trial of neoadjuvant imatinib mesylate for operable malignant gastrointestinal stromal tumor: monitoring with 18F-FDG PET and correlation with genotype and GLUT4 expression. J Nucl Med 53 (4): 567-74, 2012.
Tratamiento de los tumores de estroma gastrointestinal metastásicos o recidivantes
Opciones de tratamiento para los tumores de estroma gastrointestinal metastásicos o recidivantes
Las opciones de tratamiento para los tumores de estroma gastrointestinal (GIST) metastásicos o recidivantes son las siguientes:
-
Terapia inicial con inhibidor de tirosina–cinasas (ITC) .Imatinib .
-
Terapia inicial con ITC para los GIST con variante PDGFRA D842 .Avapritinib .
-
Terapia con ITC para los GIST resistentes al imatinib .Sunitinib .Regorafenib .
-
Opciones adicionales de tratamiento con ITC .Ripretinib .Nilotinib .Sorafenib .Pazopanib .
-
Terapia ITC para los GIST con KIT/PDGFRA de tipo natural . -
Cirugía . -
Ensayos clínicos .
El tratamiento primario de los pacientes con GIST metastásicos o recidivantes incluye tratamiento médico con un inhibidor de tirosina–cinasas (ITC); en casos seleccionados, se agrega terapia quirúrgica. Los pacientes con tumores metastásicos o recidivantes que no responden a estas medidas tal vez sean aptos para participar en ensayos clínicos.
Terapia inicial con inhibidores de tirosina–cinasas
Imatinib
El tratamiento con imatinib es la terapia estándar de primera línea para la mayoría de los pacientes con enfermedad metastásica o recidivante. La dosis inicial es de 400 mg al día, excepto para los pacientes con tumores que contienen variantes en el exón 9 de KIT, que pueden recibir 800 mg al día.[
Todos los pacientes sometidos a terapia con ITC se vigilan muy de cerca para detectar la respuesta tumoral y los efectos secundarios que tal vez requieran reducir las dosis, interrumpir o cesar la terapia con ITC cuando la toxicidad sea persistente y excesiva. Además, es posible que sea necesario modificar la dosis del ITC o sustituirlo por otro que no afecte las concentraciones de la isoenzima 3A4 del citocromo P450 (CYP450 3A4) para los pacientes que tomen medicamentos que afectan las concentraciones de CYP450 3A4.[
La respuesta se evalúa mediante tomografía computarizada (TC), imágenes por resonancia magnética (IRM) o tomografía por emisión de positrones con flúor F 18-fludesoxiglucosa (TEP con 18F-FDG).[
Evidencia (terapia con imatinib):
- En un ensayo de fase III participaron 746 pacientes con GIST irresecables o metastásicos en estadio avanzado. Los pacientes se asignaron de manera aleatoria para recibir tratamiento de dosis más altas con 800 mg de imatinib diarios o 400 mg de imatinib diarios como terapia sistémica primaria.
- No se observaron diferencias estadísticamente significativas en las tasas de respuesta objetiva, la supervivencia sin progresión (SSP) ni la supervivencia general (SG) entre los pacientes que recibieron la dosis de 800 mg y los pacientes que recibieron la dosis de 400 mg.[
15 ][Niveles de evidencia A1; B1; y B3] - Entre los pacientes que progresaron a 400 mg diarios y luego recibieron 800 mg diarios, cerca de un tercio logró una respuesta objetiva o estabilización de la enfermedad.
- No se observaron diferencias estadísticamente significativas en las tasas de respuesta objetiva, la supervivencia sin progresión (SSP) ni la supervivencia general (SG) entre los pacientes que recibieron la dosis de 800 mg y los pacientes que recibieron la dosis de 400 mg.[
- Se observaron hallazgos similares en un estudio de la European Organisation for Research and Treatment of Cancer, Italian Sarcoma Group, and Australasian Gastro-Intestinal Trials Group (EORTC-ISG-AGITG) de 946 pacientes con GIST que se asignaron de manera aleatoria para recibir 400 mg o 800 mg de imatinib, con un cambio de tratamiento permitido en el momento de la progresión.[
16 ] - Ahora se reconoce que las variantes específicas de cinasas en KIT y PDGFRA afectan la sensibilidad o la respuesta al imatinib (por ejemplo, en el exón 11 se relaciona con sensibilidad al imatinib y en el exón 9 se relaciona con resistencia al imatinib).[
17 ,18 ,19 ,20 ,21 ] Además, en metanálisis de los 2 ensayos mencionados más arriba se demostró que los pacientes con variantes en el exón 9 de KIT tienen un beneficio significativo con dosis más altas de imatinib.[22 ]
En caso de progresión tumoral en pacientes sin variantes en el exón 9 de KIT con dosis más bajas de imatinib (es decir, 400 mg diarios), es posible aumentar la dosis de imatinib a 800 mg diarios (en dosis fraccionadas). Como alternativa, en el tratamiento de la resistencia al imatinib, se puede cambiar el tratamiento del paciente a sunitinib.[
Los efectos tóxicos más comunes relacionados con la terapia con imatinib, que quizás mejoren con el tratamiento prolongado, son los siguientes:[
- Retención de líquidos (en especial, edema periorbitario o edema periférico; en ocasiones, derrame pleural o ascitis).
- Diarrea.
- Náuseas (quizás disminuyan si el fármaco se toma con alimentos).
- Fatiga.
- Calambres musculares.
- Dolor abdominal.
- Exantema.
- Anemia leve (macrocítica).
- Hipofosfatemia.
Hay pocos informes sobre insuficiencia cardíaca relacionada con el uso de imatinib,[
Terapia inicial con inhibidor de tirosina–cinasas para los tumores de estroma gastrointestinal con variantePDGFRAD842V
Avapritinib
Los pacientes con un GIST que hospeda una variante D842V en el exón 18 de PDGFRA deben recibir avapritinib al inicio. Sin embargo, en los pacientes cuyos GIST son asintomáticos o de crecimiento lento, es razonable un período de observación para evitar los efectos tóxicos del tratamiento.
Evidencia (avapritinib en pacientes con una variante PDGFRA D842V):
- El NAVIGATOR (NCT02508532) fue un ensayo sin enmascaramiento de fase I de un solo grupo con 56 pacientes con una variante PDGFRA D842V. Los pacientes recibieron avapritinib a una dosis diaria de 300 mg o 400 mg[
2 ][Nivel de evidencia C3]- Se observó una respuesta general en 49 de 56 pacientes (88 %) (intervalo de confianza [IC] 95 %, 76–95 %); 5 pacientes (9 %) lograron una respuesta completa.
- La tasa de SSP a 1 año fue del 81 % (IC 95 %, 67–94 %) y la duración de la respuesta a 1 año fue del 70 % (IC 95 %, 54–87 %).
- En la mediana de seguimiento de 15,9 meses, la tasa estimada de SG a 1 año fue del 91 % y la tasa estimada de SG a 2 años fue del 81 %.
- Los resultados de tasa de respuesta general alta del ensayo NAVIGATOR llevaron a la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) a aprobar el avapritinib para los pacientes con GIST con una variante en el exón 18 de PDGFRA, incluso variantes D842V.
Evidencia (avapritinib en pacientes que no respondieron al imatinib y al menos un ITC adicional):
- El VOYAGER (NCT03465722) fue un ensayo sin enmascaramiento de fase III de 476 pacientes con GIST avanzados que no respondieron al imatinib y, al menos, un ITC adicional. Los pacientes se asignaron de manera aleatoria para recibir 300 mg diarios de avapritinib (n = 240) o 160 mg de regorafenib diarios (régimen de 3 semanas con 1 semana de descanso) (n = 236), y se permitió el cambio de tratamiento de regorafenib a avapritinib.[
28 ]- La mediana de SSP fue de 4,2 meses en el grupo de avapritinib y de 5,6 meses en el grupo de regorafenib (cociente de riesgos instantáneos [CRI], 1,25; IC 95 %, 0,99–1,57; P = 0,055). Entre los pacientes sin una variante PDGFRA D842V, la mediana de SSP fue de 3,9 meses en el grupo de avapritinib y de 5,6 meses en el grupo de regorafenib (CRI, 1,34; IC 95 %, 1,06–1,69; P = 0,012).[
28 ][Nivel de evidencia B1] - Los datos de SG eran preliminares en el momento del informe, sin que se observaran diferencias de intervalo entre los grupos del estudio.
- Los efectos adversos generales y de grado 3 o más alto relacionados con el tratamiento no difirieron entre los grupos. Sin embargo, los efectos cognitivos se presentaron con más frecuencia en los pacientes que recibieron avapritinib (25,9 %) que en los pacientes que recibieron regorafenib (3,8 %).
- Debido a que el avapritinib no mejoró la SSP ni la SG, en comparación con el regorafenib en la población tratada, no se indica hasta que hayan fracasado múltiples tratamientos previos con ITC (al margen de la indicación de la variante específica anterior).
- La mediana de SSP fue de 4,2 meses en el grupo de avapritinib y de 5,6 meses en el grupo de regorafenib (cociente de riesgos instantáneos [CRI], 1,25; IC 95 %, 0,99–1,57; P = 0,055). Entre los pacientes sin una variante PDGFRA D842V, la mediana de SSP fue de 3,9 meses en el grupo de avapritinib y de 5,6 meses en el grupo de regorafenib (CRI, 1,34; IC 95 %, 1,06–1,69; P = 0,012).[
Si se indica, se administra avapritinib en dosis diarias de 300 mg. El avapritinib es teratógeno y, por lo tanto, exige anticoncepción eficaz hasta 6 semanas después de la dosis final.[
Los efectos cognitivos se deben vigilar de cerca, y los cambios en el tratamiento (reducciones, modificaciones, interrupción) se deben realizar de inmediato. A partir de un análisis a posteriori de pacientes que recibieron 300 mg diarios, se observaron efectos cognitivos de grado 1 a 2 en el 37 % de los pacientes y el 52 % de los pacientes mayores de 65 años. Estos efectos incluyeron deterioro cognitivo, cambios de humor, trastorno del sueño, mareos, alucinaciones, y hemorragia intracraneal. Por lo general, estos efectos cognitivos mejoraron una vez que se realizaron cambios en el tratamiento.[
Cabe destacar que, para los pacientes con GIST que no hospedan una variante PDGFRA D842V, no se debe usar avapritinib hasta que se pruebe el imatinib y, al menos, dos fármacos adicionales (sunitinib y regorafenib). En el ensayo sin anonimato de fase III VOYAGER se demostró que el regorafenib mejoró la SSP más que el avapritinib en pacientes sin una variante PDGFRA D842V.[
Terapia con inhibidor de tirosina–cinasas para los tumores de estroma gastrointestinal resistentes al imatinib
Sunitinib
En el caso de progresión del tumor o intolerancia al imatinib, los datos respaldan la terapia de segunda línea con aumento de la dosis de imatinib a 800 mg por día (como se describió más arriba) o sunitinib.[
Evidencia (sunitinib):
- En un ensayo internacional de fase III con 312 pacientes con GIST resistentes al imatinib, se asignó de manera aleatoria a los pacientes a recibir sunitinib o placebo.[
30 ]- A partir de evaluación radiológica, la mediana de tiempo hasta la progresión del tumor fue más de 4 veces más prolongada con la terapia con sunitinib (27,3 semanas; IC 95 %, 16,0–32,1) que con el placebo (6,4 semanas; IC 95 %, 4,4–10,0) (CRI, 0,33; IC 95 %, 0,23–0,47; P < 0,0001).[
30 ][Nivel de evidencia A1] - La SG fue también mejor para los pacientes que recibieron tratamiento con sunitinib (CRIde muerte, 0,49; IC 95 %, 0,29–0,83).[
30 ][Nivel de evidencia A1]
- A partir de evaluación radiológica, la mediana de tiempo hasta la progresión del tumor fue más de 4 veces más prolongada con la terapia con sunitinib (27,3 semanas; IC 95 %, 16,0–32,1) que con el placebo (6,4 semanas; IC 95 %, 4,4–10,0) (CRI, 0,33; IC 95 %, 0,23–0,47; P < 0,0001).[
La caracterización molecular del GIST también influye en la respuesta al sunitinib. A partir de un estudio de fase I/II de 97 pacientes, se observó una tasa de beneficio clínico más alta, beneficio para la SSP y la SG en pacientes con variantes en el exón 9 de KIT, en comparación con pacientes con KIT, o variantes en el exón 11 de KIT.[
Los efectos secundarios comunes relacionados con el sunitinib son los siguientes:[
- Fatiga.
- Náuseas y vómitos.
- Anemia.
- Neutropenia.
- Diarrea.
- Dolor abdominal.
- Mucositis.
- Anorexia.
- Cambio de color de la piel o el pelo.
- Proteinuria.
- Hipotiroidismo (por lo general, se recomienda la vigilancia del funcionamiento tiroideo).
- Hipertensión.
- Posibilidad de retraso en la cicatrización de heridas (es posible que sea necesario interrumpir la administración 3–4 días antes de una cirugía).
Los efectos tóxicos menos frecuentes incluyen hemorragia, fiebre yeritrodisestesia palmoplantar.[
Regorafenib
La FDA aprobó el regorafenib para el tratamiento de los GIST resistentes a la terapia de primera línea. El regorafenib es un inhibidor multicinasa con actividad contra KIT, PDGFRA y VEGFR, entre otros. El regorafenib ha demostrado actividad contra los-GIST en estudios de fase II y fase III.[
Evidencia (regorafenib):
- En el ensayo con enmascaramiento doble de fase III GRID (NCT01271712) se registraron 199 pacientes con GIST avanzados que no respondieron a la terapia previa con imatinib y sunitinib. Los pacientes se asignaron de manera aleatoria en una proporción de 2:1 a recibir 160 mg de regorafenib diarios (régimen de 3 semanas con o 1 semanas de descanso) (n = 133) o placebo (n = 66). Se permitió el cambio de tratamiento a regorafenib sin enmascaramiento en pacientes con progresión de la enfermedad en el grupo de placebo.[
40 ]- Después de una mediana de duración del tratamiento de 23 semanas para el regorafenib y 7 semanas para el placebo, la mediana de SSP fue más prolongada en los pacientes que recibieron regorafenib (4,8 meses), en comparación con los pacientes que recibieron placebo (0,9 meses) (CRI, 0,27; IC 95 %, 0,19–0,39; P < 0,0001).[
40 ][Nivel de evidencia B1] La SG no difirió entre los grupos (CRI, 0,77; 0,4–1,41; P = 0,199). Sin embargo, se cambió el tratamiento de 56 pacientes del grupo de placebo (85 %) a regorafenib en el momento de la progresión de la enfermedad. - Los efectos adversos fueron más comunes en el grupo de regorafenib (98,5 %), en comparación con el grupo de placebo (68,2 %). Los eventos más comunes de grado 3 o superior fueron hipertensión (23,5 %), eritrodisestesia palmoplantar (19,7 %) y diarrea (5,3 %).
- Después de una mediana de duración del tratamiento de 23 semanas para el regorafenib y 7 semanas para el placebo, la mediana de SSP fue más prolongada en los pacientes que recibieron regorafenib (4,8 meses), en comparación con los pacientes que recibieron placebo (0,9 meses) (CRI, 0,27; IC 95 %, 0,19–0,39; P < 0,0001).[
Opciones adicionales de terapia con inhibidor de tirosina–cinasas
Ripretinib
El ripretinib se indica para pacientes con GIST avanzados que presentan progresión de la enfermedad con 3 o más ITC (o son intolerantes a los mismos), incluso imatinib. Actúa como inhibidor del control del interruptor con múltiples dianas, como los exones 11, 13, 14, 18 de KIT 9, y estabiliza la molécula KIT en su forma activa.
Según el perfil de toxicidad del ripretinib, se debe obtener un ecocardiograma inicial o una ventriculografía nuclear (MUGA), y se debe controlar en serie la presión arterial y los signos clínicos de insuficiencia cardíaca. Se justifican los exámenes dermatológicos, dada la relación con el desarrollo de cánceres cutáneos y eritrodisestesia palmoplantar. El ripretinib es teratógeno y justifica la administración simultánea de métodos anticonceptivos eficaces. Tampoco se debe administrar antes de una operación (1 semana antes o 2 semanas después de la cirugía) debido al riesgo de retraso en la cicatrización de la herida.[
Evidencia (ripretinib):
- El INVICTUS (NCT03353753) fue un ensayo de fase III con enmascaramiento doble y controlado con placebo de 129 pacientes con GIST avanzados que no habían respondido a la terapia previa con imatinib, sunitinib y regorafenib. Los pacientes se asignaron de manera aleatoria en una proporción de 2:1 a recibir 150 mg de ripretinib diarios (n = 85) o placebo (n = 44), con la oportunidad de cambiar de tratamiento en el momento de la progresión de la enfermedad.[
41 ]- Después de una mediana de seguimiento de 6,3 meses para el grupo de ripretinib y 1,6 meses para el grupo de placebo, la mediana de SG fue más prolongada para los pacientes que recibieron ripretinib (15,1 meses), en comparación con los pacientes que recibieron placebo (6,6 meses) (CRI, 0,36; IC 95 %, 0,21–0,62).[
41 ][Nivel de evidencia A1] - La mediana de SSP fue más prolongada en los pacientes que recibieron ripretinib (6,3 meses) que en los pacientes que recibieron placebo (1,0 mes) (CRI, 0,15; IC 95 %, 0,09–0,25; P < 0,0001). La tasa de SSP a 6 meses fue del 51 % en el grupo de ripretinib (IC 95 %, 39,4–61,4 %) y del 3,2 % en el grupo de placebo (IC 95 %, 0,2–13,8 %).[
41 ] - En el grupo de placebo, 29 pacientes (66 %) se cambiaron al grupo de ripretinib.
- El ripretinib fue bien tolerado. Los efectos adversos de grado 3 o 4 más comunes fueron el aumento de la lipasa (5 %), hipertensión (4 %), fatiga (2 %) e hipofosfatemia (2 %).
- Después de una mediana de seguimiento de 6,3 meses para el grupo de ripretinib y 1,6 meses para el grupo de placebo, la mediana de SG fue más prolongada para los pacientes que recibieron ripretinib (15,1 meses), en comparación con los pacientes que recibieron placebo (6,6 meses) (CRI, 0,36; IC 95 %, 0,21–0,62).[
- El INTRIGUE (NCT03673501) fue un ensayo sin anonimato de fase III de 453 pacientes con GIST avanzados que no respondieron a la terapia con imatinib. Los pacientes se asignaron de manera aleatoria para recibir 150 mg diarios de ripretinib (n = 226) o 50 mg de sunitinib (régimen de 4 semanas con 2 semanas de descanso; n = 227).[
43 ]- La mediana de SSP no difirió entre los grupos de ripretinib y sunitinib (8,0 vs. 8,3 meses; CRI, 1,05; IC 95 %, 0,82–1,33; P = 0,72). Además, no hubo ninguna diferencia en la mediana de SSP en la cohorte del exón 11 de KIT (8,3 vs. 7,0 meses; CRI, 0,88; IC 95 %, 0,66–1,16;P = 0,36).[
43 ][Nivel de evidencia B1] - Los datos de SG eran preliminares en el momento del informe.
- Los pacientes que recibieron ripretinib presentaron menos efectos adversos del tratamiento (41,3 vs. 65,6 %; P < 0,0001) y tuvieron más probabilidad de presentar hipertensión de grado 3 o 4 relacionada con el fármaco (5,8 vs. 22,6 %). Las modificaciones, interrupciones o suspensiones definitivas de la dosis fueron menos comunes con el ripretinib.
- El ripretinib no produjo ningún beneficio en la SSP o la SG, en comparación con el sunitinib. Por lo tanto, no se indica, a menos que el tumor del paciente no responda a las líneas previas de terapia con ITC.
- La mediana de SSP no difirió entre los grupos de ripretinib y sunitinib (8,0 vs. 8,3 meses; CRI, 1,05; IC 95 %, 0,82–1,33; P = 0,72). Además, no hubo ninguna diferencia en la mediana de SSP en la cohorte del exón 11 de KIT (8,3 vs. 7,0 meses; CRI, 0,88; IC 95 %, 0,66–1,16;P = 0,36).[
Nilotinib
El nilotinib es un ITC de segunda generación con dianas similares al imatinib. En un estudio de fase III de nilotinib versus el mejor tratamiento de apoyo en los GIST resistentes a imatinib y sunitinib, se observó algún beneficio de la SSP según la evaluación local, pero ningún beneficio según la evaluación central. El análisis a posteriori reveló una diferencia modesta pero significativa en la mediana de SG de 4 meses.[
Sorafenib
El sorafenib se dirige a varias cinasas y tiene una estructura y mecanismo de acción similares al regorafenib. En un ensayo de fase II de pacientes con GIST resistentes al imatinib y al sunitinib, se observó que el sorafenib ofreció un beneficio potencial, con una tasa de control de la enfermedad del 68 % y una mediana de SSP de 5 meses.[
Pazopanib
El pazopanib inhibe la señalización del factor de crecimiento endotelial vascular (VEGF) y mostró un beneficio modesto de la SSP, en comparación con el mejor tratamiento de apoyo, en un ensayo pequeño de fase II de pacientes con GIST resistentes al imatinib y al sunitinib. Sin embargo, el pazopanib presentó una tasa alta de toxicidad.[
Terapia con ITC para los GIST conKIToPDGFRAde tipo natural
Los pacientes sin variantes de KIT o PDGFRA, como los GIST con deficiencia de SDH y relacionados con NF1, no se benefician del tratamiento inicial con ITC ni con imatinib. No obstante, es posible que estos pacientes presenten una respuesta modesta al sunitinib y el regorafenib.[
Cirugía
Es posible que se agregue la operación quirúrgica al tratamiento médico para pacientes con GIST seleccionados con el objetivo de retrasar o prevenir la recidiva, aunque el beneficio de este abordaje terapéutico en pacientes con GIST metastásicos aún no se ha demostrado en ningún ensayo clínico aleatorizado.
Evidencia (cirugía):
- En un estudio retrospectivo en el que participaron 69 pacientes consecutivos que se sometieron a cirugía por GIST primarios irresecables o metastásicos mientras recibían inhibidores de cinasas se notificó lo siguiente:[
48 ][Niveles de evidencia C2 y C1]- Se observó que los pacientes con enfermedad estable o progresión limitada presentaban supervivencia prolongada después de los procedimientos de citorreducción. En este grupo de pacientes con GIST, no se encontraron indicios de enfermedad después de la cirugía en el 78 % de los pacientes con enfermedad estable, el 25 % de los pacientes con progresión limitada y el 7 % de los pacientes con progresión generalizada.
- La tasa de SSP a 12 meses fue del 80 % para los pacientes con enfermedad estable, el 33 % para los pacientes con progresión limitada y el 0 % para los pacientes con progresión generalizada.
- La tasa de SG a 12 meses fue del 95 % para los pacientes con enfermedad estable, del 86 % para los pacientes con progresión limitada y del 0 % para los pacientes con progresión generalizada.
- Los autores de este estudio concluyeron que la cirugía para los pacientes con progresión generalizada se debe limitar a una función paliativa.
En general, las indicaciones para la cirugía en el tratamiento de los GIST metastásicos o recidivantes son las siguientes:[
- Enfermedad estable (es decir, enfermedad en situación estable o que se reduce con el tratamiento con ITC cuando es posible una resección macroscópica).
- Progresión limitada de la enfermedad (es decir, depósitos tumorales aislados que progresan durante el tratamiento con ITC después de la respuesta inicial [que indica resistencia al fármaco tardía], mientras que otros sitios de la enfermedad permanecen estables).
- Emergencias oncológicas, como hemorragia, perforación, obstrucción o absceso.
La enfermedad estable y la progresión limitada de la enfermedad identifican subgrupos de pacientes con enfermedad avanzada que se seleccionan por la estabilidad relativa de la enfermedad. Por lo tanto, los desenlaces favorables que se han observado en las series de casos quizás sean principalmente el resultado del sesgo de selección en lugar del beneficio real de la cirugía.
La mediana de tiempo hasta que se presentó resistencia secundaria al imatinib fue de cerca de 2 años.[
Estudios clínicos
Los pacientes con progresión generalizada de la enfermedad mientras reciben terapias estándar o con ciertos subtipos moleculares (es decir, GIST con deficiencia de SDH o relacionados con NF1) quizás se beneficien de su inscripción en ensayos clínicos. Estos pacientes se deben derivar a centros de investigación multidisciplinarios especializados.
Ensayos clínicos en curso
Realizar una
Referencias:
- Debiec-Rychter M, Sciot R, Le Cesne A, et al.: KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. Eur J Cancer 42 (8): 1093-103, 2006.
- Heinrich MC, Jones RL, von Mehren M, et al.: Avapritinib in advanced PDGFRA D842V-mutant gastrointestinal stromal tumour (NAVIGATOR): a multicentre, open-label, phase 1 trial. Lancet Oncol 21 (7): 935-946, 2020.
- Demetri GD, Benjamin RS, Blanke CD, et al.: NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 5 (Suppl 2): S1-29; quiz S30, 2007.
- Casali PG, Dei Tos AP, Gronchi A: Gastrointestinal stromal tumor. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology. 11th ed. Wolters Kluwer, 2019, pp 895-906.
- Blanke CD, von Mehren M, Joensuu H, et al.: Evaluation of the safety and efficacy of an oral molecularly-targeted therapy, STI157, in patients (pts) with unresectable or metastatic gastrointestinal stromal tumors (GISTs) expressing c-kit (CD117). [Abstract] Proceedings of the American Society of Clinical Oncology 20: A-1, 1a, 2001.
- van Oosterom AT, Judson I, Verweij J, et al.: Safety and efficacy of imatinib (STI571) in metastatic gastrointestinal stromal tumours: a phase I study. Lancet 358 (9291): 1421-3, 2001.
- Choi H, Charnsangavej C, Faria SC, et al.: Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate: proposal of new computed tomography response criteria. J Clin Oncol 25 (13): 1753-9, 2007.
- Blay JY, Le Cesne A, Ray-Coquard I, et al.: Prospective multicentric randomized phase III study of imatinib in patients with advanced gastrointestinal stromal tumors comparing interruption versus continuation of treatment beyond 1 year: the French Sarcoma Group. J Clin Oncol 25 (9): 1107-13, 2007.
- Blanke CD, Demetri GD, von Mehren M, et al.: Long-term results from a randomized phase II trial of standard- versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT. J Clin Oncol 26 (4): 620-5, 2008.
- Casali PG, Zalcberg J, Le Cesne A, et al.: Ten-Year Progression-Free and Overall Survival in Patients With Unresectable or Metastatic GI Stromal Tumors: Long-Term Analysis of the European Organisation for Research and Treatment of Cancer, Italian Sarcoma Group, and Australasian Gastrointestinal Trials Group Intergroup Phase III Randomized Trial on Imatinib at Two Dose Levels. J Clin Oncol 35 (15): 1713-1720, 2017.
- Demetri GD, von Mehren M, Blanke CD, et al.: Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 347 (7): 472-80, 2002.
- Verweij J, Casali PG, Zalcberg J, et al.: Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial. Lancet 364 (9440): 1127-34, 2004.
- Van Glabbeke M, Verweij J, Casali PG, et al.: Initial and late resistance to imatinib in advanced gastrointestinal stromal tumors are predicted by different prognostic factors: a European Organisation for Research and Treatment of Cancer-Italian Sarcoma Group-Australasian Gastrointestinal Trials Group study. J Clin Oncol 23 (24): 5795-804, 2005.
- Rutkowski P, Nowecki ZI, Debiec-Rychter M, et al.: Predictive factors for long-term effects of imatinib therapy in patients with inoperable/metastatic CD117(+) gastrointestinal stromal tumors (GISTs). J Cancer Res Clin Oncol 133 (9): 589-97, 2007.
- Blanke CD, Rankin C, Demetri GD, et al.: Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. J Clin Oncol 26 (4): 626-32, 2008.
- Zalcberg JR, Verweij J, Casali PG, et al.: Outcome of patients with advanced gastro-intestinal stromal tumours crossing over to a daily imatinib dose of 800 mg after progression on 400 mg. Eur J Cancer 41 (12): 1751-7, 2005.
- Heinrich MC, Corless CL, Demetri GD, et al.: Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol 21 (23): 4342-9, 2003.
- Debiec-Rychter M, Dumez H, Judson I, et al.: Use of c-KIT/PDGFRA mutational analysis to predict the clinical response to imatinib in patients with advanced gastrointestinal stromal tumours entered on phase I and II studies of the EORTC Soft Tissue and Bone Sarcoma Group. Eur J Cancer 40 (5): 689-95, 2004.
- Corless CL, Schroeder A, Griffith D, et al.: PDGFRA mutations in gastrointestinal stromal tumors: frequency, spectrum and in vitro sensitivity to imatinib. J Clin Oncol 23 (23): 5357-64, 2005.
- Heinrich MC, Owzar K, Corless CL, et al.: Correlation of kinase genotype and clinical outcome in the North American Intergroup Phase III Trial of imatinib mesylate for treatment of advanced gastrointestinal stromal tumor: CALGB 150105 Study by Cancer and Leukemia Group B and Southwest Oncology Group. J Clin Oncol 26 (33): 5360-7, 2008.
- Patrikidou A, Domont J, Chabaud S, et al.: Long-term outcome of molecular subgroups of GIST patients treated with standard-dose imatinib in the BFR14 trial of the French Sarcoma Group. Eur J Cancer 52: 173-80, 2016.
- van Glabbeke MM, Owzar K, Rankin C, et al.: Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumors (GIST): a meta-analyis based on 1,640 patients (pts). [Abstract] J Clin Oncol 25 (Suppl 18): A-10004, 546s, 2007.
- Rutkowski P, Nowecki Z, Nyckowski P, et al.: Surgical treatment of patients with initially inoperable and/or metastatic gastrointestinal stromal tumors (GIST) during therapy with imatinib mesylate. J Surg Oncol 93 (4): 304-11, 2006.
- Dagher R, Cohen M, Williams G, et al.: Approval summary: imatinib mesylate in the treatment of metastatic and/or unresectable malignant gastrointestinal stromal tumors. Clin Cancer Res 8 (10): 3034-8, 2002.
- Benjamin RS, Rankin C, Fletcher C, et al.: Phase III dose-randomized study of imatinib mesylate (STI571) for GIST: Intergroup S0033 early results. [Abstract] Proceedings of the American Society of Clinical Oncology 22: A-3271, 2003.
- Verweij J, van Oosterom A, Blay JY, et al.: Imatinib mesylate (STI-571 Glivec, Gleevec) is an active agent for gastrointestinal stromal tumours, but does not yield responses in other soft-tissue sarcomas that are unselected for a molecular target. Results from an EORTC Soft Tissue and Bone Sarcoma Group phase II study. Eur J Cancer 39 (14): 2006-11, 2003.
- Kerkelä R, Grazette L, Yacobi R, et al.: Cardiotoxicity of the cancer therapeutic agent imatinib mesylate. Nat Med 12 (8): 908-16, 2006.
- Kang YK, George S, Jones RL, et al.: Avapritinib Versus Regorafenib in Locally Advanced Unresectable or Metastatic GI Stromal Tumor: A Randomized, Open-Label Phase III Study. J Clin Oncol 39 (28): 3128-3139, 2021.
- Joseph CP, Abaricia SN, Angelis MA, et al.: Optimal Avapritinib Treatment Strategies for Patients with Metastatic or Unresectable Gastrointestinal Stromal Tumors. Oncologist 26 (4): e622-e631, 2021.
- Demetri GD, van Oosterom AT, Garrett CR, et al.: Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 368 (9544): 1329-38, 2006.
- Prior JO, Montemurro M, Orcurto MV, et al.: Early prediction of response to sunitinib after imatinib failure by 18F-fluorodeoxyglucose positron emission tomography in patients with gastrointestinal stromal tumor. J Clin Oncol 27 (3): 439-45, 2009.
- Demetri GD, Heinrich MC, Fletcher JA, et al.: Molecular target modulation, imaging, and clinical evaluation of gastrointestinal stromal tumor patients treated with sunitinib malate after imatinib failure. Clin Cancer Res 15 (18): 5902-9, 2009.
- Heinrich MC, Maki RG, Corless CL, et al.: Primary and secondary kinase genotypes correlate with the biological and clinical activity of sunitinib in imatinib-resistant gastrointestinal stromal tumor. J Clin Oncol 26 (33): 5352-9, 2008.
- Rutkowski P, Bylina E, Klimczak A, et al.: The outcome and predictive factors of sunitinib therapy in advanced gastrointestinal stromal tumors (GIST) after imatinib failure - one institution study. BMC Cancer 12: 107, 2012.
- Demetri GD, Garrett CR, Schöffski P, et al.: Complete longitudinal analyses of the randomized, placebo-controlled, phase III trial of sunitinib in patients with gastrointestinal stromal tumor following imatinib failure. Clin Cancer Res 18 (11): 3170-9, 2012.
- Reichardt P, Kang YK, Rutkowski P, et al.: Clinical outcomes of patients with advanced gastrointestinal stromal tumors: safety and efficacy in a worldwide treatment-use trial of sunitinib. Cancer 121 (9): 1405-13, 2015.
- Wolter P, Stefan C, Decallonne B, et al.: The clinical implications of sunitinib-induced hypothyroidism: a prospective evaluation. Br J Cancer 99 (3): 448-54, 2008.
- Chu TF, Rupnick MA, Kerkela R, et al.: Cardiotoxicity associated with tyrosine kinase inhibitor sunitinib. Lancet 370 (9604): 2011-9, 2007.
- George S, Wang Q, Heinrich MC, et al.: Efficacy and safety of regorafenib in patients with metastatic and/or unresectable GI stromal tumor after failure of imatinib and sunitinib: a multicenter phase II trial. J Clin Oncol 30 (19): 2401-7, 2012.
- Demetri GD, Reichardt P, Kang YK, et al.: Efficacy and safety of regorafenib for advanced gastrointestinal stromal tumours after failure of imatinib and sunitinib (GRID): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 381 (9863): 295-302, 2013.
- Blay JY, Serrano C, Heinrich MC, et al.: Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 21 (7): 923-934, 2020.
- Janku F, Abdul Razak AR, Chi P, et al.: Switch Control Inhibition of KIT and PDGFRA in Patients With Advanced Gastrointestinal Stromal Tumor: A Phase I Study of Ripretinib. J Clin Oncol 38 (28): 3294-3303, 2020.
- Bauer S, Jones RL, Blay JY, et al.: Ripretinib Versus Sunitinib in Patients With Advanced Gastrointestinal Stromal Tumor After Treatment With Imatinib (INTRIGUE): A Randomized, Open-Label, Phase III Trial. J Clin Oncol 40 (34): 3918-3928, 2022.
- Reichardt P, Blay JY, Gelderblom H, et al.: Phase III study of nilotinib versus best supportive care with or without a TKI in patients with gastrointestinal stromal tumors resistant to or intolerant of imatinib and sunitinib. Ann Oncol 23 (7): 1680-7, 2012.
- Campbell NP, Wroblewski K, Maki RG, et al.: Final results of a University of Chicago phase II consortium trial of sorafenib (SOR) in patients (pts) with imatinib (IM)- and sunitinib (SU)-resistant (RES) gastrointestinal stromal tumors (GIST). [Abstract] J Clin Oncol 29 (4): A-4, 2011.
- Mir O, Cropet C, Toulmonde M, et al.: Pazopanib plus best supportive care versus best supportive care alone in advanced gastrointestinal stromal tumours resistant to imatinib and sunitinib (PAZOGIST): a randomised, multicentre, open-label phase 2 trial. Lancet Oncol 17 (5): 632-41, 2016.
- Boikos SA, Pappo AS, Killian JK, et al.: Molecular Subtypes of KIT/PDGFRA Wild-Type Gastrointestinal Stromal Tumors: A Report From the National Institutes of Health Gastrointestinal Stromal Tumor Clinic. JAMA Oncol 2 (7): 922-8, 2016.
- Raut CP, Posner M, Desai J, et al.: Surgical management of advanced gastrointestinal stromal tumors after treatment with targeted systemic therapy using kinase inhibitors. J Clin Oncol 24 (15): 2325-31, 2006.
Tratamiento de los tumores de estroma gastrointestinal resistentes al tratamiento
El desarrollo eventual de resistencia al imatinib, sunitinib y regorafenib es casi universal. No hay ningún tratamiento estándar cuando esto ocurre y los pacientes deben considerar tratamientos en fase de investigación, como los nuevos inhibidores orales de tirosina–cinasas. Si son aptos, se alienta a los pacientes a participar en ensayos clínicos.
Ensayos clínicos en curso
Realizar una
Referencias bibliográficas clave para el tratamiento de los tumores de estroma gastrointestinal
Los miembros del Consejo editorial del PDQ sobre el tratamiento para adultos seleccionaron estas referencias bibliográficas por su importancia en el entorno del tratamiento de los tumores de estroma gastrointestinal (GIST). Esta lista se proporciona para informar a los interesados sobre estudios importantes que han ayudado a conformar la comprensión actual sobre las opciones de tratamiento para los tumores de estroma gastrointestinal. A continuación, se indican las secciones del resumen en las que se citaron las referencias.
Imatinib preoperatorio
8 a 12 semanas
- Eisenberg BL, Harris J, Blanke CD, et al.: Phase II trial of neoadjuvant/adjuvant imatinib mesylate (IM) for advanced primary and metastatic/recurrent operable gastrointestinal stromal tumor (GIST): early results of RTOG 0132/ACRIN 6665. J Surg Oncol 99 (1): 42-7, 2009. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal primarios irresecables
6 a 9 meses
- Kurokawa Y, Yang HK, Cho H, et al.: Phase II study of neoadjuvant imatinib in large gastrointestinal stromal tumours of the stomach. Br J Cancer 117 (1): 25-32, 2017. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal primarios irresecables
Imatinib posoperatorio
1 año de imatinib
- Dematteo RP, Ballman KV, Antonescu CR, et al.: Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet 373 (9669): 1097-104, 2009. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal primarios resecables
2 años de imatinib
- Joensuu H, Eriksson M, Sundby Hall K, et al.: One vs three years of adjuvant imatinib for operable gastrointestinal stromal tumor: a randomized trial. JAMA 307 (12): 1265-72, 2012. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal primarios resecables
1 año de imatinib versus 3 años
- Casali PG, Le Cesne A, Poveda Velasco A, et al.: Time to Definitive Failure to the First Tyrosine Kinase Inhibitor in Localized GI Stromal Tumors Treated With Imatinib As an Adjuvant: A European Organisation for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group Intergroup Randomized Trial in Collaboration With the Australasian Gastro-Intestinal Trials Group, UNICANCER, French Sarcoma Group, Italian Sarcoma Group, and Spanish Group for Research on Sarcomas. J Clin Oncol 33 (36): 4276-83, 2015. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal primarios resecables
5 años de imatinib
- Raut CP, Espat NJ, Maki RG, et al.: Efficacy and Tolerability of 5-Year Adjuvant Imatinib Treatment for Patients With Resected Intermediate- or High-Risk Primary Gastrointestinal Stromal Tumor: The PERSIST-5 Clinical Trial. JAMA Oncol 4 (12): e184060, 2018. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal primarios resecables
Duración variable de la administración de imatinib
- Lin JX, Chen QF, Zheng CH, et al.: Is 3-years duration of adjuvant imatinib mesylate treatment sufficient for patients with high-risk gastrointestinal stromal tumor? A study based on long-term follow-up. J Cancer Res Clin Oncol 143 (4): 727-734, 2017. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal primarios resecables
Inhibidores de tirosina–cinasas para tumores de estroma gastrointestinal avanzados
Imatinib
- Demetri GD, von Mehren M, Blanke CD, et al.: Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 347 (7): 472-80, 2002. [
PUBMED Abstract ]Citada en:
Aspectos generales de las opciones de tratamiento de los tumores de estroma gastrointestinal Tratamiento de los tumores de estroma gastrointestinal metastásicos o recidivantes
- Blanke CD, Rankin C, Demetri GD, et al.: Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. J Clin Oncol 26 (4): 626-32, 2008. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal metastásicos o recidivantes
Avapritinib
- Heinrich MC, Jones RL, von Mehren M, et al.: Avapritinib in advanced PDGFRA D842V-mutant gastrointestinal stromal tumour (NAVIGATOR): a multicentre, open-label, phase 1 trial. Lancet Oncol 21 (7): 935-946, 2020. [
PUBMED Abstract ]Citada en:
Aspectos generales de las opciones de tratamiento de los tumores de estroma gastrointestinal Tratamiento de los tumores de estroma gastrointestinal metastásicos o recidivantes
Avapritinib versus regorafenib
- Kang YK, George S, Jones RL, et al.: Avapritinib Versus Regorafenib in Locally Advanced Unresectable or Metastatic GI Stromal Tumor: A Randomized, Open-Label Phase III Study. J Clin Oncol 39 (28): 3128-3139, 2021. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal metastásicos o recidivantes
Sunitinib
- Demetri GD, van Oosterom AT, Garrett CR, et al.: Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 368 (9544): 1329-38, 2006. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal metastásicos o recidivantes
Regorafenib
- Demetri GD, Reichardt P, Kang YK, et al.: Efficacy and safety of regorafenib for advanced gastrointestinal stromal tumours after failure of imatinib and sunitinib (GRID): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 381 (9863): 295-302, 2013. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal metastásicos o recidivantes
Ripretinib
- Blay JY, Serrano C, Heinrich MC, et al.: Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 21 (7): 923-934, 2020. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal metastásicos o recidivantes
Ripretinib versus sunitinib
- Bauer S, Jones RL, Blay JY, et al.: Ripretinib Versus Sunitinib in Patients With Advanced Gastrointestinal Stromal Tumor After Treatment With Imatinib (INTRIGUE): A Randomized, Open-Label, Phase III Trial. J Clin Oncol 40 (34): 3918-3928, 2022. [
PUBMED Abstract ]Citada en:
Tratamiento de los tumores de estroma gastrointestinal metastásicos o recidivantes
Actualizaciones más recientes a este resumen (03 / 18 / 2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este resumen.
El
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento de los tumores de estroma gastrointestinal. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
El revisor principal del sumario sobre Tratamiento de los tumores de estroma gastrointestinal es:
- Vinayak Venkataraman, MD
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como "En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]".
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento de los tumores de estroma gastrointestinal. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como "estándar" o "en evaluación clínica". Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del
Última revisión: 2025-03-18
Esta información no reemplaza el consejo de un médico. Ignite Healthwise, LLC, niega toda garantía y responsabilidad por el uso de esta información. El uso que usted haga de esta información implica que usted acepta los
Healthwise, Healthwise para cada decisión de la salud, y el logo de Healthwise son marcas de fábrica de Ignite Healthwise, LLC.
Page Footer
Quiero...
Audiencia
Sitios seguros para miembros
Información sobre The Cigna Group
Aviso legal
Los planes individuales y familiares de seguro médico y dental están asegurados por Cigna Health and Life Insurance Company (CHLIC), Cigna HealthCare of Arizona, Inc., Cigna HealthCare of Illinois, Inc., Cigna HealthCare of Georgia, Inc., Cigna HealthCare of North Carolina, Inc., Cigna HealthCare of South Carolina, Inc. y Cigna HealthCare of Texas, Inc. Los planes de beneficios de salud y de seguro de salud de grupo están asegurados o administrados por CHLIC, Connecticut General Life Insurance Company (CGLIC) o sus afiliadas (puedes ver
Todas las pólizas de seguros y los planes de beneficios de grupo contienen exclusiones y limitaciones. Para conocer la disponibilidad, los costos y detalles completos de la cobertura, comunícate con un agente autorizado o con un representante de ventas de Cigna. Este sitio web no está dirigido a los residentes de New Mexico.