Comprar planes
Comprar tu propia cobertura
Planes a través de tu empleador
Conoce sobre los beneficios médicos, dentales, de farmacia y voluntarios que tu empleador puede ofrecer.
Aprender
¿Vives o trabajas fuera del país?
Tratamiento del carcinoma de células de Merkel (PDQ®) : Tratamiento - información para profesionales de salud [NCI]
Esta información es producida y suministrada por el Instituto Nacional del Cáncer (NCI, por sus siglas en inglés). La información en este tema puede haber cambiado desde que se escribió. Para la información más actual, comuníquese con el Instituto Nacional del Cáncer a través del Internet en la página web http://cancer.gov o llame al 1-800-4-CANCER.
Información general sobre el carcinoma de células de Merkel
El carcinoma de células de Merkel (CCM) fue descrito por primera vez por Toker en 1972 como carcinoma trabecular de la piel.[
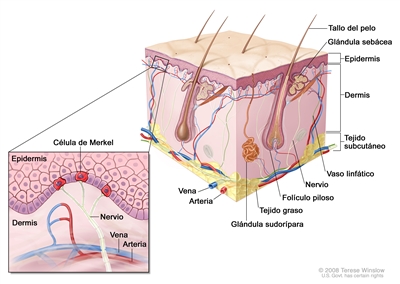
El CCM es un carcinoma neuroendocrino de crecimiento rápido que aparece en la unión dermoepidérmica (consultar la
Históricamente, las opciones de tratamiento para los pacientes con enfermedad en estadio avanzado han sido limitadas; no obstante, los nuevos abordajes de inmunoterapia producen respuestas duraderas.[
Características anatómicas
Incidencia y mortalidad
La incidencia del CCM aumenta de forma progresiva con la edad. Se han notificado pocos casos en pacientes menores de 50 años y la mediana de edad en el momento del diagnóstico es de alrededor de 65 años (consultar la 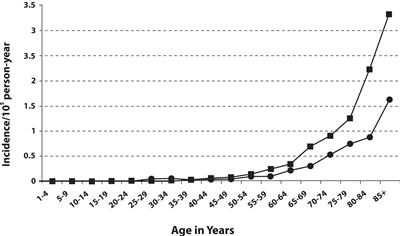
El CCM se presenta con mayor frecuencia en áreas de la piel expuestas al sol; en particular, la cabeza y el cuello, seguido por las extremidades y luego, el tronco.[
En 2013, se notificó que el CCM tuvo una incidencia anual de 0,7 casos por 100 000 personas en los Estados Unidos.[
| Localización anatómica | Casos (%) |
|---|---|
| SAI = sin otra indicación; SEER = Surveillance, Epidemiology, and End Results Program. | |
| a Albores-Saavedra J et al: Merkel cell carcinoma demographics, morphology, and survival based on 3,870 cases: A population-based study. J Cutan Pathol. Reproducción autorizada. © 2009 Publicado por Wiley-Blackwell. Todos los derechos reservados.[ |
|
| Piel, cara | 1041 (26,9) |
| Piel de miembro superior y hombro | 853 (22,0) |
| Piel de miembro inferior y cadera | 578 (14,9) |
| Piel del tronco | 410 (10,6) |
| Piel de cuero cabelludo y cuello | 348 (9,0) |
| Piel, SAI | 234 (6,0) |
| Oído externo | 120 (3,1) |
| Párpado | 98 (2,5) |
| Piel del labio | 91 (2,4) |
| Sitio primario desconocido | 31 (0,8) |
| Total | 3804 (98,3) |
En varias series de casos, hasta el 97 % de los CCM aparecen en la piel. Los CCM primarios en otras localizaciones fueron muy poco frecuentes, así como los CCM de sitio primario desconocido.[
En los datos del registro SEER se observó un exceso en el riesgo de CCM como primero o segundo cáncer en pacientes con varios cánceres primarios.[
Patogenia
Se ha observado un aumento de la incidencia de CCM en personas tratadas por psoriasis con dosis altas de metoxaleno (psoraleno) y radiación ultravioleta A (PUVA) (3 de 1380 pacientes, un 0,2 %). Esto también se ha observado en personas con depresión inmunitaria crónica, en especial, por leucemia linfocítica crónica, infección por el VIH y trasplante previo de un órgano sólido.[
En 2008, se notificó por primera vez un poliomavirus nuevo (poliomavirus de células de Merkel, [MCPyV]) en muestras tumorales de CCM [
Se detectaron índices muy bajos de MCPyV en la piel normal distante del tumor primario de un CCM en un porcentaje significativo de pacientes con trastornos cutáneos no relacionados con el CCM, en la piel con apariencia normal de personas sanas y en cánceres de piel no melanoma en personas con depresión inmunitaria.[
La importancia de los nuevos hallazgos sobre el MCPyV permanece incierta. El significado pronóstico de la carga viral, las concentraciones de los títulos de anticuerpos y la función de inmunodepresión subyacente en las personas portadoras de este virus (debido a enfermedades y medicamentos) siguen en investigación.
La prevalencia del MCPyV difiere entre los pacientes con CCM de los Estados Unidos y Europa en oposición con Australia. Es posible que hayan dos vías independientes para el surgimiento del CCM: una que es impulsada por la presencia del MCPyV y otra impulsada principalmente por el daño solar, en especial, según se observó en los pacientes de series australianas.[
Aunque no se ha identificado un marcador único para el CCM, se informó de una variedad de marcadores moleculares y citogenéticos del CCM.[
Presentación clínica
El CCM se presenta por lo general como un nódulo dérmico solitario, indoloro, endurecido, de color ligeramente eritematoso a violeta intenso y, con poca frecuencia, ulcerado. El CCM puede infiltrar localmente a través de los vasos linfáticos dérmicos, lo que da lugar a múltiples lesiones satélite. Debido a su apariencia clínica inespecífica, pocas veces se presume la presencia de CCM antes de realizar una biopsia.[
Se propuso la siguiente fórmula nemotécnica en inglés para resumir las características clínicas del CCM:[
AEIOU
- A = asymptomatic (asintomático).
- E = expanding rapidly (expansión rápida).
- I = immune suppressed (inmunodepresión).
- O = older than 50 years (mayor de 50 años).
- U = UV-exposed skin (piel expuesta a rayos ultravioleta).
No todos los pacientes cuentan con todos los elementos de esta fórmula mnemónica; sin embargo, el 89 % de los pacientes cumplieron con 3 o más criterios, el 52 % cumplieron con 4 o más criterios y 7 % cumplieron con los 5 criterios.[
Evaluación clínica inicial
Debido a que la diseminación locorregional es común, los pacientes con diagnóstico reciente de CCM necesitan un examen físico cuidadoso que incluya la búsqueda de lesiones satélite y compromiso ganglionar regional.
Las pruebas con imágenes se adaptan de acuerdo con el cuadro clínico y se deben considerar todos los signos y síntomas relevantes. No se ha realizado un estudio sistemático de las pruebas con imágenes óptimas para los pacientes con diagnóstico reciente ni está claro si todos estos pacientes, en especial, aquellos con tumores primarios más pequeños, se benefician de imágenes detalladas.
Si se realizan pruebas con imágenes, estas tal vez incluyan una tomografía computarizada (TC) del tórax y el abdomen para descartar un cáncer primario de células pequeñas de pulmón, así como metástasis a distancia y regionales. A veces también se recomiendan estudios con imágenes diseñados para evaluar los signos y síntomas sospechosos. En una serie, las TC rindieron una tasa de falsos negativos del 80 % para las metástasis regionales.[
Resultados de la estadificación inicial
De acuerdo con las series de casos retrospectivos notificados en el transcurso de varias décadas, los resultados de la estadificación clínica inicial de un CCM varían mucho en la literatura. De los cánceres invasivos, el 48,6 % tenían invasión local, el 31,1 % tenían invasión regional y el 8,2 % tenían invasión a distancia.[
El CCM que se manifiesta en ganglios regionales sin una lesión primaria identificable se encuentra en una minoría de pacientes y el porcentaje de estos casos varía en las series notificadas. Los tumores sin una lesión primaria identificable se atribuyeron a una regresión espontánea del tumor primario o a un carcinoma neuroendocrino metastásico de sitio oculto en la exploración clínica.[
Progresión clínica
En un análisis de pacientes de 18 series de casos, 279 de 926 pacientes (30,1 %) presentaron recidiva local durante el seguimiento, excepto aquellos que presentaron al inicio una enfermedad metastásica a distancia. Estos casos se atribuyeron normalmente a márgenes quirúrgicos inadecuados o a la falta de radioterapia adyuvante. Además, 545 de 982 pacientes (55,5 %) tenían metástasis en los ganglios linfáticos en el momento del diagnóstico o durante el seguimiento.[
En el mismo análisis de 18 series de casos, los sitios más comunes de metástasis a distancia fueron los ganglios linfáticos distantes (60,1 %), una parte distante de la piel (30,3 %), el pulmón (23,4 %), el sistema nervioso central (18,4 %) y el hueso (15,2 %).[
En una serie de 237 pacientes que se presentaron al inicio con enfermedad local o regional, la mediana de tiempo hasta la recidiva fue de 9 meses (intervalo, 2–70 meses). Noventa y uno por ciento de las recidivas se presentaron dentro de los 2 años a partir del diagnóstico.[
Posibles factores pronósticos
El grado de diseminación de la enfermedad en el momento de la presentación inicial quizás proporcione el cálculo más útil para pronóstico.[
Los procedimientos diagnósticos, como la biopsia del ganglio linfático centinela, quizás ayuden a diferenciar la enfermedad local y regional en el momento de la presentación inicial. Un tercio de los pacientes que carecen de ganglios clínicamente palpables o radiológicamente visibles tendrán enfermedad regional evidente en el microscopio.[
En muchos estudios retrospectivos se evaluó la relación entre una variedad amplia de factores biológicos e histológicos con la supervivencia y el control locorregional.[
En un estudio retrospectivo amplio de una sola institución se evaluaron los factores histológicos potencialmente relacionados con el pronóstico de 156 pacientes con CCM durante una mediana de seguimiento de 51 meses (intervalo, 2–224 meses).[
En un estudio realizado en 2009 se investigó si la presencia del MCPyV recién identificado en muestras tumorales de CCM influyó en los desenlaces clínicos de 114 pacientes con CCM en Finlandia. En este pequeño estudio, los pacientes cuyos tumores exhibieron positividad para el MCPyV presentaron una mejor supervivencia que los pacientes cuyos tumores exhibieron negatividad para el MCPyV.[
Pronóstico
Los parámetros más importantes para el pronóstico del CCM son el tamaño del tumor y la presencia de metástasis locorregionales o a distancia. Estos factores constituyen la base del sistema de estadificación del American Joint Committee on Cancer para el CCM.[
El grueso de la bibliografía sobre el CCM corresponde a series de casos pequeñas sujetas a muchos factores de confusión. Por esta razón, las tasas de recaída y supervivencia por estadio de las que se tienen informes varían mucho en la bibliografía. En general, la enfermedad en los estadios más bajos se relaciona con una mejor supervivencia general.[
En un informe se notificó que los desenlaces clínicos de pacientes que presentan al inicio una enfermedad local de volumen pequeño y ganglios linfáticos sin compromiso tumoral confirmados mediante estudio patológico tienen una tasa de supervivencia por causa específica a 5 años superior al 90 %.[
En un resumen tabulado de los resultados de 12 series de tratamiento del CCM se ilustra la dificultad de comparar los datos de los resultados entre las series.[
En la 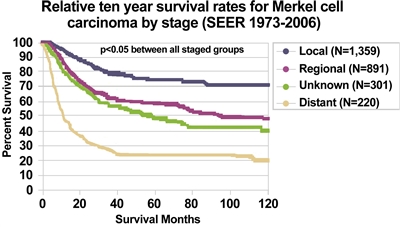
Referencias:
- Toker C: Trabecular carcinoma of the skin. Arch Dermatol 105 (1): 107-10, 1972.
- Schwartz RA, Lambert WC: The Merkel cell carcinoma: a 50-year retrospect. J Surg Oncol 89 (1): 5, 2005.
- Agelli M, Clegg LX, Becker JC, et al.: The etiology and epidemiology of merkel cell carcinoma. Curr Probl Cancer 34 (1): 14-37, 2010 Jan-Feb.
- Harms PW: Update on Merkel Cell Carcinoma. Clin Lab Med 37 (3): 485-501, 2017.
- Nghiem P, McKee PH, Haynes HA: Merkel cell (cutaneous neuroendocrine) carcinoma. In: Sober AJ, Haluska FG, eds.: Skin Cancer. BC Decker Inc., 2001, pp 127-141.
- Nghiem P, James N: Merkel cell carcinoma. In: Wolff K, Goldsmith LA, Katz SI, et al., eds.: Fitzpatrick's Dermatology in General Medicine. 7th ed. McGraw-Hill , 2008, pp 1087-94.
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007.
- Medina-Franco H, Urist MM, Fiveash J, et al.: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol 8 (3): 204-8, 2001.
- Busse PM, Clark JR, Muse VV, et al.: Case records of the Massachusetts General Hospital. Case 19-2008. A 63-year-old HIV-positive man with cutaneous Merkel-cell carcinoma. N Engl J Med 358 (25): 2717-23, 2008.
- Rockville Merkel Cell Carcinoma Group: Merkel cell carcinoma: recent progress and current priorities on etiology, pathogenesis, and clinical management. J Clin Oncol 27 (24): 4021-6, 2009.
- Calder KB, Smoller BR: New insights into merkel cell carcinoma. Adv Anat Pathol 17 (3): 155-61, 2010.
- Cassler NM, Merrill D, Bichakjian CK, et al.: Merkel Cell Carcinoma Therapeutic Update. Curr Treat Options Oncol 17 (7): 36, 2016.
- Agelli M, Clegg LX: Epidemiology of primary Merkel cell carcinoma in the United States. J Am Acad Dermatol 49 (5): 832-41, 2003.
- Hodgson NC: Merkel cell carcinoma: changing incidence trends. J Surg Oncol 89 (1): 1-4, 2005.
- Young JL, Ward KC, Ries LAG: Cancer of rare sites. In: Ries LAG, Young JL, Keel GE, et al., eds.: SEER Survival Monograph: Cancer Survival Among Adults: U. S. SEER Program, 1988-2001, Patient and Tumor Characteristics. National Cancer Institute, 2007. NIH Pub. No. 07-6215, pp 251-61.
- Miller RW, Rabkin CS: Merkel cell carcinoma and melanoma: etiological similarities and differences. Cancer Epidemiol Biomarkers Prev 8 (2): 153-8, 1999.
- Albores-Saavedra J, Batich K, Chable-Montero F, et al.: Merkel cell carcinoma demographics, morphology, and survival based on 3870 cases: a population based study. J Cutan Pathol 37 (1): 20-7, 2010.
- Heath M, Jaimes N, Lemos B, et al.: Clinical characteristics of Merkel cell carcinoma at diagnosis in 195 patients: the AEIOU features. J Am Acad Dermatol 58 (3): 375-81, 2008.
- Paulson KG, Park SY, Vandeven NA, et al.: Merkel cell carcinoma: Current US incidence and projected increases based on changing demographics. J Am Acad Dermatol 78 (3): 457-463.e2, 2018.
- Ma JE, Brewer JD: Merkel cell carcinoma in immunosuppressed patients. Cancers (Basel) 6 (3): 1328-50, 2014.
- Howard RA, Dores GM, Curtis RE, et al.: Merkel cell carcinoma and multiple primary cancers. Cancer Epidemiol Biomarkers Prev 15 (8): 1545-9, 2006.
- Bzhalava D, Bray F, Storm H, et al.: Risk of second cancers after the diagnosis of Merkel cell carcinoma in Scandinavia. Br J Cancer 104 (1): 178-80, 2011.
- Lunder EJ, Stern RS: Merkel-cell carcinomas in patients treated with methoxsalen and ultraviolet A radiation. N Engl J Med 339 (17): 1247-8, 1998.
- Feng H, Shuda M, Chang Y, et al.: Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science 319 (5866): 1096-100, 2008.
- Garneski KM, Warcola AH, Feng Q, et al.: Merkel cell polyomavirus is more frequently present in North American than Australian Merkel cell carcinoma tumors. J Invest Dermatol 129 (1): 246-8, 2009.
- Becker JC, Houben R, Ugurel S, et al.: MC polyomavirus is frequently present in Merkel cell carcinoma of European patients. J Invest Dermatol 129 (1): 248-50, 2009.
- Kassem A, Schöpflin A, Diaz C, et al.: Frequent detection of Merkel cell polyomavirus in human Merkel cell carcinomas and identification of a unique deletion in the VP1 gene. Cancer Res 68 (13): 5009-13, 2008.
- Houben R, Schrama D, Becker JC: Molecular pathogenesis of Merkel cell carcinoma. Exp Dermatol 18 (3): 193-8, 2009.
- Paik JY, Hall G, Clarkson A, et al.: Immunohistochemistry for Merkel cell polyomavirus is highly specific but not sensitive for the diagnosis of Merkel cell carcinoma in the Australian population. Hum Pathol 42 (10): 1385-90, 2011.
- Andres C, Belloni B, Puchta U, et al.: Prevalence of MCPyV in Merkel cell carcinoma and non-MCC tumors. J Cutan Pathol 37 (1): 28-34, 2010.
- Kassem A, Technau K, Kurz AK, et al.: Merkel cell polyomavirus sequences are frequently detected in nonmelanoma skin cancer of immunosuppressed patients. Int J Cancer 125 (2): 356-61, 2009.
- Foulongne V, Dereure O, Kluger N, et al.: Merkel cell polyomavirus DNA detection in lesional and nonlesional skin from patients with Merkel cell carcinoma or other skin diseases. Br J Dermatol 162 (1): 59-63, 2010.
- DeCaprio JA: Does detection of Merkel cell polyomavirus in Merkel cell carcinoma provide prognostic information? J Natl Cancer Inst 101 (13): 905-7, 2009.
- Laude HC, Jonchère B, Maubec E, et al.: Distinct merkel cell polyomavirus molecular features in tumour and non tumour specimens from patients with merkel cell carcinoma. PLoS Pathog 6 (8): , 2010.
- Buck CB, Lowy DR: Immune readouts may have prognostic value for the course of merkel cell carcinoma, a virally associated disease. J Clin Oncol 29 (12): 1506-8, 2011.
- Lemos B, Nghiem P: Merkel cell carcinoma: more deaths but still no pathway to blame. J Invest Dermatol 127 (9): 2100-3, 2007.
- Seattle Cancer Care Alliance: Merkel Cell Carcinoma Information for Patients and Their Physicians: Clinical Photos/Images. Seattle, Wa: Seattle Cancer Care Alliance Skin Oncology Clinic, 2009.
Available online. Last accessed April 19, 2024. - Gupta SG, Wang LC, Peñas PF, et al.: Sentinel lymph node biopsy for evaluation and treatment of patients with Merkel cell carcinoma: The Dana-Farber experience and meta-analysis of the literature. Arch Dermatol 142 (6): 685-90, 2006.
- Anderson SE, Beer KT, Banic A, et al.: MRI of merkel cell carcinoma: histologic correlation and review of the literature. AJR Am J Roentgenol 185 (6): 1441-8, 2005.
- Iagaru A, Quon A, McDougall IR, et al.: Merkel cell carcinoma: Is there a role for 2-deoxy-2-[f-18]fluoro-D-glucose-positron emission tomography/computed tomography? Mol Imaging Biol 8 (4): 212-7, 2006 Jul-Aug.
- Belhocine T, Pierard GE, Frühling J, et al.: Clinical added-value of 18FDG PET in neuroendocrine-merkel cell carcinoma. Oncol Rep 16 (2): 347-52, 2006.
- Missotten GS, de Wolff-Rouendaal D, de Keizer RJ: Merkel cell carcinoma of the eyelid review of the literature and report of patients with Merkel cell carcinoma showing spontaneous regression. Ophthalmology 115 (1): 195-201, 2008.
- Richetta AG, Mancini M, Torroni A, et al.: Total spontaneous regression of advanced merkel cell carcinoma after biopsy: review and a new case. Dermatol Surg 34 (6): 815-22, 2008.
- Allen PJ, Bowne WB, Jaques DP, et al.: Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 23 (10): 2300-9, 2005.
- Stokes JB, Graw KS, Dengel LT, et al.: Patients with Merkel cell carcinoma tumors < or = 1.0 cm in diameter are unlikely to harbor regional lymph node metastasis. J Clin Oncol 27 (23): 3772-7, 2009.
- Jabbour J, Cumming R, Scolyer RA, et al.: Merkel cell carcinoma: assessing the effect of wide local excision, lymph node dissection, and radiotherapy on recurrence and survival in early-stage disease--results from a review of 82 consecutive cases diagnosed between 1992 and 2004. Ann Surg Oncol 14 (6): 1943-52, 2007.
- Henness S, Vereecken P: Management of Merkel tumours: an evidence-based review. Curr Opin Oncol 20 (3): 280-6, 2008.
- Skelton HG, Smith KJ, Hitchcock CL, et al.: Merkel cell carcinoma: analysis of clinical, histologic, and immunohistologic features of 132 cases with relation to survival. J Am Acad Dermatol 37 (5 Pt 1): 734-9, 1997.
- Sandel HD, Day T, Richardson MS, et al.: Merkel cell carcinoma: does tumor size or depth of invasion correlate with recurrence, metastasis, or patient survival? Laryngoscope 116 (5): 791-5, 2006.
- Llombart B, Monteagudo C, López-Guerrero JA, et al.: Clinicopathological and immunohistochemical analysis of 20 cases of Merkel cell carcinoma in search of prognostic markers. Histopathology 46 (6): 622-34, 2005.
- Senchenkov A, Barnes SA, Moran SL: Predictors of survival and recurrence in the surgical treatment of merkel cell carcinoma of the extremities. J Surg Oncol 95 (3): 229-34, 2007.
- Goldberg SR, Neifeld JP, Frable WJ: Prognostic value of tumor thickness in patients with Merkel cell carcinoma. J Surg Oncol 95 (8): 618-22, 2007.
- Heath ML, Nghiem P: Merkel cell carcinoma: if no breslow, then what? J Surg Oncol 95 (8): 614-5, 2007.
- Tai P: Merkel cell cancer: update on biology and treatment. Curr Opin Oncol 20 (2): 196-200, 2008.
- Andea AA, Coit DG, Amin B, et al.: Merkel cell carcinoma: histologic features and prognosis. Cancer 113 (9): 2549-58, 2008.
- Paulson KG, Iyer JG, Tegeder AR, et al.: Transcriptome-wide studies of merkel cell carcinoma and validation of intratumoral CD8+ lymphocyte invasion as an independent predictor of survival. J Clin Oncol 29 (12): 1539-46, 2011.
- Fields RC, Busam KJ, Chou JF, et al.: Recurrence and survival in patients undergoing sentinel lymph node biopsy for merkel cell carcinoma: analysis of 153 patients from a single institution. Ann Surg Oncol 18 (9): 2529-37, 2011.
- Sihto H, Kukko H, Koljonen V, et al.: Clinical factors associated with Merkel cell polyomavirus infection in Merkel cell carcinoma. J Natl Cancer Inst 101 (13): 938-45, 2009.
- Harms KL, Healy MA, Nghiem P, et al.: Analysis of Prognostic Factors from 9387 Merkel Cell Carcinoma Cases Forms the Basis for the New 8th Edition AJCC Staging System. Ann Surg Oncol 23 (11): 3564-3571, 2016.
- Iyer JG, Storer BE, Paulson KG, et al.: Relationships among primary tumor size, number of involved nodes, and survival for 8044 cases of Merkel cell carcinoma. J Am Acad Dermatol 70 (4): 637-643, 2014.
- Schwartz JL, Griffith KA, Lowe L, et al.: Features predicting sentinel lymph node positivity in Merkel cell carcinoma. J Clin Oncol 29 (8): 1036-41, 2011.
- Ko JS, Prieto VG, Elson PJ, et al.: Histological pattern of Merkel cell carcinoma sentinel lymph node metastasis improves stratification of Stage III patients. Mod Pathol 29 (2): 122-30, 2016.
- Eng TY, Boersma MG, Fuller CD, et al.: Treatment of merkel cell carcinoma. Am J Clin Oncol 27 (5): 510-5, 2004.
Clasificación celular del carcinoma de células de Merkel
Aunque el origen y la función exactas de las células de Merkel permanecen bajo investigación, se piensa que tienen características de origen tanto epitelial como neuroendocrino y que surgen de células con función de sensibilidad al tacto (mecanorreceptores).[
Las características histopatológicas incluyen gránulos neurosecretores en el citoplasma con centros densos detectados mediante microscopia electrónica y análisis inmunohistoquímico con citoqueratina 20 (consultar la
Un panel de reactivos inmunitarios (consultar la 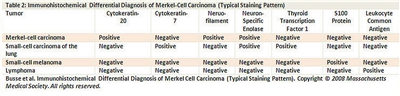
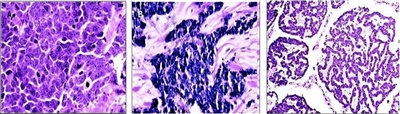
Desde el punto de vista histológico, el CCM se clasificó en tres subtipos diferentes:[
- Trabecular: estructura clásica, tipo de célula grande, densidad alta o gránulos detectados mediante examen ecográfico.
- Intermedio: estructura sólida (más común).
- Células pequeñas: difuso, pocos gránulos de densidad alta detectados mediante examen ecográfico (segundo tipo más común).
Son comunes las mezclas de variantes.[
Un grupo indicó una lista de 12 elementos que se deberían describir en los informes patológicos de las lesiones primarias resecadas y 9 elementos que se describen en los informes de patología de los ganglios linfáticos centinela. La importancia pronóstica de estos elementos no ha sido validada de forma prospectiva.[
Si los siguientes datos quedan registrados para cada paciente con CCM, se puede estadificar a cualquier paciente con el sistema de estadificación disponible o con un nuevo sistema de estadificación:
- Tamaño del tumor primario (dimensión patológica o clínica máxima en centímetros).
- Presencia o ausencia de invasión tumoral primaria en el hueso, el músculo, la fascia o el cartílago.
- Presencia o ausencia de metástasis ganglionares.
- Método usado en la evaluación del estado del compromiso ganglionar (examen clínico o patológico).
- Presencia o ausencia de metástasis a distancia.
El College of American Pathologists publicó un protocolo para el examen de muestras de pacientes con CCM de la piel.[
Para obtener más información, consultar la sección
Las variantes histológicas del CCM se presentan en la
Referencias:
- Nghiem P, McKee PH, Haynes HA: Merkel cell (cutaneous neuroendocrine) carcinoma. In: Sober AJ, Haluska FG, eds.: Skin Cancer. BC Decker Inc., 2001, pp 127-141.
- Bichakjian CK, Nghiem P, Johnson T, et al.: Merkel Cell Carcinoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 549-62.
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007.
- Medina-Franco H, Urist MM, Fiveash J, et al.: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol 8 (3): 204-8, 2001.
- Busse PM, Clark JR, Muse VV, et al.: Case records of the Massachusetts General Hospital. Case 19-2008. A 63-year-old HIV-positive man with cutaneous Merkel-cell carcinoma. N Engl J Med 358 (25): 2717-23, 2008.
- Haag ML, Glass LF, Fenske NA: Merkel cell carcinoma. Diagnosis and treatment. Dermatol Surg 21 (8): 669-83, 1995.
- Ratner D, Nelson BR, Brown MD, et al.: Merkel cell carcinoma. J Am Acad Dermatol 29 (2 Pt 1): 143-56, 1993.
- Gould VE, Moll R, Moll I, et al.: Neuroendocrine (Merkel) cells of the skin: hyperplasias, dysplasias, and neoplasms. Lab Invest 52 (4): 334-53, 1985.
- Albores-Saavedra J, Batich K, Chable-Montero F, et al.: Merkel cell carcinoma demographics, morphology, and survival based on 3870 cases: a population based study. J Cutan Pathol 37 (1): 20-7, 2010.
- Alam M: Management of Merkel cell carcinoma: What we know. Arch Dermatol 142 (6): 771-4, 2006.
- Heath ML, Nghiem P: Merkel cell carcinoma: if no breslow, then what? J Surg Oncol 95 (8): 614-5, 2007.
- Andea AA, Coit DG, Amin B, et al.: Merkel cell carcinoma: histologic features and prognosis. Cancer 113 (9): 2549-58, 2008.
- Bichakjian CK, Lowe L, Lao CD, et al.: Merkel cell carcinoma: critical review with guidelines for multidisciplinary management. Cancer 110 (1): 1-12, 2007.
- Rao P, Balzer BL, Lemos BD, et al.: Protocol for the examination of specimens from patients with merkel cell carcinoma of the skin. Arch Pathol Lab Med 134 (3): 341-4, 2010.
- Goessling W, McKee PH, Mayer RJ: Merkel cell carcinoma. J Clin Oncol 20 (2): 588-98, 2002.
Información sobre los estadios del carcinoma de células de Merkel
Anteriormente, en la mayoría de las publicaciones se utilizaron cinco sistemas de estadificación, que compiten entre sí, para describir el carcinoma de células de Merkel (CCM).
| Primer Autor | Fecha de publicación | Institución(es) | No. de pacientes en las series de casos | Fechas de los casos |
|---|---|---|---|---|
| MSKCC = Memorial Sloan Kettering Cancer Center; N/A = No aplicable. | ||||
| a El sistema del MSKCC ha evolucionado con el tiempo. Los autores del MSKCC publicaron una serie adicional de casos con 256 pacientes.[ |
||||
| Yiengpruksawan[ |
1991 | MSKCCa | 77 | 1969–1989 |
| Allen[ |
1999 | MSKCCa | 102 | 1969–1996 |
| Allen[ |
2005 | MSKCCa | 250 | 1970–2002 |
| American Joint Committee on Cancer[ |
2017 | N/A | N/A | |
| Clark[ |
2007 | Westmead Hospital, Sidney, Australia | 110 | |
| Princess Margaret Hospital/University Health Network, Toronto, Canadá | ||||
| Sydney Head and Neck Cancer Institute/Royal Prince Alfred Hospital, Sidney, Australia | ||||
Estos sistemas de estadificación son sumamente contradictorios entre sí. La enfermedad en estadio III puede significar cualquier cosa desde enfermedad local avanzada hasta enfermedad ganglionar o enfermedad metastásica a distancia. Además, todos los sistemas de estadificación del CCM en uso se basan en menos de 300 pacientes.
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
Para abordar estos problemas, el American Joint Committee on Cancer (AJCC) estableció un nuevo sistema de estadificación de consenso específico para definir el CCM.[
Entre los cánceres estadificados con este sistema se incluye el carcinoma neuroendocrino cutáneo primario.
Grupo de estadio clínico (cTNM)
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínico. | ||
| a Reproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| 0 | Tis, N0, M0 | Tis = tumor primarioin situ. |
| N0 = sin metástasis en ganglios linfáticos regionales detectadas en la exploración clínica o radiológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínico. | ||
| a Reproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| I | T1, N0, M0 | T1 = diámetro clínico máximo del tumor ≤2 cm. |
| N0 = sin metástasis en ganglios linfáticos regionales detectadas en la exploración clínica o radiológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínico. | ||
| a Reproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| IIA | T2–3, N0, M0 | T2 = diámetro clínico máximo del tumor >2 cm, pero ≤5 cm. |
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| N0 = sin metástasis en ganglios linfáticos regionales detectadas en la exploración clínica o radiológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| IIB | T4, N0, M0 | T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. |
| N0 = sin metástasis en ganglios linfáticos regionales detectadas en la exploración clínica o radiológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínico. | ||
| a Reproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| III | T0–4, N1–3, M0 | T0 = sin indicios de tumor primario. |
| Tis = tumor primarioin situ. | ||
| T1 = diámetro clínico máximo del tumor ≤2 cm. | ||
| T2 = diámetro clínico máximo del tumor >2, pero ≤5 cm. | ||
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. | ||
| N1 = metástasis en ganglios linfáticos regionales. | ||
| N2 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario)sin metástasis en ganglios linfáticos. | ||
| N3 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario)con metástasis en ganglios linfáticos. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; c = clínico. | ||
| a Reproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| IV | T0–4, cualquier N, M1 | T0 = sin indicios de tumor primario. |
| Tis = tumor primarioin situ. | ||
| T1 = diámetro clínico máximo del tumor ≤2 cm. | ||
| T2 = diámetro clínico máximo del tumor >2, pero ≤5 cm. | ||
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. | ||
| NX = ganglios linfáticos regionales no evaluables por métodos clínicos (por ejemplo, se extirparon antes por otro motivo, o por constitución). | ||
| N0 = sin metástasis en ganglios linfáticos regionales detectadas en la exploración clínica o radiológica. | ||
| N1 = metástasis en ganglios linfáticos regionales. | ||
| N2 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario)sin metástasis en ganglios linfáticos. | ||
| N3 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario)con metástasis en ganglios linfáticos. | ||
| M1 = metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
Grupo de estadio patológico (pTNM)
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico. | ||
| a Reproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| 0 | Tis, pN0, M0 | Tis = tumor primarioin situ. |
| pN0 = sin metástasis en ganglios linfáticos regionales detectadas en la evaluación patológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico. | ||
| a Reproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| I | T1, pN0, M0 | T1 = diámetro clínico máximo del tumor ≤2 cm. |
| pN0 = sin metástasis en ganglios linfáticos regionales detectadas en la evaluación patológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico. | ||
| a Reproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| IIA | T2–3, pN0, M0 | T2 = diámetro clínico máximo del tumor >2, pero ≤5 cm. |
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| pN0 = sin metástasis en ganglios linfáticos regionales detectadas en la evaluación patológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| IIB | T4, pN0, M0 | T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. |
| pN0 = sin metástasis en ganglios linfáticos regionales detectadas en la evaluación patológica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico. | ||
| a Reproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| IIIA | T1–4, pN1a(sn) o pN1a, M0 | T1 = diámetro clínico máximo del tumor ≤2 cm. |
| T2 = diámetro clínico máximo del tumor >2 cm, pero ≤5 cm. | ||
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. | ||
| pN1a(sn) = metástasis en ganglio linfático regional oculta en la evaluación clínica que se identifica únicamente mediante biopsia del ganglio linfático centinela. | ||
| pN1a = metástasis en ganglio linfático regional oculta en la evaluación clínica después de una disección de ganglio linfático. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| T0, pN1b, M0 | T0 = sin indicios de tumor primario. | |
| pN1b = metástasis en ganglio linfático regional detectada mediante exploración clínica o radiológica, confirmada en la evaluación microscópica. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| IIIB | T1–4, pN1b–3, M0 | T1 = diámetro clínico máximo del tumor ≤2 cm. |
| T2 = diámetro clínico máximo del tumor >2 cm, pero ≤5 cm. | ||
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. | ||
| pN1b = metástasis en ganglio linfático regional detectada mediante exploración clínica o radiológica, confirmada en la evaluación microscópica. | ||
| pN2 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario)sin metástasis en ganglios linfáticos. | ||
| pN3 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario)con metástasis en ganglios linfáticos. | ||
| M0 = sin metástasis a distancia detectadas en la exploración clínica o radiológica. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia; p = patológico. | ||
| a Reproducción autorizada de AJCC: Merkel Cell Carcinoma. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 549–62. | ||
| IV | T0–4, cualquier pN, pM1 | T0 = sin indicios de tumor primario. |
| T1 = diámetro clínico máximo del tumor ≤2 cm. | ||
| T2 = diámetro clínico máximo del tumor >2 cm, pero ≤5 cm. | ||
| T3 = diámetro clínico máximo del tumor >5 cm. | ||
| T4 = tumor primario con invasión de la fascia, el músculo, el cartílago o el hueso. | ||
| pNX = ganglios linfáticos regionales no evaluables (por ejemplo, se extirparon antes por otro motivo ono se extirparon para evaluación patológica). | ||
| pN0 = sin metástasis en ganglios linfáticos regionales detectadas en la evaluación patológica. | ||
| pN1 = metástasis en ganglios linfáticos regionales. | ||
| –pN1a(sn) = metástasis en ganglio linfático regional oculta en la evaluación clínica que se identifica únicamente mediante biopsia del ganglio linfático centinela. | ||
| –pN1a = metástasis en ganglio linfático regional oculta en la evaluación clínica después de una disección de ganglio linfático. | ||
| –pN1b = metástasis en ganglio linfático regional detectada mediante exploración clínica o radiológica, confirmada en la evaluación microscópica. | ||
| pN2 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario)sin metástasis en ganglios linfáticos. | ||
| pN3 = metástasis en tránsito (separadas del tumor primario; ubicadas entre el tumor primario y la cuenca de drenaje ganglionar regional, o alejadas del tumor primario)con metástasis en ganglios linfáticos. | ||
| pM1 = metástasis a distancia confirmadas en la evaluación microscópica. | ||
| –pM1a = metástasis a distancia en la piel, el tejido celular subcutáneo o en ganglios linfáticos regionales, confirmadas en la evaluación microscópica. | ||
| –pM1b = metástasis en el pulmón, confirmada en la evaluación microscópica. | ||
| pM1c = metástasis en todos los otros sitios distantes, confirmadas en la evaluación microscópica. | ||
Antes de la publicación del nuevo sistema de estadificación de consenso del AJCC, se favoreció el más reciente sistema de cuatro etapas del Memorial Sloan Kettering Cancer Center (MSKCC) porque se basaba en un mayor número de pacientes y era el de mejor validación.[
- Estadio I: enfermedad local que mide <2 cm.
- Estadio II: enfermedad local que mide ≥2 cm.
- Estadio III: enfermedad ganglionar regional.
- Estadio IV: enfermedad metastásica a distancia.
Un grupo indicó una lista de 12 elementos que se deben describir en los informes patológicos de lesiones primarias resecadas y 9 elementos que se describen en los informes patológicos de los ganglios linfáticos centinelas. La importancia pronóstica de estos elementos no ha sido validada de forma prospectiva.[
Referencias:
- Andea AA, Coit DG, Amin B, et al.: Merkel cell carcinoma: histologic features and prognosis. Cancer 113 (9): 2549-58, 2008.
- Yiengpruksawan A, Coit DG, Thaler HT, et al.: Merkel cell carcinoma. Prognosis and management. Arch Surg 126 (12): 1514-9, 1991.
- Allen PJ, Zhang ZF, Coit DG: Surgical management of Merkel cell carcinoma. Ann Surg 229 (1): 97-105, 1999.
- Allen PJ, Bowne WB, Jaques DP, et al.: Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 23 (10): 2300-9, 2005.
- Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017.
- Clark JR, Veness MJ, Gilbert R, et al.: Merkel cell carcinoma of the head and neck: is adjuvant radiotherapy necessary? Head Neck 29 (3): 249-57, 2007.
- Bichakjian CK, Nghiem P, Johnson T, et al.: Merkel Cell Carcinoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 549-62.
- Bichakjian CK, Lowe L, Lao CD, et al.: Merkel cell carcinoma: critical review with guidelines for multidisciplinary management. Cancer 110 (1): 1-12, 2007.
Aspectos generales de las opciones de tratamiento del carcinoma de células de Merkel
El carcinoma de células de Merkel (CCM) es un tumor poco común. La mayoría de las recomendaciones clínicas para su tratamiento que se encuentran en la bibliografía se basan en series de casos que describen un número relativamente reducido de pacientes que no participaron en ensayos clínicos formales, no se evaluaron con procedimientos de estadificación clínica uniformes, no se trataron con protocolos de tratamiento uniformes ni se les recomendó un seguimiento regular. Estos informes también tienen posibles factores de confusión debidos a posibles sesgos de selección y verificación, así como un seguimiento breve. Tampoco tienen la potencia para detectar diferencias moderadas en el desenlace.
Además, los desenlaces de pacientes con enfermedad en estadio I y estadio II según el American Joint Committee on Cancer a menudo se notifican juntos. A falta de resultados de ensayos clínicos con exámenes, tratamientos y seguimiento prescritos, la mayoría de los pacientes con CCM se trataron usando preferencias institucionales o profesionales que consideran los elementos específicos de cada caso, así como las preferencias de los pacientes.
Hay dos filosofías divergentes acerca del método más apropiado para tratar un CCM. Según la primera filosofía, el CCM se trata como otros cánceres de piel no melanoma, con énfasis en el tratamiento de la enfermedad locorregional con cirugía y radioterapia según resulte apropiado. Según la segunda filosofía, el CCM se trata de acuerdo con las características biológicas. Este abordaje es análogo al del cáncer de pulmón de células pequeñas, que se supone es una enfermedad sistémica, y conduce a una recomendación más rutinaria para usar la quimioterapia sistémica adyuvante.[
Cirugía de la lesión primaria
En una revisión de 18 series de casos, 279 de 926 pacientes (30,1 %) presentaron recidiva local durante el seguimiento, con exclusión de los que sufrían de enfermedad metastásica a distancia en el momento de la presentación inicial. Estas recidivas se atribuyeron normalmente a márgenes quirúrgicos inadecuados o, posiblemente, a una falta de radioterapia adyuvante.[
Dado la propensión del CCM a recidivar localmente (a veces con lesiones satélites o metástasis en tránsito), se recomendó la extirpación local amplia para reducir el riesgo de recidiva local en los pacientes con enfermedad en estadios clínicos I o II.
Las recomendaciones acerca del ancho y la profundidad mínimas adecuadas para el margen tisular normal que se extirpa alrededor del tumor primario varían entre las diversas series retrospectivas de casos, pero este tema no se ha estudiado de manera sistemática.[
Algunos autores han preconizado el uso de la cirugía micrográfica de Mohs como una técnica que preserva el tejido. La tasa de recaída notificada es similar o mejor que la de la extirpación amplia, pero se trataron relativamente pocos casos de esta manera y ninguno en ensayos controlados aleatorizados.[
Cirugía de ganglio linfático regional
En algunas series de casos, las tasas de recidiva locorregional son altas cuando se omite la estadificación ganglionar patológica. La estadificación ganglionar quirúrgica en pacientes sin compromiso clínico permitió identificar ganglios con compromiso tumoral en el 25 % al 35 % de los pacientes.[
La función de la disección electiva de ganglios linfáticos (DEGL), cuando no hay compromiso clínico ganglionar, no se ha estudiado en ensayos clínicos formales. En las series de casos pequeñas, se recomendó la DEGL para los tumores primarios más grandes, los tumores con más de 10 mitosis por campo de gran aumento, invasión linfática o vascular, y los subtipos histológicos de células pequeñas.[
Se indicó la biopsia del ganglio linfático centinela (GLC) como la opción inicial preferida para completar la DEGL durante una estadificación adecuada del CCM. La biopsia del GLC produce menos morbilidad que la disección ganglionar completa. Además, para los sitios del CCM con drenaje linfático indeterminado, como aquellos en la espalda, se pueden usar técnicas de biopsia del GLC para identificar los lechos apropiados de ganglios linfáticos. Si se realiza, la biopsia del GLC se hace en el momento de la resección amplia, cuando los canales linfáticos locales todavía están intactos.
En varios informes, se encontró que el uso de técnicas de biopsia del GLC para el CCM es confiable y reproducible.[
- En un metanálisis de diez series de casos se encontró que el compromiso del GLC predijo firmemente un riesgo alto de recidiva a corto plazo y que la disección ganglionar terapéutica posterior fue eficaz para prevenir la recidiva ganglionar regional a corto plazo.[
21 ] - En otro metanálisis se incluyeron 12 series de casos retrospectivos (solo con coincidencia parcial con la colección de series de casos del metanálisis anterior).[
12 ][Nivel de evidencia C2]- La biopsia del GLC detectó la diseminación del CCM en un tercio de los pacientes cuyos tumores, de otro modo, se habrían subestadificado clínica y radiológicamente.
- La tasa de recidiva fue tres veces más alta en los pacientes con una biopsia del GLC que mostró cáncer en comparación con aquellos en los que no se observó cáncer en la biopsia del GLC (P = 0,03).
- Entre 2006 y 2010, en una serie retrospectiva grande de una sola institución con 95 pacientes (97 tumores primarios) se identificó un GLC en 93 casos, y se observaron tumores ganglionares en 42 pacientes. Se usaron técnicas inmunohistoquímicas para evaluar el compromiso ganglionar. Varios modelos de tumores y características de los pacientes se estudiaron a fin de predecir el compromiso ganglionar. No hubo un subgrupo de pacientes con predicción de menos del 15 % al 20 % de probabilidad de compromiso del GLC, lo que indicó que se podría considerar hacer la biopsia del GLC para todos los pacientes con posibilidad de curación que no tienen compromiso clínico de los ganglios linfáticos o metástasis a distancia.[
22 ][Nivel de evidencia C2] - De 1996 a 2010, en otro ensayo retrospectivo de una sola institución en 153 pacientes con CCM localizado que se sometieron a biopsia del GLC, se analizaron los factores relacionados con el compromiso del GLC. Los mejores factores pronósticos para una biopsia del GLC que muestre cáncer fueron el tamaño del tumor y la invasión linfovascular.[
22 ,23 ][Nivel de evidencia C2]
A falta de ensayos clínicos aleatorizados y prospectivos con potencia adecuada, quedan pendientes las siguientes preguntas:[
- ¿Debería cada biopsia del GLC con resultado que muestre compromiso por cáncer seguirse de manera sistemática de una cirugía ganglionar definitiva o radioterapia?
- ¿Se podría demostrar que los desenlaces mejoran al agregar radiación de manera sistemática cuando la cirugía de ganglios linfáticos revela tumores en múltiples ganglios, diseminación extracapsular o invasión linfovascular?
- ¿Los pacientes con CCM que miden menos de 1 cm se deben someter de manera sistemática a una disección del ganglio linfático centinela (DGLC)?
- ¿Deberían los pacientes sin examen ganglionar o en quienes no se encontró compromiso ganglionar ser sometidos de manera sistemática a radioterapia local o locorregional?
- ¿Deberían las técnicas de tinción inmunohistoquímica utilizarse para identificar las micrometástasis de ganglios linfáticos?, ¿tiene relevancia clínica la enfermedad micrometastásica en los ganglios?
La cirugía de ganglios linfáticos se usa de manera primaria para la estadificación y para guiar los tratamientos adicionales.
A partir de un número reducido de estudios retrospectivos, la disección terapéutica de los ganglios linfáticos regionales después de una DGLC que muestra compromiso por cáncer parece reducir al mínimo, pero no eliminar por completo, el riesgo posterior de recidiva en los ganglios regionales y de metástasis en tránsito.[
Radioterapia
Debido a la gran malignidad que caracteriza al CCM, su evidente radiosensibilidad y la incidencia elevada de recidivas locales y regionales (como las metástasis en tránsito después de una cirugía solo en el lecho del tumor), algunos médicos recomendaron radioterapia adyuvante dirigida al sitio primario y a la cuenca ganglionar. Se ha considerado la radiación dirigida a la cuenca ganglionar administrada al mismo tiempo que la radiación dirigida al sitio primario, en especial, para pacientes con tumores más grandes, tumores localmente inoperables, márgenes de extirpación estrechos o con compromiso tumoral que no se pueden mejorar con cirugía adicional y aquellos con ganglios regionales comprometidos, en especial, después de una DGLC (estadio II).[
A falta de ensayos clínicos aleatorizados y prospectivos con potencia adecuada, quedan pendientes las siguientes preguntas:[
- ¿Debería cada biopsia del GLC con resultado que muestre compromiso por cáncer seguirse de manera sistemática de una cirugía ganglionar definitiva o radioterapia?
- ¿Se podría demostrar que los desenlaces mejoran al agregar radiación de manera sistemática cuando la cirugía de ganglios linfáticos revela tumores en múltiples ganglios, diseminación extracapsular o invasión linfovascular?
- ¿Deberían los pacientes sin examen ganglionar o en quienes no se encontró compromiso ganglionar ser sometidos de manera sistemática a radioterapia local o locorregional?
Debido a lo pequeño de estas series retrospectivas no aleatorizadas, no se ha comprobado que la radioterapia muestre alguna ventaja específica.
Cuando se recomienda, la dosis de radiación suele ser por lo menos de 50 Gy en fracciones de 2 Gy dirigidas al lecho quirúrgico con márgenes y a los vasos linfáticos regionales de drenaje. Para pacientes con tumores no resecados o tumores con evidencia de diseminación microscópica más allá de los márgenes resecados, se recomendaron dosis más altas de entre 56 Gy y 65 Gy dirigidas al sitio primario.[
En series de casos pequeñas con pacientes muy seleccionados, no aleatorizados y con diversas características clínicas, se ha informado de control local o regional del CCM con radioterapia sola.[
Los datos del Retrospective Surveillance, Epidemiology and End Results (SEER) Program indican que añadir radioterapia a la cirugía confiere una ventaja de supervivencia, pero las conclusiones resultan complicadas debido a los datos incompletos de los pacientes, la ausencia de un protocolo para la evaluación y el tratamiento, y el posible sesgo del muestreo.[
Inmunoterapia
Cerca del 70 % al 80 % de los casos de CCM en los Estados Unidos obedecen al poliomavirus de células de Merkel (MCPyV). Entre los CCM que presentan el virus, las oncoproteínas víricas (antígenos T) se expresan constitutivamente y promueven el crecimiento. Además, los pacientes con respuesta inmunitaria estimulada frente al MCPyV exhiben mejores desenlaces de la enfermedad, lo que proporciona un fundamento para el uso de la inmunoterapia. Aunque hay pocos ensayos aleatorizados, varios inhibidores de puntos de control inmunitario han demostrado mejorar la supervivencia y presentan buena tolerabilidad en pacientes con CCM avanzado, en comparación con la quimioterapia usada en los controles históricos. Por lo tanto, los inhibidores de puntos de control inmunitario se consideran el tratamiento de primera línea recomendado para la mayoría de pacientes. Hay ensayos en curso para evaluar el uso de los inhibidores de puntos de control inmunitario en el entorno neoadyuvante y adyuvante.
Avelumab
El avelumab es un anticuerpo monoclonal contra el ligando 1 de muerte programada (PD-L1).
Evidencia (avelumab):
- En un ensayo de fase II (JAVELIN Merkel 200 [NCT02155647]), un grupo de 88 pacientes con CCM metastásico recibió avelumab (10 mg/kg intravenoso [IV] cada 2 semanas). Estos pacientes habían recibido antes quimioterapia.[
37 ]- La tasa de respuesta objetiva fue del 33 %, y el 11 % de los pacientes presentó una respuesta completa. La mediana de tiempo hasta la respuesta fue de 6,1 semanas y fue independiente del estado del MCPyV o PD-L1. Las respuestas fueron duraderas; el 74 % duró más de 1 año. La mediana de SG fue de 12,6 meses, más del doble de la mediana histórica obtenida con la quimioterapia de segunda línea.
A partir de los resultados de este estudio, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el avelumab en 2017 para el tratamiento de pacientes con CCM metastásico, sin importar el antecedente de administración de quimioterapia.[
37 ,38 ,39 ] - El avelumab también se estudió en el entorno de primera línea en un ensayo de fase II de un solo grupo de 116 pacientes.[
40 ]- Al cabo de una mediana de seguimiento de 21,2 meses, el 30,2% (intervalo de confianza [IC] 95 %, 22,0–39,4 %) de los pacientes tenía una respuesta duradera (>6 meses). La tasa de respuesta objetiva fue del 39,7 %, y la mediana de SG fue de 20,3 meses (IC 95 %, 12,4–no estimable).[
40 ][Nivel de evidencia C3] - En el análisis exploratorio se encontró que las respuestas fueron más altas en los pacientes con expresión de PD-L1 y en aquellos con resultados negativos para MCPyV.
- Al cabo de una mediana de seguimiento de 21,2 meses, el 30,2% (intervalo de confianza [IC] 95 %, 22,0–39,4 %) de los pacientes tenía una respuesta duradera (>6 meses). La tasa de respuesta objetiva fue del 39,7 %, y la mediana de SG fue de 20,3 meses (IC 95 %, 12,4–no estimable).[
Pembrolizumab
El pembrolizumab es un anticuerpo monoclonal humanizado de tipo IgG4 contra la proteína 1 de muerte celular programada (PD-1).
Evidencia (pembrolizumab):
- El pembrolizumab se estudió en un ensayo de fase II (NCT02267603) de tratamiento sistémico primario para pacientes con CCM en estadio IIIB irresecable o estadio IV. Un grupo de 50 pacientes se sometió a tratamiento.[
41 ][Nivel de evidencia C3]- La tasa de respuesta objetiva fue del 58 % (IC 95 %, 43,2–71,8 %); el 30 % de los pacientes presentó respuesta completa y el 28 %, respuesta parcial. Si bien la tasa de respuesta fue similar a las tasas históricas de la quimioterapia de primera línea, las respuestas al pembrolizumab duraron más. La mediana de supervivencia sin progresión (SSP) fue de 16,8 meses (IC 95 %, 4,6–43,4), y la tasa de SG a 3 años fue del 59,4 %.
La FDA aprobó el pembrolizumab en diciembre de 2018.
Retifanlimab
El retifanlimab es un anticuerpo monoclonal anti–PD-1.
Evidencia (retifanlimab):
- El retifanlimab se evaluó en un ensayo de fase II (POD1UM-201 [NCT03599713]), publicado como resumen, de 101 pacientes con CCM avanzado sin tratamiento previo. Los pacientes recibieron 500 mg intravenoso (IV) cada 4 semanas.[
42 ,43 ]- En los resultados preliminares después de una mediana de seguimiento de 17,6 meses se observó una tasa de respuesta completa del 16,8 %, una tasa de respuesta parcial del 38,6 %, y una tasa de respuesta general del 53,5 % (IC 95 %, 43,3–63,5 %).[
42 ,43 ][Nivel de evidencia C3] - La mediana de SSP fue de 12,7 meses (IC 95 %, 7,3–24,9) y la mediana de duración de la respuesta fue de 25,3 meses (IC 95 %, 14,2–no estimable). La mediana de SG no se había alcanzado hasta el momento de la evaluación.
A partir de los resultados de este ensayo, la FDA otorgó la aprobación acelerada para el retifanlimab en mayo de 2023.
- En los resultados preliminares después de una mediana de seguimiento de 17,6 meses se observó una tasa de respuesta completa del 16,8 %, una tasa de respuesta parcial del 38,6 %, y una tasa de respuesta general del 53,5 % (IC 95 %, 43,3–63,5 %).[
Nivolumab
El nivolumab es un anticuerpo monoclonal anti–PD-1.
Evidencia (nivolumab):
- El nivolumab se estudió en un ensayo de fase I/II (CheckMate 358 [NCT02488759]), publicado como resumen, en pacientes con cánceres asociados con virus, como el CCM. Se aceptaron pacientes con antecedentes de hasta 2 líneas de tratamiento previas. Los pacientes con CCM metastásico podían participar sin importar el estado respecto al MCPyV ni el antecedente de quimioterapia.[
44 ,45 ]- Los datos de 25 pacientes con enfermedad metastásica mostraron una tasa de respuesta general del 60 % al cabo de una mediana de duración del tratamiento de 15,8 meses. En los resultados preliminares se notificó una tasa de respuesta continuada del 87 %, y respuestas en 13 de 15 pacientes en el momento del último seguimiento (mediana de seguimiento, 6 meses).[
44 ,45 ][Nivel de evidencia C3] - Este ensayo incluyó una segunda cohorte para investigar nivolumab y ipilimumab (1 mg/kg) en pacientes con CCM metastásico.
La FDA no ha autorizado el uso de nivolumab para el tratamiento del CCM.
- Los datos de 25 pacientes con enfermedad metastásica mostraron una tasa de respuesta general del 60 % al cabo de una mediana de duración del tratamiento de 15,8 meses. En los resultados preliminares se notificó una tasa de respuesta continuada del 87 %, y respuestas en 13 de 15 pacientes en el momento del último seguimiento (mediana de seguimiento, 6 meses).[
Quimioterapia
En los pacientes con CCM, se ha utilizado una variedad de regímenes quimioterapéuticos en los entornos de terapia adyuvante, enfermedad avanzada y recidivante.[
- Se estableció una analogía biológica entre el CCM y el carcinoma de células pequeñas de pulmón que tiene características histológicas similares y se considera una enfermedad sistémica.
- El riesgo de metástasis y progresión del CCM es alto.
- Se observaron buenas tasas de respuesta clínica inicial con algunos regímenes quimioterapéuticos.
Siempre que sea posible, se debe alentar la participación de los pacientes en ensayos clínicos.
Desde 1997 a 2001, el Trans-Tasman Radiation Oncology Group realizó una evaluación de fase II que incluyó a 53 pacientes con CCM y enfermedad locorregional de riesgo alto. El riesgo alto se definió como una recidiva que se presenta después del tratamiento inicial, ganglios linfáticos comprometidos, tumor primario mayor de 1 cm, enfermedad residual macroscópica después de la cirugía o tumor primario oculto con ganglios linfáticos comprometidos. El tratamiento incluyó radioterapia locorregional (50 Gy en 25 fracciones), carboplatino simultáneo (área bajo la curva [ABC] 4,5) y etopósido IV (89 mg/m2 los días 1 a 3 de las semanas 1, 4, 7 y 10). La cirugía no se estandarizó ni para el tumor primario ni los ganglios linfáticos, y 12 pacientes tenían márgenes estrechos, márgenes con compromiso tumoral o enfermedad residual macroscópica. A 28 pacientes no se les extirparon los lechos ganglionares y el resto se sometió a diversas cirugías ganglionares. Después de una mediana de seguimiento de 48 meses, la tasa de SG a 3 años fue del 76 %, la tasa de control locorregional fue del 75 % y la tasa de control a distancia fue del 76 %. Las reacciones de la piel a la radiación y la neutropenia febril fueron reacciones clínicas tóxicas agudas importantes. Dada la heterogeneidad de la población y la cirugía no estandarizada, es difícil inferir un beneficio terapéutico claro de la quimioterapia.[
En un informe posterior, los mismos investigadores evaluaron a un subconjunto de estos pacientes del protocolo (N = 40, después de excluir a los pacientes con tumores primarios desconocidos). Este grupo de pacientes se comparó con un grupo de 61 controles históricos tratados en las mismas instituciones sin quimioterapia, que recibieron el diagnóstico antes de 1997 y que no contaban con estudios rutinarios de estadificación por imágenes. Se administró radioterapia a 50 pacientes. No se observó ningún beneficio significativo de la supervivencia para los pacientes que recibieron quimioterapia.[
En un ensayo clínico piloto posterior con 18 pacientes realizado entre 2004 y 2006, los mismos investigadores intentaron reducir la toxicidad dérmica y hematológica observada en el Study 96-07. El carboplatino (ABC, 2) se administró semanalmente durante la radioterapia desde el día 1 por un máximo de 5 dosis, seguidas de 3 ciclos de carboplatino (ABC 4,5 y 80 mg/m2 de etopósido IV los días 1 a 3, empezando 3 semanas después de la radiación y repitiéndolo cada 3 semanas durante 3 ciclos). La radioterapia fue similar a la del ensayo anterior.[
También se dio cuenta del uso de quimioterapia en determinados pacientes con enfermedad localmente avanzada y metastásica. En un estudio retrospectivo con 107 pacientes, el 57 % de los pacientes con enfermedad metastásica y el 69 % con enfermedad localmente avanzada respondieron a la quimioterapia inicial. La mediana de SG fue de 9 meses para los pacientes con enfermedad metastásica y de 24 meses para los pacientes con enfermedad localmente avanzada. Se proyectó que la tasa de SG a los 3 años sería del 17 % para los pacientes con enfermedad metastásica y del 35 % para los pacientes con enfermedad avanzada local. Sin embargo, la toxicidad fue significativa y no hubo un beneficio claro, en particular para los pacientes de más edad.[
Seguimiento
Las técnicas de seguimiento más apropiadas y su frecuencia para los pacientes tratados por un CCM no se han estudiado de forma prospectiva. Debido a la propensión a la recidiva local y regional, los médicos deberían realizar por lo menos un examen físico minucioso del sitio de la enfermedad inicial y los ganglios linfáticos regionales. Se indican estudios con imágenes para evaluar los signos y los síntomas de interés o para identificar a tiempo las metástasis a distancia. Sin embargo, no hay datos que indiquen que la detección a tiempo y el tratamiento de nuevas metástasis a distancia resulten en un aumento de la supervivencia.
En una serie de 237 pacientes que presentaban al inicio enfermedad local o regional, la mediana del tiempo hasta la recidiva fue de 9 meses (intervalo, 2–70 meses). Noventa y uno por ciento de las recidivas se presentaron dentro de los 2 años desde el momento del diagnóstico.[
Ensayos clínicos en curso
Realizar una
Referencias:
- Busse PM, Clark JR, Muse VV, et al.: Case records of the Massachusetts General Hospital. Case 19-2008. A 63-year-old HIV-positive man with cutaneous Merkel-cell carcinoma. N Engl J Med 358 (25): 2717-23, 2008.
- Medina-Franco H, Urist MM, Fiveash J, et al.: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol 8 (3): 204-8, 2001.
- Nghiem P, James N: Merkel cell carcinoma. In: Wolff K, Goldsmith LA, Katz SI, et al., eds.: Fitzpatrick's Dermatology in General Medicine. 7th ed. McGraw-Hill , 2008, pp 1087-94.
- Allen PJ, Bowne WB, Jaques DP, et al.: Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 23 (10): 2300-9, 2005.
- Goessling W, McKee PH, Mayer RJ: Merkel cell carcinoma. J Clin Oncol 20 (2): 588-98, 2002.
- Senchenkov A, Barnes SA, Moran SL: Predictors of survival and recurrence in the surgical treatment of merkel cell carcinoma of the extremities. J Surg Oncol 95 (3): 229-34, 2007.
- Nghiem P, McKee PH, Haynes HA: Merkel cell (cutaneous neuroendocrine) carcinoma. In: Sober AJ, Haluska FG, eds.: Skin Cancer. BC Decker Inc., 2001, pp 127-141.
- Boyer JD, Zitelli JA, Brodland DG, et al.: Local control of primary Merkel cell carcinoma: review of 45 cases treated with Mohs micrographic surgery with and without adjuvant radiation. J Am Acad Dermatol 47 (6): 885-92, 2002.
- Wilson LD, Gruber SB: Merkel cell carcinoma and the controversial role of adjuvant radiation therapy: clinical choices in the absence of statistical evidence. J Am Acad Dermatol 50 (3): 435-7; discussion 437-8, 2004.
- Gollard R, Weber R, Kosty MP, et al.: Merkel cell carcinoma: review of 22 cases with surgical, pathologic, and therapeutic considerations. Cancer 88 (8): 1842-51, 2000.
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007.
- Gupta SG, Wang LC, Peñas PF, et al.: Sentinel lymph node biopsy for evaluation and treatment of patients with Merkel cell carcinoma: The Dana-Farber experience and meta-analysis of the literature. Arch Dermatol 142 (6): 685-90, 2006.
- Stokes JB, Graw KS, Dengel LT, et al.: Patients with Merkel cell carcinoma tumors < or = 1.0 cm in diameter are unlikely to harbor regional lymph node metastasis. J Clin Oncol 27 (23): 3772-7, 2009.
- Haag ML, Glass LF, Fenske NA: Merkel cell carcinoma. Diagnosis and treatment. Dermatol Surg 21 (8): 669-83, 1995.
- Ratner D, Nelson BR, Brown MD, et al.: Merkel cell carcinoma. J Am Acad Dermatol 29 (2 Pt 1): 143-56, 1993.
- Yiengpruksawan A, Coit DG, Thaler HT, et al.: Merkel cell carcinoma. Prognosis and management. Arch Surg 126 (12): 1514-9, 1991.
- Messina JL, Reintgen DS, Cruse CW, et al.: Selective lymphadenectomy in patients with Merkel cell (cutaneous neuroendocrine) carcinoma. Ann Surg Oncol 4 (5): 389-95, 1997 Jul-Aug.
- Hill AD, Brady MS, Coit DG: Intraoperative lymphatic mapping and sentinel lymph node biopsy for Merkel cell carcinoma. Br J Surg 86 (4): 518-21, 1999.
- Wasserberg N, Schachter J, Fenig E, et al.: Applicability of the sentinel node technique to Merkel cell carcinoma. Dermatol Surg 26 (2): 138-41, 2000.
- Rodrigues LK, Leong SP, Kashani-Sabet M, et al.: Early experience with sentinel lymph node mapping for Merkel cell carcinoma. J Am Acad Dermatol 45 (2): 303-8, 2001.
- Mehrany K, Otley CC, Weenig RH, et al.: A meta-analysis of the prognostic significance of sentinel lymph node status in Merkel cell carcinoma. Dermatol Surg 28 (2): 113-7; discussion 117, 2002.
- Schwartz JL, Griffith KA, Lowe L, et al.: Features predicting sentinel lymph node positivity in Merkel cell carcinoma. J Clin Oncol 29 (8): 1036-41, 2011.
- Fields RC, Busam KJ, Chou JF, et al.: Recurrence and survival in patients undergoing sentinel lymph node biopsy for merkel cell carcinoma: analysis of 153 patients from a single institution. Ann Surg Oncol 18 (9): 2529-37, 2011.
- Maza S, Trefzer U, Hofmann M, et al.: Impact of sentinel lymph node biopsy in patients with Merkel cell carcinoma: results of a prospective study and review of the literature. Eur J Nucl Med Mol Imaging 33 (4): 433-40, 2006.
- Goepfert H, Remmler D, Silva E, et al.: Merkel cell carcinoma (endocrine carcinoma of the skin) of the head and neck. Arch Otolaryngol 110 (11): 707-12, 1984.
- Lewis KG, Weinstock MA, Weaver AL, et al.: Adjuvant local irradiation for Merkel cell carcinoma. Arch Dermatol 142 (6): 693-700, 2006.
- Veness MJ, Perera L, McCourt J, et al.: Merkel cell carcinoma: improved outcome with adjuvant radiotherapy. ANZ J Surg 75 (5): 275-81, 2005.
- Jabbour J, Cumming R, Scolyer RA, et al.: Merkel cell carcinoma: assessing the effect of wide local excision, lymph node dissection, and radiotherapy on recurrence and survival in early-stage disease--results from a review of 82 consecutive cases diagnosed between 1992 and 2004. Ann Surg Oncol 14 (6): 1943-52, 2007.
- Veness M, Foote M, Gebski V, et al.: The role of radiotherapy alone in patients with merkel cell carcinoma: reporting the Australian experience of 43 patients. Int J Radiat Oncol Biol Phys 78 (3): 703-9, 2010.
- Meeuwissen JA, Bourne RG, Kearsley JH: The importance of postoperative radiation therapy in the treatment of Merkel cell carcinoma. Int J Radiat Oncol Biol Phys 31 (2): 325-31, 1995.
- Marks ME, Kim RY, Salter MM: Radiotherapy as an adjunct in the management of Merkel cell carcinoma. Cancer 65 (1): 60-4, 1990.
- Mojica P, Smith D, Ellenhorn JD: Adjuvant radiation therapy is associated with improved survival in Merkel cell carcinoma of the skin. J Clin Oncol 25 (9): 1043-7, 2007.
- Housman DM, Decker RH, Wilson LD: Regarding adjuvant radiation therapy in merkel cell carcinoma: selection bias and its affect on overall survival. J Clin Oncol 25 (28): 4503-4; author reply 4504-5, 2007.
- Garneski KM, Nghiem P: Merkel cell carcinoma adjuvant therapy: current data support radiation but not chemotherapy. J Am Acad Dermatol 57 (1): 166-9, 2007.
- Foote M, Harvey J, Porceddu S, et al.: Effect of radiotherapy dose and volume on relapse in Merkel cell cancer of the skin. Int J Radiat Oncol Biol Phys 77 (3): 677-84, 2010.
- Fang LC, Lemos B, Douglas J, et al.: Radiation monotherapy as regional treatment for lymph node-positive Merkel cell carcinoma. Cancer 116 (7): 1783-90, 2010.
- Kaufman HL, Russell JS, Hamid O, et al.: Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after ≥1 year of follow-up: JAVELIN Merkel 200, a phase 2 clinical trial. J Immunother Cancer 6 (1): 7, 2018.
- Becker JC, Lorenz E, Ugurel S, et al.: Evaluation of real-world treatment outcomes in patients with distant metastatic Merkel cell carcinoma following second-line chemotherapy in Europe. Oncotarget 8 (45): 79731-79741, 2017.
- Cowey CL, Mahnke L, Espirito J, et al.: Real-world treatment outcomes in patients with metastatic Merkel cell carcinoma treated with chemotherapy in the USA. Future Oncol 13 (19): 1699-1710, 2017.
- D'Angelo SP, Lebbé C, Mortier L, et al.: First-line avelumab in a cohort of 116 patients with metastatic Merkel cell carcinoma (JAVELIN Merkel 200): primary and biomarker analyses of a phase II study. J Immunother Cancer 9 (7): , 2021.
- Nghiem PT, Bhatia S, Lipson EJ, et al.: PD-1 Blockade with Pembrolizumab in Advanced Merkel-Cell Carcinoma. N Engl J Med 374 (26): 2542-52, 2016.
- Grignani G, Rutkowski P, Lebbe C, et al.: Updated results from POD1UM-201: A phase II study of retifanlimab in patients with advanced or metastatic Merkel cell carcinoma (MCC). [Abstract] Ann Oncol 34 (Suppl 2): A-1146P, S686, 2023.
- Grignani G, Rutkowski P, Lebbé C, et al.: Updated results from POD1UM-201: A phase 2 study of retifanlimab in patients with advanced or metastatic Merkel cell carcinoma. In: Grignani G, Rutkowski P, Lebbe C, et al.: Updated results from POD1UM-201: A phase II study of retifanlimab in patients with advanced or metastatic Merkel cell carcinoma (MCC). 34 (Suppl 2): A-1146P, S686, 2023, Poster.
Available online . Last accessed April 19, 2024. - Bhatia S, Topalian SL, Sharfman WH, et al.: Non-comparative, open-label, international, multicenter phase I/II study of nivolumab (NIVO) ± ipilimumab (IPI) in patients (pts) with recurrent/metastatic merkel cell carcinoma (MCC) (CheckMate 358). [Abstract] J Clin Oncol 41 (Suppl 16): A-9506, 2023.
- Topalian SL, Bhatia S, Hollebecque A, et al.: Abstract CT074: Non-comparative, open-label, multiple cohort, phase 1/2 study to evaluate nivolumab (NIVO) in patients with virus-associated tumors (CheckMate 358): efficacy and safety in Merkel cell carcinoma (MCC). [Abstract] Cancer Res 77 (13 Suppl): A-CT074, 2017.
- Tai PT, Yu E, Winquist E, et al.: Chemotherapy in neuroendocrine/Merkel cell carcinoma of the skin: case series and review of 204 cases. J Clin Oncol 18 (12): 2493-9, 2000.
- Henness S, Vereecken P: Management of Merkel tumours: an evidence-based review. Curr Opin Oncol 20 (3): 280-6, 2008.
- Poulsen M, Rischin D, Walpole E, et al.: High-risk Merkel cell carcinoma of the skin treated with synchronous carboplatin/etoposide and radiation: a Trans-Tasman Radiation Oncology Group Study--TROG 96:07. J Clin Oncol 21 (23): 4371-6, 2003.
- Poulsen MG, Rischin D, Porter I, et al.: Does chemotherapy improve survival in high-risk stage I and II Merkel cell carcinoma of the skin? Int J Radiat Oncol Biol Phys 64 (1): 114-9, 2006.
- Poulsen M, Walpole E, Harvey J, et al.: Weekly carboplatin reduces toxicity during synchronous chemoradiotherapy for Merkel cell carcinoma of skin. Int J Radiat Oncol Biol Phys 72 (4): 1070-4, 2008.
- Voog E, Biron P, Martin JP, et al.: Chemotherapy for patients with locally advanced or metastatic Merkel cell carcinoma. Cancer 85 (12): 2589-95, 1999.
Tratamiento del carcinoma de células de Merkel en estadios I y II
El carcinoma de células de Merkel (CCM) en estadio I y II solo incluye a los pacientes con enfermedad local.
La extirpación con márgenes de 1 a 2 cm y la radioterapia son los pilares del tratamiento de los tumores primarios de CCM. A menudo, se recomienda la radioterapia adyuvante dirigida al sitio del tumor primario. Sin embargo, se puede evitar la morbilidad de la radiación y mantener bajas las tasas de recidiva local, como se observa en un subconjunto de pacientes con lesiones pequeñas de riesgo bajo (es decir, tumores que miden <2 cm sin otros factores pronósticos adversos).[
Debido al riesgo de enfermedad ganglionar oculta, se recomienda la biopsia del ganglio linfático centinela (GLC) para pacientes sin enfermedad metastásica detectable en forma clínica.[
Opciones de tratamiento del carcinoma de células de Merkel en estadio I y II
Las opciones de tratamiento para
- Extirpación local con margen sin compromiso tumoral, con intención de mantener la función.
- La evaluación ganglionar quirúrgica, que normalmente se inicia con un procedimiento en el GLC, se puede considerar en aquellos pacientes con riesgo significativo de enfermedad ganglionar. Además, se puede considerar la disección ganglionar definitiva si se encuentra compromiso ganglionar; ello conllevaría a elevar la clasificación del cáncer del paciente a un estadio III.
- Una opción es administrar radioterapia local si hay inquietud sobre el margen de extirpación del tumor primario. A veces se usa radioterapia regional si el procedimiento de estadificación ganglionar es incompleto o se omitió. En los sitios donde la localización de los ganglios linfáticos regionales primarios es incierta (por ejemplo, en la mitad de la espalda), la selección del campo para el ganglio regional es problemática.
- Se alienta la participación en ensayos clínicos.
Ensayos clínicos en curso
Realizar una
Referencias:
- Frohm ML, Griffith KA, Harms KL, et al.: Recurrence and Survival in Patients With Merkel Cell Carcinoma Undergoing Surgery Without Adjuvant Radiation Therapy to the Primary Site. JAMA Dermatol 152 (9): 1001-7, 2016.
- Cassler NM, Merrill D, Bichakjian CK, et al.: Merkel Cell Carcinoma Therapeutic Update. Curr Treat Options Oncol 17 (7): 36, 2016.
- Harms PW: Update on Merkel Cell Carcinoma. Clin Lab Med 37 (3): 485-501, 2017.
- Su LD, Lowe L, Bradford CR, et al.: Immunostaining for cytokeratin 20 improves detection of micrometastatic Merkel cell carcinoma in sentinel lymph nodes. J Am Acad Dermatol 46 (5): 661-6, 2002.
Tratamiento del carcinoma de células de Merkel en estadio III
El carcinoma de células de Merkel (CCM) en estadio III incluye a los pacientes con enfermedad ganglionar.
Opciones de tratamiento del carcinoma de células de Merkel en estadio III
Las opciones de tratamiento para el
- Extirpación local con margen sin compromiso tumoral, con intención de mantener la función.
- Procedimiento en el ganglio centinela seguido, posiblemente, de una cirugía ganglionar regional más definitiva si se encuentra compromiso ganglionar.
- Radiación ganglionar local y regional, especialmente si hay inquietud sobre cuán adecuado es el margen de extirpación del tumor primario o el riesgo de recidiva locorregional después de la cirugía ganglionar (por ejemplo, ganglios primarios múltiples, diseminación extracapsular, invasión linfovascular y evidencia de metástasis en tránsito).
- Se ha administrado quimioterapia sistémica e inmunoterapia a los pacientes con el riesgo más alto de recidiva, pero los datos disponibles no han mostrado ventaja clínica en cuanto a la supervivencia.
- Se alienta la participación en ensayos clínicos.
Ensayos clínicos en curso
Realizar una
Tratamiento del carcinoma de células de Merkel en estadio IV
El carcinoma de células de Merkel (CCM) en estadio IV incluye a los pacientes con metástasis a distancia.
La inmunoterapia con un solo fármaco es el tratamiento sistémico inicial preferido para los pacientes con enfermedad metastásica. Se puede considerar la quimioterapia sistémica como opción en los pacientes con enfermedad en estadio IV que tienen un buen estado funcional y que no son aptos para recibir inmunoterapia o su enfermedad progresó mientras recibían este tratamiento. Aunque se observaron respuestas ante diversos regímenes, se carece de evidencia en cuanto a los resultados de la quimioterapia sobre el control permanente de la enfermedad o la supervivencia a largo plazo.
Si la quimioterapia no se considera una opción apropiada, los pacientes con enfermedad en estadio IV pueden considerar someterse a otra cirugía o recibir radioterapia como tratamiento paliativo local o regional.
Opciones de tratamiento del carcinoma de células de Merkel en estadio IV
Las opciones de tratamiento para el
- Inmunoterapia con un solo fármaco.
- Paliación con quimioterapia, cirugía o radioterapia según lo que resulte apropiado desde el punto de vista clínico.
- Se alienta enfáticamente la participación en ensayos clínicos.
Ensayos clínicos en curso
Realizar una
Tratamiento del carcinoma de células de Merkel recidivante
El carcinoma de células Merkel (CMM) es un tumor raro. Las recomendaciones y los resultados de los diversos tratamientos para pacientes con CCM se incluyen en muchas series de casos numerosas [
Opciones de tratamiento del carcinoma de células de Merkel recidivante
Recidiva local
Las opciones de tratamiento para los pacientes con recidiva local incluyen cirugía local más amplia si fuera posible, seguida de radioterapia si no se administró antes.
Asimismo, se puede considerar la disección de ganglios linfáticos regionales (DGLR) si los ganglios regionales de drenaje no se extirparon antes.
Debido a la precariedad del pronóstico después de la recidiva, también se puede considerar la terapia sistémica, aunque no hay evidencia de que mejore la supervivencia.
Recidiva ganglionar
Las opciones del tratamiento para los pacientes con recidiva ganglionar regional sola incluyen la DGLR y la radioterapia adyuvante si los ganglios regionales de drenaje no se trataron antes. Debido a la precariedad del pronóstico después de la recidiva, también se puede considerar la terapia sistémica, aunque no hay datos probatorios de que esta mejore la supervivencia.
Recidiva a distancia
En los pacientes con enfermedad a distancia, varios fármacos de inmunoterapia han producido respuestas duraderas y se recomienda su uso en monoterapia como tratamiento sistémico de primera línea para la mayoría de los pacientes. Entre estos fármacos, el avelumab y el pembrolizumab cuentan con los datos de seguimiento más prolongado publicados. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) autorizó el uso de estos fármacos.[
La quimioterapia es una opción para los pacientes que no son aptos para recibir inmunoterapia o que su enfermedad progresó mientras recibía este tratamiento, también es una opción para pacientes específicos que obtienen beneficio de una respuesta rápida.[
Ensayos clínicos en curso
Realizar una
Referencias:
- Goessling W, McKee PH, Mayer RJ: Merkel cell carcinoma. J Clin Oncol 20 (2): 588-98, 2002.
- Henness S, Vereecken P: Management of Merkel tumours: an evidence-based review. Curr Opin Oncol 20 (3): 280-6, 2008.
- Voog E, Biron P, Martin JP, et al.: Chemotherapy for patients with locally advanced or metastatic Merkel cell carcinoma. Cancer 85 (12): 2589-95, 1999.
- Poulsen M, Rischin D, Walpole E, et al.: High-risk Merkel cell carcinoma of the skin treated with synchronous carboplatin/etoposide and radiation: a Trans-Tasman Radiation Oncology Group Study--TROG 96:07. J Clin Oncol 21 (23): 4371-6, 2003.
- Kaufman HL, Russell JS, Hamid O, et al.: Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after ≥1 year of follow-up: JAVELIN Merkel 200, a phase 2 clinical trial. J Immunother Cancer 6 (1): 7, 2018.
- D'Angelo SP, Lebbé C, Mortier L, et al.: First-line avelumab in a cohort of 116 patients with metastatic Merkel cell carcinoma (JAVELIN Merkel 200): primary and biomarker analyses of a phase II study. J Immunother Cancer 9 (7): , 2021.
- Nghiem PT, Bhatia S, Lipson EJ, et al.: PD-1 Blockade with Pembrolizumab in Advanced Merkel-Cell Carcinoma. N Engl J Med 374 (26): 2542-52, 2016.
- Grignani G, Rutkowski P, Lebbe C, et al.: Updated results from POD1UM-201: A phase II study of retifanlimab in patients with advanced or metastatic Merkel cell carcinoma (MCC). [Abstract] Ann Oncol 34 (Suppl 2): A-1146P, S686, 2023.
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007.
- Tai PT, Yu E, Winquist E, et al.: Chemotherapy in neuroendocrine/Merkel cell carcinoma of the skin: case series and review of 204 cases. J Clin Oncol 18 (12): 2493-9, 2000.
Actualizaciones más recientes a este resumen (04 / 24 / 2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se añadió
Se añadió
Se añadió
Se añadió
Se añadió
Se revisó
Se revisó
Se revisó
La sección
El
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del carcinoma de células de Merkel. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del carcinoma de células de Merkel son:
- Russell S. Berman, MD (New York University School of Medicine)
- Shaheer A. Khan, PhD (Columbia University Irving Medical Center)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como "En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]".
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del carcinoma de células de Merkel. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como "estándar" o "en evaluación clínica". Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del
Última revisión: 2024-04-26
Esta información no reemplaza el consejo de un médico. Ignite Healthwise, LLC, niega toda garantía y responsabilidad por el uso de esta información. El uso que usted haga de esta información implica que usted acepta los
Healthwise, Healthwise para cada decisión de la salud, y el logo de Healthwise son marcas de fábrica de Ignite Healthwise, LLC.
Page Footer
Quiero...
Audiencia
Sitios seguros para miembros
Información sobre The Cigna Group
Aviso legal
Los planes individuales y familiares de seguro médico y dental están asegurados por Cigna Health and Life Insurance Company (CHLIC), Cigna HealthCare of Arizona, Inc., Cigna HealthCare of Illinois, Inc., Cigna HealthCare of Georgia, Inc., Cigna HealthCare of North Carolina, Inc., Cigna HealthCare of South Carolina, Inc. y Cigna HealthCare of Texas, Inc. Los planes de beneficios de salud y de seguro de salud de grupo están asegurados o administrados por CHLIC, Connecticut General Life Insurance Company (CGLIC) o sus afiliadas (puedes ver
Todas las pólizas de seguros y los planes de beneficios de grupo contienen exclusiones y limitaciones. Para conocer la disponibilidad, los costos y detalles completos de la cobertura, comunícate con un agente autorizado o con un representante de ventas de Cigna. Este sitio web no está dirigido a los residentes de New Mexico.