Comprar planes
Comprar tu propia cobertura
Planes a través de tu empleador
Conoce sobre los beneficios médicos, dentales, de farmacia y voluntarios que tu empleador puede ofrecer.
Aprender
¿Vives o trabajas fuera del país?
Tratamiento del cáncer de tiroides infantil (PDQ®) : Tratamiento - información para profesionales de salud [NCI]
Esta información es producida y suministrada por el Instituto Nacional del Cáncer (NCI, por sus siglas en inglés). La información en este tema puede haber cambiado desde que se escribió. Para la información más actual, comuníquese con el Instituto Nacional del Cáncer a través del Internet en la página web http://cancer.gov o llame al 1-800-4-CANCER.
Información general sobre el cáncer de tiroides infantil
Incidencia
En los Estados Unidos, la incidencia anual de cánceres de tiroides es de 10,7 casos por millón en personas de 0 a 19 años. La incidencia es más alta en las mujeres que en los hombres (17,6 vs. 4,1 casos por millón de personas, respectivamente) y más baja en las personas negras que en las personas blancas (3,9 vs. 11,8 casos por millón de personas, respectivamente). Representa cerca del 6 % de todos los cánceres en este grupo de edad.[
En 2 estudios de tendencia temporal que usaron la base de datos del Programa de Vigilancia, Epidemiología y Resultados Finales (SEER), se observó un aumento del 2 % y del 3,8 % anual en la incidencia del carcinoma de tiroides diferenciado en niños, adolescentes y jóvenes en los períodos entre 1973 y 2011, y 1984 y 2010, respectivamente.[
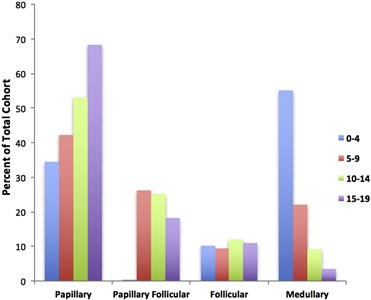
El subtipo papilar es el subtipo más común de cáncer de tiroides infantil y representa cerca del 60 % de los casos, seguido del subtipo papilar de variante folicular (20–25 %), el subtipo folicular (10 %) y el subtipo medular (<10 %). El subtipo anaplásico se presenta en menos del 1 % de los carcinomas de tiroides en pediatría. La incidencia del subtipo papilar y su variante folicular alcanza su máximo entre los 15 y los 19 años de edad. La incidencia de cáncer de tiroides medular es más alta en niños de 0 a 4 años y disminuye a edades más avanzadas (consultar la
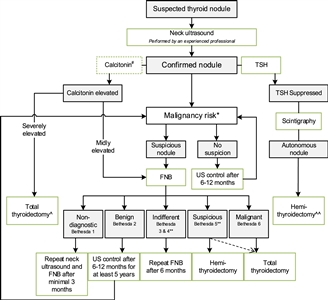
Evaluación diagnóstica
La prevalencia de nódulos tiroideos benignos en la niñez se ha estimado en alrededor del 0,5 % al 2 %.[
- Ecografía de tiroides y cuello. Las características ecográficas comunes de una neoplasia maligna incluyen hipoecogenicidad, márgenes invasivos, aumento del flujo sanguíneo intranodular, microcalcificaciones y ganglios linfáticos cervicales anormales. A partir de las características ecográficas, se han desarrollado sistemas de puntuación para facilitar la selección de los nódulos que requieren aspiración con aguja fina (AAF) en adultos. El más popular de estos sistemas de puntuación es el Thyroid Imaging Reporting and Data System. Sin embargo, la incidencia más alta de carcinoma de tiroides diferenciado en los nódulos tiroideos infantiles y la falta de validación en la población pediátrica dificultan la extrapolación de estos criterios a los niños.[
7 ,8 ] - Concentración sérica de la hormona estimulante de la tiroides (TSH). El funcionamiento de la glándula tiroides suele ser normal. Los nódulos hiperfuncionantes tienen un riesgo muy bajo de neoplasia maligna (2–6 %).[
8 ] - Concentración sérica de tiroglobulina, que por lo general es elevada en el carcinoma de tiroides diferenciado.
- Aspiración con aguja fina (AAF). La sensibilidad, especificidad y exactitud de la AAF en niños es similar a la de los adultos, pero hay un riesgo más alto de resultados negativos falsos en los nódulos de más de 4 cm.[
8 ]Los resultados de la AAF se clasifican de acuerdo con los 6 niveles del Sistema Bethesda para informar la citopatología de tiroides (consultar el
Cuadro 1 ).[8 ]Cuadro 1. Sistema Bethesda para informar la citopatología de tiroidesa Categoría Bethesda Categoría citopatológica Tasa de neoplasias malignas Tratamiento recomendado AAF = aspiración con aguja fina. a Reproducción autorizada de Journal of Pediatric Surgery , Volumen 55, Número 11, Emily R. Christison-Lagay, Reto M. Baertschiger, Catherine Dinauer, Gary L. Francis, Marcus M. Malek, Timothy B Lautz, Jennifer H. Aldrink, Christa Grant, Daniel S. Rhee, Peter Ehrlich, Roshni Dasgupta, Shahab Abdessalam, Pediatric differentiated thyroid carcinoma: Actualización del APSA Cancer Committee, páginas 2273–2283, Derechos de autor (2020), autorizado por Elsevier.[8 ]I No diagnóstica o inadecuada 1–5 % Repetición de la AAF (otras opciones: vigilancia continua con ecografía, lobectomía) II Benigna 0–10 % Si es pequeño, serie de ecografías; si es >4 cm, lobectomía III Atipia o lesión folicular de significado indeterminado 0–44 % Prueba genética molecular, lobectomía si no hay mutación preocupante, tiroidectomía si hay mutación enBRAFo una fusión IV Neoplasia folicular 60–71 % Prueba genética molecular, lobectomía si no hay mutación preocupante, tiroidectomía si hay mutación enBRAFo una fusión V Sospecha de neoplasia maligna 70–86 % Tiroidectomía total, con disección central del cuello o sin esta VI Maligna 97–100 % Tiroidectomía total, con disección central del cuello o sin esta Si bien las pruebas moleculares de los nódulos tiroideos podrían ser útiles para el diagnóstico del carcinoma de tiroides papilar, no hay evidencia que respalde su uso.[
7 ] - Evaluación ganglionar. El análisis de los ganglios linfáticos cervicales es muy importante para estratificar el riesgo y determinar las estrategias quirúrgicas. Las características estructurales que preocupan cuando se observan en la ecografía de adultos incluyen forma redondeada, márgenes irregulares, calcificaciones, cambio quístico, vascularidad periférica, pérdida de hilo graso y ecotextura heterogénea. Se debe realizar una AAF en cualquier ganglio linfático lateral del cuello que sea sospechoso con el fin de confirmar el compromiso metastásico antes de la disección lateral del cuello.[
8 ]
Referencias:
- National Cancer Institute: NCCR*Explorer: An interactive website for NCCR cancer statistics. Bethesda, MD: National Cancer Institute.
Available online . Last accessed February 25, 2025. - Vergamini LB, Frazier AL, Abrantes FL, et al.: Increase in the incidence of differentiated thyroid carcinoma in children, adolescents, and young adults: a population-based study. J Pediatr 164 (6): 1481-5, 2014.
- Golpanian S, Perez EA, Tashiro J, et al.: Pediatric papillary thyroid carcinoma: outcomes and survival predictors in 2504 surgical patients. Pediatr Surg Int 32 (3): 201-8, 2016.
- Pole JD, Zuk AM, Wasserman JD: Diagnostic and Treatment Patterns Among Children, Adolescents, and Young Adults with Thyroid Cancer in Ontario: 1992-2010. Thyroid 27 (8): 1025-1033, 2017.
- Schmidt Jensen J, Grønhøj C, Mirian C, et al.: Incidence and Survival of Thyroid Cancer in Children, Adolescents, and Young Adults in Denmark: A Nationwide Study from 1980 to 2014. Thyroid 28 (9): 1128-1133, 2018.
- Dermody S, Walls A, Harley EH: Pediatric thyroid cancer: An update from the SEER database 2007-2012. Int J Pediatr Otorhinolaryngol 89: 121-6, 2016.
- Lebbink CA, Links TP, Czarniecka A, et al.: 2022 European Thyroid Association Guidelines for the management of pediatric thyroid nodules and differentiated thyroid carcinoma. Eur Thyroid J 11 (6): , 2022.
- Christison-Lagay ER, Baertschiger RM, Dinauer C, et al.: Pediatric differentiated thyroid carcinoma: An update from the APSA Cancer Committee. J Pediatr Surg 55 (11): 2273-2283, 2020.
Cáncer de tiroides diferenciado (papilar o folicular)
Factores de riesgo
Los factores de riesgo del cáncer de tiroides diferenciado en pediatría son los siguientes:
- Exposición a la radiación. Hay una frecuencia excesiva de adenomas y carcinomas de tiroides papilares después de la exposición a la radiación, debido a contaminación ambiental o por el uso de radiación ionizante para diagnóstico o tratamiento.[
1 ,2 ,3 ,4 ] El riesgo aumenta después de la exposición a una dosis media de más de 0,05 Gy a 0,1 Gy (50–100 mGy), sigue un patrón lineal de dosis-respuesta hasta los 30 Gy y luego disminuye. El riesgo de cáncer de tiroides después de la exposición a la radiación es mayor cuando esta se produce a una edad más temprana, y el riesgo persiste más de 45 años después de haber ocurrido.[4 ,5 ] Los sobrevivientes de cáncer infantil que después presentan carcinomas de tiroides diferenciados tienden a tener, en promedio, tumores más pequeños y, con mayor frecuencia, enfermedad bilateral. Sin embargo, no se han documentado diferencias en la incidencia de complicaciones quirúrgicas, tasa de recidiva o muerte relacionada con la enfermedad entre los sobrevivientes y los controles.[6 ] Para obtener más información, consultar la secciónNeoplasias subsiguientes en Efectos tardíos del tratamiento anticanceroso en la niñez.El carcinoma de tiroides papilar es el de carcinoma de tiroides que se diagnostica con más frecuencia después de la exposición a la radiación.[
5 ] A menudo se encuentran alteraciones moleculares, incluso reordenamientos intracromosómicos; entre estos, los reordenamientos de RET son los más comunes.[5 ] - Nódulo tiroideo y tiroiditis autoinmunitaria. En un estudio de 485 nódulos en 385 niños que se sometieron a aspiración con aguja fina, se observó cáncer de tiroides en 108 nódulos (24 %). La tiroiditis autoinmunitaria, que se observó en 95 pacientes (25 %), se relacionó de manera independiente con un aumento del riesgo de cáncer de tiroides (oportunidad relativa [OR], 2,19; intervalo de confianza [IC] 95 %, 1,32–3,62). El carcinoma de tiroides papilar fue más frecuente que el carcinoma de tiroides folicular. Entre los carcinomas de tiroides papilares, la tiroiditis autoinmunitaria estaba relacionada de manera importante con la variante esclerosante difusa (OR, 4,74; IC 95 %, 1,33–16,9).[
7 ] - Factores genéticos. Los factores genéticos desempeñan una función importante en un subgrupo de carcinomas tiroideos. En el caso de los carcinomas de células foliculares, solo el 5 % al 10 % son cánceres familiares. Entre ellos, la mayoría de los casos familiares son asindrómicos, mientras que una minoría ocurre en el contexto de síndromes de cáncer bien definidos con alteraciones de la línea germinal conocidas, como los siguientes:[
8 ,9 ]- Poliposis relacionada con APC.
- Complejo de Carney.
- Síndrome de hamartoma tumoral PTEN.
- Síndrome de Werner.
- Síndrome DICER1.
Cuadro clínico inicial y factores pronósticos
Los pacientes con cáncer de tiroides por lo general presentan una masa tiroidea con adenopatía cervical indolora o sin ella.[
En el cáncer de tiroides bien diferenciado, se encontró que el sexo masculino, el tamaño tumoral más grande y las metástasis a distancia son factores pronósticos importantes de mortalidad temprana. Sin embargo, incluso los pacientes del grupo de riesgo más alto que presentaron metástasis a distancia tuvieron una tasa de supervivencia del 90 %.[
Además, se notificaron las siguientes observaciones:
- En un estudio transversal en el que participaron el 20 % de los hospitales comunitarios de los Estados Unidos, se comparó el cuadro clínico inicial de 644 casos pediátricos con el de más de 43 000 casos en adultos. En comparación con los adultos, los niños presentaron una proporción más alta de compromiso ganglionar (31,5 % en niños vs. 14,7 % en adultos) y metástasis pulmonares (5,7 % en niños vs. 2,2 % en adultos).[
10 ] - La edad más joven se relaciona con una presentación clínica más maligna del carcinoma de tiroides diferenciado. Las tasas de recidiva más altas se relacionaron con una edad más joven en el momento de la presentación.[
12 ] - El tamaño tumoral más grande (>1 cm), la diseminación extratiroidea y la enfermedad multifocal se relacionaron con un aumento del riesgo de metástasis ganglionares.[
13 ] - Los niños prepúberes presentan un cuadro clínico inicial más maligno en comparación con los adolescentes en etapa puberal; además, los niños tienen un grado más alto de diseminación extratiroidea, compromiso de ganglios linfáticos y metástasis pulmonares. Sin embargo, los desenlaces son similares entre los grupos de niños prepuberales y adolescentes.[
14 ,15 ,16 ] - En un análisis de un registro francés, se observaron desenlaces similares en niños y jóvenes que presentaron carcinoma de tiroides papilar después de recibir radioterapia en comparación con niños y jóvenes con carcinoma de tiroides papilar espontáneo. Sin embargo, los pacientes que recibieron antes irradiación en la tiroides por una enfermedad benigna tuvieron más tumores invasivos y compromiso ganglionar.[
17 ] - En estudios retrospectivos, las fusiones génicas tumorales de RET, ALK y NTRK se relacionaron con características clínicas de riesgo alto.
- En un estudio de 106 pacientes pediátricos, 80 presentaron alteraciones genómicas identificables, entre ellas 31 tenían oncogenes de fusión (21 con RET, 6 con ALK y 4 con NTRK). Los pacientes con tumores positivos para una fusión eran más jóvenes (edad <10 años, 93 %); presentaron una proporción más alta de tumores grandes (>2 cm), diseminación extratiroidea, metástasis ganglionar y pulmonar; y tuvieron una incidencia más alta de enfermedad recidivante o persistente que los pacientes con tumores con alteración en BRAF. La expresión de SLC5A5 (que codifica la proteína cotransportadora de sodio y yodo, un determinante importante de la avidez por yodo I 131 [131I]) disminuyó en niños con carcinomas de tiroides papilares positivos para fusiones y en 2 pacientes con enfermedad resistente al 131I que albergaban fusiones génicas de NTRK y RET, respectivamente. La administración de larotrectinib y selpercatinib produjo respuestas tumorales y restauró la absorción de yodo radiactivo, lo que subraya la importancia de las pruebas moleculares en pacientes pediátricos con cáncer de tiroides papilar.[
18 ] - En un segundo estudio, 131 pacientes pediátricos se clasificaron en 3 grupos: con alteración de RAS (HRAS, KRAS o NRAS), con alteración de BRAF (BRAF V600E) y con fusiones génicas de RET o NTRK (fusiones de RET, NTRK1 o NTRK3).[
19 ] Los pacientes con fusiones génicas de RET o NTRK tuvieron una probabilidad significativamente mayor de presentar enfermedad ganglionar avanzada y metástasis a distancia, y menos probabilidad de lograr la remisión al cabo de 1 año, en comparación con los pacientes de los grupos con alteración de RAS y alteración de BRAF.
- En un estudio de 106 pacientes pediátricos, 80 presentaron alteraciones genómicas identificables, entre ellas 31 tenían oncogenes de fusión (21 con RET, 6 con ALK y 4 con NTRK). Los pacientes con tumores positivos para una fusión eran más jóvenes (edad <10 años, 93 %); presentaron una proporción más alta de tumores grandes (>2 cm), diseminación extratiroidea, metástasis ganglionar y pulmonar; y tuvieron una incidencia más alta de enfermedad recidivante o persistente que los pacientes con tumores con alteración en BRAF. La expresión de SLC5A5 (que codifica la proteína cotransportadora de sodio y yodo, un determinante importante de la avidez por yodo I 131 [131I]) disminuyó en niños con carcinomas de tiroides papilares positivos para fusiones y en 2 pacientes con enfermedad resistente al 131I que albergaban fusiones génicas de NTRK y RET, respectivamente. La administración de larotrectinib y selpercatinib produjo respuestas tumorales y restauró la absorción de yodo radiactivo, lo que subraya la importancia de las pruebas moleculares en pacientes pediátricos con cáncer de tiroides papilar.[
- En un ensayo se informaron los desenlaces de 65 pacientes chinos (edad <20 años) con carcinoma de tiroides papilar y metástasis pulmonares.[
20 ] De los pacientes, 20 presentaron metástasis pulmonares persistentes después del tratamiento con yodo radioactivo, a lo que se denominó enfermedad resistente al yodo radioactivo. No se observaron diferencias significativas en las características patológicas entre los pacientes menores de 15 años y los pacientes de 15 a 20 años, pero los pacientes más jóvenes tuvieron una probabilidad más alta de presentar enfermedad resistente al yodo radioactivo (cociente de riesgos instantáneos [CRI], 3,500; IC 95 %, 1,134–10,803; P = 0,023). La enfermedad resistente al yodo radioactivo se identificó como un factor predictivo independiente de enfermedad progresiva (CRI, 10,008; IC 95 %, 2,427–41,268; P = 0,001). En la curva Kaplan-Meier se observó que el grupo resistente al yodo radioactivo tenía tasas más bajas de supervivencia sin progresión (SSP) y de supervivencia específica de la enfermedad que el grupo ávido de yodo radioactivo (P < 0,001 y P = 0,039). De forma similar, la presencia de enfermedad resistente al yodo radioactivo fue un factor de riesgo para una SSP desfavorable en pacientes menores de 15 años (P < 0,001).
En una revisión de la National Cancer Database, se encontró que los pacientes de 21 años o menos de familias de bajos recursos y aquellos que no tenían seguro médico, tuvieron un mayor tiempo de espera entre el diagnóstico y el tratamiento del cáncer de tiroides bien diferenciado y presentaron un estadio más avanzado de la enfermedad.[
En una revisión retrospectiva de una sola institución se analizó el efecto de la enfermedad multifocal en el momento de la presentación en pacientes con carcinoma de tiroides papilar.[
En un estudio de una sola institución se compararon las gammagrafías diagnósticas de todo el cuerpo con 131I y las concentraciones de tiroglobulina estimulada (sTg) como factores predictivos de metástasis a distancia en niños con carcinoma de tiroides papilar.[
Características histológicas y moleculares del cáncer de tiroides diferenciado
Los tumores de tiroides se clasifican como adenomas o carcinomas.[
Características histológicas
A menudo se llaman carcinomas de tiroides diferenciados a los carcinomas papilares y foliculares. La clasificación patológica de los carcinomas de tiroides diferenciados se basa en definiciones estándar establecidas por la Organización Mundial de la Salud, y los criterios son los mismos para niños y adultos. Los desenlaces a largo plazo en niños y adolescentes con carcinoma de tiroides diferenciado son excelentes, con tasas de supervivencia a 10 años superiores al 95 %.[
- El carcinoma papilar de tiroides representa el 90 % o más de los casos de carcinoma de tiroides diferenciado que aparecen durante la niñez y la adolescencia. El carcinoma de tiroides papilar en la edad pediátrica exhibe diferentes variantes histológicas: clásica, sólida, folicular y esclerosante difusa.[
27 ] El carcinoma de tiroides papilar es con frecuencia multifocal y bilateral, y metastatiza a los ganglios linfáticos regionales en la mayoría de los niños. En el 25 % de los casos se producen metástasis hematógenas.[9 ,28 ] - El carcinoma de tiroides folicular es infrecuente. Por lo general, es un tumor unifocal y más propenso a metástasis hematógenas iniciales en los pulmones y los huesos. Las metástasis en ganglios linfáticos regionales son poco comunes. Las variantes histológicas del cáncer de tiroides folicular incluyen las variante de células de Hürthle (oncocítico), de células claras e insular (poco diferenciado).[
9 ]
Características moleculares
La oncogénesis en la tiroides y la progresión de los carcinomas de células foliculares de tiroides (carcinoma de tiroides diferenciado, carcinoma de tiroides papilar poco diferenciado y carcinoma de tiroides anaplásico) se explican mediante un proceso de pasos múltiples que resulta en la activación anómala de las vías de señalización MAPK o PI3K/PTEN/AKT. Los estudios genómicos exhaustivos que se llevaron a cabo durante la última década han definido el panorama de estos tumores, así como también las correlaciones entre genotipo y fenotipo. Con el empleo de técnicas de secuenciación avanzada, se encuentran alteraciones oncógenas en más del 90 % de los tumores.[
Las variantes oncoiniciadoras más comunes son las de los genes BRAF y RAS, seguidas de las fusiones de genes que comprometen RET o NTRK:[
- BRAF. Las variantes de un solo nucleótido del gen BRAF son las alteraciones más comunes que se encuentran en el carcinoma de tiroides. La variante más común es la V600E (95 % de los casos con alteraciones de BRAF). Se encuentran variantes de BRAF en el 40 % al 80 % de los carcinomas de tiroides papilares y en menor proporción en el carcinoma de tiroides papilar poco diferenciado (5–35 %) y el carcinoma de tiroides anaplásico (10–50 %).[
8 ,31 ]La presencia de BRAF V600E se relacionó con la diseminación extratiroidea del tumor y el aumento del riesgo de recidiva. Sin embargo, su importancia pronóstica es controvertida. Los tumores que presentan BRAF V600E parecen exhibir un perfil inmunodepresor amplio con expresión alta del ligando de muerte programada 1 (PD-L1).[
8 ,31 ]En un análisis retrospectivo de 80 pacientes brasileños menores de 18 años con carcinoma de tiroides papilar, se identificaron fusiones AGK::BRAF y variantes de un solo nucleótido BRAF V600E.[
32 ] Las fusiones AGK::BRAF, que se encuentran en el 19 % de los pacientes pediátricos con carcinoma de tiroides papilar, se relacionaron con metástasis a distancia y menor edad. Las variantes BRAF V600E, que se encuentran en el 15 % de los pacientes pediátricos con carcinoma de tiroides papilar, se relacionaron con mayor edad y tumores más grandes. - RAS. La activación oncogénica de RAS ocurre en cualquiera de las familias de genes RAS (NRAS, HRAS y KRAS), aunque las alteraciones más frecuentes son las variantes de un solo nucleótido de NRAS. Las variantes de RAS son marcadores de lesiones de tiroides con patrón folicular. Están presentes en el 30 % al 50 % de los carcinomas de tiroides foliculares, en el 25 % al 45 % de las variantes foliculares del carcinoma de tiroides papilar y en menos del 10% de los carcinomas de tiroides papilares. También se encuentran con frecuencia en el carcinoma de tiroides papilar poco diferenciado (20–50 %) y en el carcinoma de tiroides anaplásico (10–50 %) y se cree que promueven la progresión tumoral. Tienen una prevalencia mayor en las áreas con carencia de yodo.[
8 ,31 ] - Reordenamientos de RET. Se han descubierto múltiples reordenamientos de RET en alrededor del 5 % al 25 % de los carcinomas de tiroides papilares y en menos del 10 % de sus variantes foliculares. Se encuentran muy vinculados a la exposición a la radiación ambiental o terapéutica. También son comunes en los pacientes jóvenes, muchos de los cuales presentan metástasis ganglionares y manifestaciones clinicopatológicas de gran malignidad.[
8 ,31 ] Se notificó que las variantes de RET son más comunes en la variante esclerosante difusa del carcinoma papilar que en el carcinoma papilar no esclerosante estándar (83 vs. 15,4 %; P = 0,0095).[27 ]En una revisión retrospectiva se identificaron 113 tumores positivos para una fusión de RET entre 993 pacientes con carcinoma de tiroides papilar.[
33 ] Los tumores positivos para fusión de RET fueron 3 veces más frecuentes en pacientes pediátricos y adolescentes (29,8 %) que en pacientes adultos (8,7 %). Se identificaron 20 tipos de fusiones de RET. Los carcinomas positivos para fusión de RET se relacionaron con un comportamiento tumoral agresivo, incluso tasas altas de metástasis ganglionares (75,2 %) y de metástasis a distancia (18,6 %). Estas tasas fueron significativamente más altas que en los carcinomas con fusiones de NTRK, variantes BRAF V600E y variantes de RAS. Las metástasis locales y a distancia también se encontraron con frecuencia en los pacientes con microcarcinomas positivos para fusiones de RET. Las recidivas verdaderas fueron infrecuentes (2,4 %) y solo se presentaron en adultos. Las tasas de supervivencia específicas de la enfermedad fueron del 99 % a los 2 años, del 96 % a los 5 años y del 95 % a los 10 años. - Reordenamientos de NTRK. Se han descrito reordenamientos de NTRK1 y NTRK3 en cerca del 5 % de los carcinomas de tiroides papilares. Sin embargo, se notificaron genes de fusión ETV6::NTRK3 en el 15 % de los carcinomas de tiroides papilares provocados por radiación. En pacientes jóvenes y en niños, los carcinomas de tiroides papilares con reordenamiento de NTRK a veces presentan metástasis ganglionares y características clínicopatológicas de gran malignidad, similares a las de los tumores con reordenamiento de RET.[
8 ,31 ] - Variantes de DICER1. Se han identificado variantes patogénicas de DICER1 en cerca del 10 % de los carcinomas de tiroides papilares.[
34 ] También se han descrito variantes de DICER1 en una cohorte pequeña de pacientes con carcinomas de tiroides poco diferenciados.[35 ]En un estudio se correlacionó el estado de los puntos calientes con variantes de DICER1 con las características clínicas, histológicas y de desenlace en una serie de 56 pacientes pediátricos con carcinomas de tiroides papilares. Estos pacientes no tenían antecedentes clínicos ni familiares de manifestaciones sindrómicas relacionadas con DICER1.[
36 ] De los carcinomas de tiroides papilares, 15 (27 %) albergaban la variante BRAF p.V600E, mientras que 8 (14 %) presentaban variantes de DICER1, sin variantes BRAF p.V600E asociadas. Se identificaron variantes de DICER1 en los exones 26 y 27. También se observó una nueva variante D1810del (c.5428_5430delGAT). En el estudio se confirmó la ausencia de variantes de DICER1 en puntos calientes del DNA del tejido no tumoral emparejado en los 8 carcinomas de tiroides papilares relacionados con DICER1. También se concluyó que la mayor incidencia en pacientes mujeres y el número elevado de carcinomas de tiroides papilares con patrón folicular de riesgo bajo son características de los carcinomas de tiroides papilares relacionados con DICER1.En un estudio se obtuvo el perfil de miRNA de 20 muestras de tejido tiroideo no neoplásico, 8 muestras de tejido adenomatoso y 60 muestras de tejido con cáncer de tiroides pediátrico, 8 de los cuales presentaban variantes de RNasa IIIb de DICER1. Todos los cánceres de tiroides diferenciados con variantes de DICER1 eran foliculares, 6 eran cánceres de tiroides papilares de variante folicular y 2 eran cánceres de tiroides foliculares.[
37 ]
Otras de las alteraciones son las siguientes:[
- Se han descrito reordenamientos de ALK en menos del 10 % de los carcinomas de tiroides papilares y, por lo general, se relacionan con desdiferenciaciones.
- Se han descrito variantes activadoras de AKT1 en el 19 % de los carcinomas de tiroides papilares poco diferenciados recidivantes o metastásicos.
- Los reordenamientos de PPARG están presentes en el 20 % al 50 % de los carcinomas de tiroides foliculares y en menor proporción en las variantes foliculares del carcinoma de tiroides papilar.
- Con frecuencia se encuentran variantes activadoras de TERT en el carcinoma de tiroides papilar poco diferenciado (20–50 %) y en el carcinoma de tiroides anaplásico (30–75 %). Estas variantes también se notificaron en el 10 % al 35 % de los carcinomas de tiroides foliculares y en el 5 % al 15 % de los carcinomas de tiroides papilares. Se cree que las variantes de TERT promueven la progresión tumoral a carcinoma de tiroides papilar poco diferenciado y carcinoma de tiroides anaplásico, y representan un marcador pronóstico negativo.
- Hay alteraciones de TP53 en el 40 % al 80 % de los carcinomas de tiroides anaplásicos y en el 10 % al 35 % de los carcinomas de tiroides papilares poco diferenciados. Se considera que este es el último paso en la progresión tumoral y un marcador de pronóstico poco favorable.
Al analizar los tumores con características histológicas similares, la gama de alteraciones genéticas somáticas difiere entre niños y adultos, en la siguiente forma:[
- Las fusiones génicas que afectan RET o, con menor frecuencia, NTRK representan cerca del 50 % de las alteraciones moleculares en el carcinoma de tiroides diferenciado en la edad pediátrica, en comparación con cerca del 15 % en la edad adulta.
- Las alteraciones en los genes BRAF o RAS, presentes en alrededor del 70 % de los carcinomas de tiroides que se diagnostican en adultos, se observan en el 20 % al 40 % de los tumores en pacientes pediátricos. Se han descrito variantes de BRAF en cerca del 20 % al 30 % de los casos, mientras que las variantes de RAS se encuentran con mucha menos frecuencia en los casos pediátricos (5–10 %).
- Cuando se combinan las evaluaciones del DNA y RNA, es posible identificar alteraciones susceptibles de tratamiento dirigido en cerca del 98 % de los carcinomas de tiroides infantiles.
Tratamiento del carcinoma de tiroides papilar y folicular
Las opciones de tratamiento del carcinoma de tiroides papilar y folicular (diferenciado) son las siguientes:
-
Cirugía . -
Ablación con yodo radiactivo .
Debido a que no es frecuente el cáncer de tiroides diferenciado en los niños, es muy recomendable centralizar la atención en sitios especializados.[
En 2015, la American Thyroid Association (ATA) Task Force on Pediatric Thyroid Cancer publicó directrices para el tratamiento de los nódulos tiroideos y el cáncer de tiroides diferenciado en niños y adolescentes. Estas directrices se basan en la evidencia científica y en opiniones de paneles de expertos con una evaluación cuidadosa del nivel de evidencia.[
Evaluación preoperatoria
Los factores que se deben considerar para la evaluación preoperatoria son los siguientes:
- Un ecografista experimentado debe hacer una palpación del cuello y obtener una ecografía completa de todas las regiones del cuello mediante una sonda de alta resolución y la técnica de Doppler. Antes de la cirugía se debe realizar un examen ecográfico completo.[
6 ,9 ] - Se debe considerar la adición de imágenes transversales (tomografía computarizada [TC] con contraste o imágenes por resonancia magnética) cuando se sospeche invasión del tracto aerodigestivo. Es importante destacar que, si se utilizan medios de contraste yodados, será necesario demorar la evaluación y el tratamiento con yodo radiactivo durante 2 a 3 meses hasta que disminuya la carga total de yodo en el cuerpo.[
9 ] - Es posible considerar la obtención de imágenes del tórax (radiografía o TC) en pacientes con enfermedad considerable en los ganglios linfáticos cervicales.[
9 ] - Se obtiene una centellografía nuclear de la tiroides solo si el paciente presenta al inicio inhibición de la hormona estimulante de la tiroides (TSH).[
9 ] - No se recomienda el uso rutinario de gammagrafía ósea ni de tomografía por emisión de positrones (TEP) con flúor F18-fludesoxiglucosa.[
9 ] - Se deben considerar otras pruebas genéticas o de diagnóstico por imágenes en casos en los que se sospeche enfermedad familiar o extensa.[
6 ]
Cirugía
La tiroidectomía total es el tratamiento esencial del carcinoma de tiroides diferenciado. Lo ideal es que la cirugía de tiroides en los niños la lleve a cabo un cirujano que tenga experiencia en procedimientos endocrinos en niños y en un hospital que cuente con toda la gama de especializaciones pediátricas. La ATA recomienda que la tiroidectomía la haga un cirujano de tiroides experimentado (>30 casos/año) o que se opte por un abordaje multidisciplinario entre un cirujano pediátrico y un cirujano de adultos endocrino o de cabeza y cuello.[
Tiroidectomía
La tiroidectomía total es el tratamiento recomendado para los pacientes con carcinoma papilar o folicular. La recomendación del panel de expertos de la ATA se basa en datos que indican un aumento de incidencia de enfermedad bilateral (30 %) y multifocal (65 %).[
En los pacientes con un tumor unilateral pequeño confinado a la glándula tiroidea, se podría considerar una tiroidectomía subtotal, en la que se deja una pequeña cantidad de tejido tiroideo (<1–2 %) en el punto de entrada del nervio laríngeo recurrente o de las glándulas paratiroideas superiores, lo que disminuye el daño permanente en esas estructuras.[
En un análisis retrospectivo se identificaron factores relacionados con el compromiso bilateral de la tiroides en 115 pacientes pediátricos con cáncer de tiroides bien diferenciado.[
En otro análisis retrospectivo multicéntrico se evaluó la prevalencia y los factores de riesgo de la enfermedad multifocal en 212 pacientes pediátricos con carcinoma de tiroides papilar.[
Las resecciones tiroideas que no llegan a ser una tiroidectomía total se relacionan con tasas de recidiva hasta 10 veces mayores. La tiroidectomía total también permite mejorar el uso del yodo radiactivo para las pruebas de imágenes y el tratamiento.
Disección central del cuello
Se debe realizar una disección terapéutica de los ganglios linfáticos centrales cuando hay indicios clínicos de metástasis centrales o laterales en el cuello.[
En los pacientes sin evidencia clínica de invasión extratiroidea macroscópica o metástasis locorregional, se puede considerar una disección profiláctica central del cuello según la focalidad del tumor y el tamaño del tumor primario. Sin embargo, debido al aumento de mortalidad relacionada con la disección de ganglios linfáticos centrales, es importante evaluar caso por caso los riesgos y beneficios según el alcance de la disección.[
Disección lateral del cuello
La disección radical modificada del cuello se reserva para la enfermedad metastásica que se ha comprobado mediante biopsia en el compartimento lateral (niveles II, III, IV y V). Se recomienda la confirmación citológica de enfermedad metastásica en los ganglios linfáticos laterales del cuello antes de la cirugía.
No se recomienda la disección profiláctica rutinaria lateral de los ganglios linfáticos del cuello.
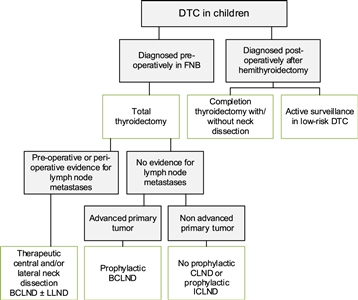
Clasificación y asignación del riesgo
Pese a los datos limitados en el entorno pediátrico, la ATA Task Force recomienda el uso del sistema de clasificación de tumor, ganglio linfático y metástasis (TNM) para asignar a los pacientes a 1 de 3 grupos de riesgo.[
- Riesgo pediátrico bajo según la ATA. Enfermedad confinada a la tiroides con enfermedad N0 o NX, o pacientes con N1a diagnosticada de manera fortuita (metástasis microscópica en un número pequeño de ganglios linfáticos centrales del cuello). Si bien estos pacientes tienen el riesgo más bajo de metástasis a distancia, aún tienen riesgo de enfermedad cervical residual; en particular, si la cirugía inicial no incluyó una disección central del cuello.
- Riesgo pediátrico intermedio según la ATA. Enfermedad extensa N1a o enfermedad N1b mínima. Si bien estos pacientes tienen un riesgo bajo de metástasis a distancia, tienen un aumento del riesgo de una resección incompleta de ganglios linfáticos y de enfermedad cervical persistente.
- Riesgo pediátrico alto según la ATA. Enfermedad regional extensa (N1b) o enfermedad localmente invasora (T4), con metástasis a distancia o sin esta. Los pacientes de este grupo tienen el riesgo más alto de resección incompleta, enfermedad persistente y metástasis a distancia.
Para obtener más información sobre el sistema TNM, consultar la sección
Estadificación posoperatoria y vigilancia a largo plazo
Después de la resección quirúrgica, la enfermedad se estadifica según los hallazgos operatorios para identificar a los pacientes con enfermedad persistente y aquellos con riesgo intermedio o alto de recidiva. La estadificación inicial se deberá realizar dentro de las 12 semanas posteriores a la cirugía para evaluar si hay indicios de enfermedad locorregional persistente e identificar a los pacientes con más probabilidades de beneficiarse de la terapia adicional con 131I. Los niveles de riesgo pediátrico establecidos por la ATA ayudan a determinar el alcance de las pruebas posoperatorias.[
Riesgo pediátrico bajo según la ATA
- La estadificación posoperatoria inicial incluye una evaluación de la tiroglobulina con inhibición de la TSH. No se necesita una gammagrafía diagnóstica con yodo I 123 (123I).
- Se debe procurar obtener concentraciones de 0,5 mUI/l a 1,0 mUI/l con la inhibición de la TSH.
- En los pacientes sin indicios de enfermedad, la vigilancia debe incluir una ecografía a los 6 meses de la operación y luego una vez al año durante 5 años, así como concentraciones de tiroglobulina con inhibición de la TSH cada 3 a 6 meses durante 2 años y luego una vez al año.
- En los niños con anticuerpos antitiroglobulina (común en los pacientes con tiroiditis de Hashimoto), la tendencia de la tiroglobulina es menos confiable y es posible que se necesite una gammagrafía con 123I.
Riesgo pediátrico intermedio según la ATA
- La estadificación posoperatoria inicial incluye evaluación de la tiroglobulina con estimulación de la TSH y una gammagrafía diagnóstica de todo el cuerpo con 123I para estratificación y determinación con 131I posteriores.
- Se debe procurar obtener concentraciones de 0,1 mUI/l a 0,5 mUI/l con la inhibición de la TSH.
- Para los pacientes sin indicios de enfermedad, la vigilancia debe incluir una ecografía a los 6 meses de la cirugía y luego cada 6 a 12 meses durante 5 años (después, con menor frecuencia); las concentraciones de tiroglobulina (durante la terapia de reemplazo hormonal) se miden cada 3 a 6 meses durante 3 años y luego una vez al año.
- Se debe considerar la evaluación de la tiroglobulina con estimulación de la TSH y la gammagrafía diagnóstica con 123I al cabo de 1 o 2 años en los pacientes tratados con 131I.
Riesgo pediátrico alto según la ATA
- La estadificación posoperatoria inicial incluye evaluación de la tiroglobulina con estimulación de la TSH y una gammagrafía diagnóstica de todo el cuerpo con 123I para estratificación y determinación con 131I posteriores.
- Se debe procurar obtener concentraciones inferiores a 0,1 mUI/l con la inhibición de la TSH.
- Para los pacientes sin indicios de enfermedad, la vigilancia debe incluir una ecografía a los 6 meses de la cirugía y luego cada 6 a 12 meses durante 5 años (después, con menor frecuencia); las concentraciones de tiroglobulina (durante la terapia de reemplazo hormonal) se miden cada 3 a 6 meses durante 3 años y luego una vez al año.
- Evaluación de la tiroglobulina con estimulación de la TSH y, posiblemente, una gammagrafía diagnóstica con 123I al cabo de 1 o 2 años en los pacientes tratados con 131I.
En los pacientes con anticuerpos antitiroglobulina, se debe demorar la estadificación posoperatoria para dar tiempo a la depuración de anticuerpos, excepto para pacientes con enfermedad T4 o M1.
Ablación con yodo radiactivo
El objetivo del tratamiento con 131I es disminuir la recidiva y la mortalidad mediante la eliminación de la enfermedad ávida de yodo.[
- La ATA Task Force recomienda el uso de 131I para tratar la enfermedad locorregional ávida de yodo que es persistente o la enfermedad ganglionar que no se puede resecar, así como para las metástasis a distancia que se sabe o se presume que están ávidas de yodo. En los pacientes con enfermedad persistente después de la administración de 131I, se debe evaluar de manera individual la decisión de continuar el tratamiento con 131I de acuerdo con los datos clínicos y la respuesta previa. En los pacientes sin metástasis ganglionar o a distancia, no hay evidencia de que el 131I pueda mejorar la supervivencia o reducir las tasas de recidiva.[
6 ] - Para facilitar la absorción de 131I por la enfermedad residual ávida de yodo, la concentración de la TSH debe ser superior a 30 mUI/l. Esta concentración se alcanza después de interrumpir la levotiroxina durante 14 días como mínimo. También se debe seguir una dieta baja en yodo durante 2 semanas antes del tratamiento. La ablación con yodo radiactivo se debe diferir durante 2 a 3 meses después de la exposición a una TC con contraste yodado y se debe confirmar que la eliminación de yodo en la orina es inferior a 75 µ/l. Para pacientes que no logran una respuesta adecuada de la TSH o no toleran un hipotiroidismo grave, se puede usar TSH humana recombinante.
- La administración terapéutica de 131I a menudo se basa en una dosificación empírica o una dosimetría corporal total. La ATA Task Force no logró recomendar un abordaje específico porque no hay datos de comparación del tratamiento empírico con el tratamiento guiado por dosimetría. Sin embargo, debido a las diferencias de tamaño corporal y la depuración del yodo en los niños en comparación con los adultos, todas las actividades que involucren el uso de 131I deberían ser calculadas por personas expertas en la dosificación para niños.
- Para todos los niños, se recomienda una gammagrafía de todo el cuerpo 4 a 7 días después del tratamiento con 131I. La adición de una TC por emisión de fotón único con una TC convencional integrada (TCEFU-TC) puede ayudar a distinguir la ubicación anatómica de la absorción focal.
Los efectos tardíos del tratamiento con 131I, aunque son poco frecuentes, incluyen disfunción de las glándulas salivales, inhibición de la médula ósea, fibrosis pulmonar y segundas neoplasias malignas.[
44 ] - Debido a que la respuesta a 131I se observa hasta de 15 a 18 meses después del tratamiento, se recomiendan intervalos prolongados de al menos 12 meses antes de volver a administrar el tratamiento.[
6 ]
Evidencia (ablación con yodo radiactivo):
- En un estudio multicéntrico de niños y adolescentes con carcinoma de tiroides diferenciado, 285 pacientes consecutivos se trataron con tiroidectomía total y ablación con yodo radiactivo de acuerdo con las directrices de la ATA.[
45 ]- El 87 % de los pacientes no tenía indicios de enfermedad activa al cabo de una mediana de seguimiento de 133 meses.
- En un estudio de un solo centro sobre cáncer de tiroides diferenciado de riesgo bajo según la ATA diagnosticado entre 2010 y 2020, 95 pacientes se sometieron a tiroidectomía total seguida de tratamiento con 131I en el 53 % de los pacientes.[
46 ]- No hubo diferencia estadística en las tasas de remisión entre los pacientes que recibieron tratamiento con 131I o sin este al cabo de 1 año (70 vs. 68,9 %, respectivamente; P = 0,089) o en la última evaluación clínica (82 vs. 75,6 %; P = 0,534).
- Durante el período del estudio, el uso de 131I en la población de pacientes disminuyó de manera constante, ya que en las ATA Pediatric Differentiated Thyroid Cancer Guidelines de 2015 se recomendó suspender el tratamiento con 131I en pacientes con enfermedad de riesgo bajo. En consecuencia, los pacientes que recibieron tratamiento con 131I tuvieron un seguimiento más largo (mediana, 5,8 años) que aquellos que no lo recibieron (mediana, 3,6 años).
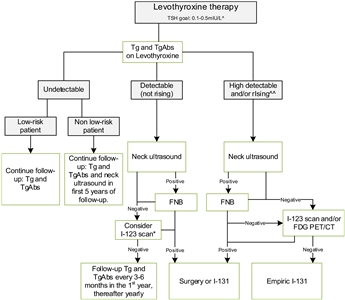
La ETA ha propuesto un plan de seguimiento simplificado que se basa en las concentraciones de tiroglobulina y la ecografía del cuello (consultar la
Tratamiento del carcinoma de tiroides papilar y folicular recidivante
A pesar de presentar una enfermedad más avanzada que los adultos en el cuadro clínico inicial, los niños con cáncer de tiroides diferenciado por lo general tienen una supervivencia excelente con relativamente pocos efectos secundarios.[
Las opciones de tratamiento del carcinoma de tiroides papilar y folicular recidivante incluyen las siguientes:
-
Ablación con yodo radiactivo con 131I . -
Inhibidores de tirosina–cinasas .
Ablación con yodo radiactivo 131I
La ablación con yodo radiactivo 131I suele ser eficaz después de la recidiva.[
Inhibidores de tirosina–cinasas
En los pacientes con enfermedad resistente al tratamiento con 131I, las terapias moleculares dirigidas con inhibidores de tirosina–cinasas (ITC) a veces son una alternativa de tratamiento.
Los ITC con eficacia documentada para el tratamiento de adultos son los siguientes:
- Sorafenib. El sorafenib es un inhibidor de la cinasa de VEGFR, PDGFR y RAS. En un ensayo aleatorizado de fase III, el sorafenib mejoró la SSP en comparación con el placebo (10,8 vs. 5,8 meses) en pacientes adultos con cáncer de tiroides diferenciado localmente avanzado o metastásico resistente al yodo radiactivo.[
50 ] La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el sorafenib en 2013 para el tratamiento de adultos con carcinoma de tiroides diferenciado metastásico en estadio avanzado.Los datos específicos para pediatría son escasos. Sin embargo, en un informe de caso, el sorafenib produjo una respuesta radiográfica en un paciente de 8 años con carcinoma de tiroides papilar metastásico.[
51 ] - Lenvatinib. El lenvatinib es un inhibidor oral de VEGFR, FGFR, PDGFR, RET y KIT. En un estudio aleatorizado de fase III de adultos con cáncer de tiroides diferenciado resistente al tratamiento con 131I, el lenvatinib se relacionó con una mejora significativa de la SSP y la tasa de respuesta en comparación con un placebo.[
52 ] La FDA aprobó el lenvatinib en 2015 para el tratamiento de adultos con carcinoma de tiroides diferenciado resistente al yodo radiactivo y progresivo.Se notificó que 3 niños con carcinoma de tiroides papilar resistente al yodo radiactivo presentaron una respuesta clínica al lenvatinib.[
53 ] - Vemurafenib y dabrafenib (inhibidores de BRAF). Se llevó a cabo un estudio sin enmascaramiento, no aleatorizado de fase II sobre vemurafenib en adultos con carcinoma de tiroides que tenían una enfermedad resistente a 131I, metastásica o irresecable y positiva para la variante BRAF V600E. Ningún participante había recibido tratamiento previo con ITC. Se documentó una tasa de respuesta del 38,5 %.[
54 ] En los pacientes con carcinoma de tiroides anaplásico metastásico o avanzado con la alteración BRAF V600E se demostró una tasa de respuesta del 69 % con la combinación de dabrafenib y el inhibidor de MEK, trametinib.[55 ] - Larotrectinib y entrectinib (inhibidores de NTRK). El larotrectinib se ha utilizado para tratar a pacientes con carcinoma de tiroides positivo para fusión de TRK. En un estudio, los 5 pacientes con carcinoma de tiroides positivo para fusión de TRK que recibieron tratamiento con larotrectinib obtuvieron respuestas parciales o completas.[
56 ] También se notificaron respuestas con entrectinib.[57 ] La FDA aprobó el larotrectinib y el entrectinib para el tratamiento de adultos y niños (restringido a pacientes mayores de 12 años en el caso del entrectinib) con tumores sólidos que presentan todas las siguientes características:[58 ]- Tienen una fusión génica de NTRK sin una variante conocida de resistencia adquirida.
- Son metastásicos o la resección quirúrgica del tumor probablemente produzca morbilidad grave.
- No hay alternativas de tratamiento satisfactorias o la enfermedad progresó después del tratamiento.
- Selpercatinib (inhibidor de RET). En un ensayo de fase I/II de terapia con selpercatinib para pacientes (intervalo de edad, 25–88 años) con cánceres con variante de RET, se inscribió a 19 pacientes con fusión de RET tratados antes por cánceres de tiroides.[
59 ]- De los 19 pacientes, 15 (79 %) alcanzaron respuestas objetivas (1 respuesta completa y 14 respuestas parciales) y la mediana de duración de la respuesta fue de 18,4 meses.
- Los efectos adversos relacionados con el tratamiento de grados 3 y 4 fueron hipertensión (12 %), aumento de las concentraciones de alanina–aminotransferasa (10 %) y aspartato–aminotransferasa (7 %), diarrea (3 %) y prolongación del intervalo QT (2 %).
- En 2024, el FDA otorgó la aprobación completa al selpercatinib para el tratamiento de pacientes adultos y pediátricos de 2 años o más con cáncer de tiroides positivo para fusión de RET en estadio avanzado o metastásico que requieren terapia sistémica y cuya enfermedad es resistente al yodo radiactivo (si el yodo radiactivo fuera apropiado).[
60 ]
- Cabozantinib (inhibidor de VEGFR y RET). En un ensayo aleatorizado con enmascaramiento doble de fase III (COSMIC-311 [NCT03690388]) en pacientes adultos (intervalo de edad, 55–72 años) se comparó el cabozantinib con un placebo. Estos pacientes habían recibido al menos un ITC dirigido a VEGFR para el carcinoma de tiroides diferenciado, y su enfermedad se consideró progresiva y resistente al yodo radiactivo. Se observó una respuesta eficaz en 10 de 67 pacientes que recibieron cabozantinib, en comparación con cero respuestas en el grupo de placebo. La SSP fue de 11 meses (IC 95 %, 7,4–13,8) en el grupo de cabozantinib, en comparación con 1,9 meses (IC 95 %, 1,9–3,7) en el grupo de placebo, con un CRI de 0,22 (IC 95 %, 0,14–0,31).[
61 ] A partir de estos datos, la FDA aprobó el cabozantinib en esta población.[62 ]
Para obtener más información, consultar
Opciones de tratamiento en evaluación clínica del carcinoma de tiroides papilar y folicular recidivante
La información en inglés sobre los ensayos clínicos patrocinados por el Instituto Nacional del Cáncer (NCI) se encuentra en el
Referencias:
- Cahoon EK, Nadyrov EA, Polyanskaya ON, et al.: Risk of Thyroid Nodules in Residents of Belarus Exposed to Chernobyl Fallout as Children and Adolescents. J Clin Endocrinol Metab 102 (7): 2207-2217, 2017.
- Rose J, Wertheim BC, Guerrero MA: Radiation treatment of patients with primary pediatric malignancies: risk of developing thyroid cancer as a secondary malignancy. Am J Surg 204 (6): 881-6; discussion 886-7, 2012.
- Lal G, Groff M, Howe JR, et al.: Risk of subsequent primary thyroid cancer after another malignancy: latency trends in a population-based study. Ann Surg Oncol 19 (6): 1887-96, 2012.
- Lubin JH, Adams MJ, Shore R, et al.: Thyroid Cancer Following Childhood Low-Dose Radiation Exposure: A Pooled Analysis of Nine Cohorts. J Clin Endocrinol Metab 102 (7): 2575-2583, 2017.
- Iglesias ML, Schmidt A, Ghuzlan AA, et al.: Radiation exposure and thyroid cancer: a review. Arch Endocrinol Metab 61 (2): 180-187, 2017 Mar-Apr.
- Lebbink CA, Links TP, Czarniecka A, et al.: 2022 European Thyroid Association Guidelines for the management of pediatric thyroid nodules and differentiated thyroid carcinoma. Eur Thyroid J 11 (6): , 2022.
- Keefe G, Culbreath K, Cherella CE, et al.: Autoimmune Thyroiditis and Risk of Malignancy in Children with Thyroid Nodules. Thyroid 32 (9): 1109-1117, 2022.
- Acquaviva G, Visani M, Repaci A, et al.: Molecular pathology of thyroid tumours of follicular cells: a review of genetic alterations and their clinicopathological relevance. Histopathology 72 (1): 6-31, 2018.
- Francis GL, Waguespack SG, Bauer AJ, et al.: Management Guidelines for Children with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 25 (7): 716-59, 2015.
- Al-Qurayshi Z, Hauch A, Srivastav S, et al.: A National Perspective of the Risk, Presentation, and Outcomes of Pediatric Thyroid Cancer. JAMA Otolaryngol Head Neck Surg 142 (5): 472-8, 2016.
- Shayota BJ, Pawar SC, Chamberlain RS: MeSS: A novel prognostic scale specific for pediatric well-differentiated thyroid cancer: a population-based, SEER outcomes study. Surgery 154 (3): 429-35, 2013.
- Ye B, Shi J, Shen C, et al.: Comparison of differentiated thyroid carcinoma recurrence and its clinical features in children of different ages. Oncotarget 8 (29): 48051-48059, 2017.
- Kim J, Sun Z, Adam MA, et al.: Predictors of nodal metastasis in pediatric differentiated thyroid cancer. J Pediatr Surg 52 (1): 120-123, 2017.
- Lazar L, Lebenthal Y, Steinmetz A, et al.: Differentiated thyroid carcinoma in pediatric patients: comparison of presentation and course between pre-pubertal children and adolescents. J Pediatr 154 (5): 708-14, 2009.
- Redlich A, Luster M, Lorenz K, et al.: Age, American Thyroid Association Risk Group, and Response to Therapy Are Prognostic Factors in Children With Differentiated Thyroid Cancer. J Clin Endocrinol Metab 107 (1): e165-e177, 2022.
- Chesover AD, Vali R, Hemmati SH, et al.: Lung Metastasis in Children with Differentiated Thyroid Cancer: Factors Associated with Diagnosis and Outcomes of Therapy. Thyroid 31 (1): 50-60, 2021.
- Sassolas G, Hafdi-Nejjari Z, Casagranda L, et al.: Thyroid cancers in children, adolescents, and young adults with and without a history of childhood exposure to therapeutic radiation for other cancers. Thyroid 23 (7): 805-10, 2013.
- Lee YA, Lee H, Im SW, et al.: NTRK and RET fusion-directed therapy in pediatric thyroid cancer yields a tumor response and radioiodine uptake. J Clin Invest 131 (18): , 2021.
- Franco AT, Ricarte-Filho JC, Isaza A, et al.: Fusion Oncogenes Are Associated With Increased Metastatic Capacity and Persistent Disease in Pediatric Thyroid Cancers. J Clin Oncol 40 (10): 1081-1090, 2022.
- Tian T, Huang S, Dai H, et al.: Radioactive Iodine-Refractory Pulmonary Metastases of Papillary Thyroid Cancer in Children, Adolescents, and Young Adults. J Clin Endocrinol Metab 108 (2): 306-314, 2023.
- Garner EF, Maizlin II, Dellinger MB, et al.: Effects of socioeconomic status on children with well-differentiated thyroid cancer. Surgery 162 (3): 662-669, 2017.
- Scholfield DW, Lopez J, Eagan A, et al.: Is Multifocality a Predictor of Poor Outcome in Childhood and Adolescent Papillary Thyroid Carcinoma? J Clin Endocrinol Metab 108 (12): 3135-3144, 2023.
- Garcia Alves-Junior PA, de Andrade Barreto MC, de Andrade FA, et al.: Stimulated thyroglobulin and diagnostic 131-iodine whole-body scan as a predictor of distant metastasis and association with response to treatment in pediatric thyroid cancer patients. Endocrine 84 (3): 1081-1087, 2024.
- Christison-Lagay ER, Baertschiger RM, Dinauer C, et al.: Pediatric differentiated thyroid carcinoma: An update from the APSA Cancer Committee. J Pediatr Surg 55 (11): 2273-2283, 2020.
- Dermody S, Walls A, Harley EH: Pediatric thyroid cancer: An update from the SEER database 2007-2012. Int J Pediatr Otorhinolaryngol 89: 121-6, 2016.
- National Cancer Institute: NCCR*Explorer: An interactive website for NCCR cancer statistics. Bethesda, MD: National Cancer Institute.
Available online . Last accessed February 25, 2025. - Brady C, Manning SC, Rudzinski E, et al.: Clinical Outcomes of Diffuse Sclerosing Variant Papillary Thyroid Carcinoma in Pediatric Patients. Laryngoscope 132 (5): 1132-1138, 2022.
- Sugino K, Nagahama M, Kitagawa W, et al.: Distant Metastasis in Pediatric and Adolescent Differentiated Thyroid Cancer: Clinical Outcomes and Risk Factor Analyses. J Clin Endocrinol Metab 105 (11): , 2020.
- Stosic A, Fuligni F, Anderson ND, et al.: Diverse Oncogenic Fusions and Distinct Gene Expression Patterns Define the Genomic Landscape of Pediatric Papillary Thyroid Carcinoma. Cancer Res 81 (22): 5625-5637, 2021.
- Bauer AJ: Molecular Genetics of Thyroid Cancer in Children and Adolescents. Endocrinol Metab Clin North Am 46 (2): 389-403, 2017.
- Cancer Genome Atlas Research Network: Integrated genomic characterization of papillary thyroid carcinoma. Cell 159 (3): 676-90, 2014.
- Sisdelli L, Cordioli MICV, Vaisman F, et al.: AGK-BRAF is associated with distant metastasis and younger age in pediatric papillary thyroid carcinoma. Pediatr Blood Cancer 66 (7): e27707, 2019.
- Bulanova Pekova B, Sykorova V, Mastnikova K, et al.: RET fusion genes in pediatric and adult thyroid carcinomas: cohort characteristics and prognosis. Endocr Relat Cancer 30 (12): , 2023.
- Wasserman JD, Sabbaghian N, Fahiminiya S, et al.: DICER1 Mutations Are Frequent in Adolescent-Onset Papillary Thyroid Carcinoma. J Clin Endocrinol Metab 103 (5): 2009-2015, 2018.
- Chernock RD, Rivera B, Borrelli N, et al.: Poorly differentiated thyroid carcinoma of childhood and adolescence: a distinct entity characterized by DICER1 mutations. Mod Pathol 33 (7): 1264-1274, 2020.
- Onder S, Mete O, Yilmaz I, et al.: DICER1 Mutations Occur in More Than One-Third of Follicular-Patterned Pediatric Papillary Thyroid Carcinomas and Correlate with a Low-Risk Disease and Female Gender Predilection. Endocr Pathol 33 (4): 437-445, 2022.
- Ricarte-Filho JC, Casado-Medrano V, Reichenberger E, et al.: DICER1 RNase IIIb domain mutations trigger widespread miRNA dysregulation and MAPK activation in pediatric thyroid cancer. Front Endocrinol (Lausanne) 14: 1083382, 2023.
- Potter SL, Reuther J, Chandramohan R, et al.: Integrated DNA and RNA sequencing reveals targetable alterations in metastatic pediatric papillary thyroid carcinoma. Pediatr Blood Cancer 68 (1): e28741, 2021.
- Pekova B, Sykorova V, Dvorakova S, et al.: RET, NTRK, ALK, BRAF, and MET Fusions in a Large Cohort of Pediatric Papillary Thyroid Carcinomas. Thyroid 30 (12): 1771-1780, 2020.
- Spinelli C, Strambi S, Rossi L, et al.: Surgical management of papillary thyroid carcinoma in childhood and adolescence: an Italian multicenter study on 250 patients. J Endocrinol Invest 39 (9): 1055-9, 2016.
- Cherella CE, Richman DM, Liu E, et al.: Predictors of Bilateral Disease in Pediatric Differentiated Thyroid Cancer. J Clin Endocrinol Metab 106 (10): e4242-e4250, 2021.
- Banik GL, Shindo ML, Kraimer KL, et al.: Prevalence and Risk Factors for Multifocality in Pediatric Thyroid Cancer. JAMA Otolaryngol Head Neck Surg 147 (12): 1100-1106, 2021.
- Machens A, Elwerr M, Thanh PN, et al.: Impact of central node dissection on postoperative morbidity in pediatric patients with suspected or proven thyroid cancer. Surgery 160 (2): 484-92, 2016.
- Albano D, Bertagna F, Panarotto MB, et al.: Early and late adverse effects of radioiodine for pediatric differentiated thyroid cancer. Pediatr Blood Cancer 64 (11): , 2017.
- Cistaro A, Quartuccio N, Garganese MC, et al.: Prognostic factors in children and adolescents with differentiated thyroid carcinoma treated with total thyroidectomy and RAI: a real-life multicentric study. Eur J Nucl Med Mol Imaging 49 (4): 1374-1385, 2022.
- Bojarsky M, Baran JA, Halada S, et al.: Outcomes of ATA Low-Risk Pediatric Thyroid Cancer Patients Not Treated With Radioactive Iodine Therapy. J Clin Endocrinol Metab 108 (12): 3338-3344, 2023.
- Golpanian S, Perez EA, Tashiro J, et al.: Pediatric papillary thyroid carcinoma: outcomes and survival predictors in 2504 surgical patients. Pediatr Surg Int 32 (3): 201-8, 2016.
- Vergamini LB, Frazier AL, Abrantes FL, et al.: Increase in the incidence of differentiated thyroid carcinoma in children, adolescents, and young adults: a population-based study. J Pediatr 164 (6): 1481-5, 2014.
- Powers PA, Dinauer CA, Tuttle RM, et al.: Treatment of recurrent papillary thyroid carcinoma in children and adolescents. J Pediatr Endocrinol Metab 16 (7): 1033-40, 2003.
- Brose MS, Nutting CM, Jarzab B, et al.: Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet 384 (9940): 319-28, 2014.
- Iyer P, Mayer JL, Ewig JM: Response to sorafenib in a pediatric patient with papillary thyroid carcinoma with diffuse nodular pulmonary disease requiring mechanical ventilation. Thyroid 24 (1): 169-74, 2014.
- Schlumberger M, Tahara M, Wirth LJ, et al.: Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med 372 (7): 621-30, 2015.
- Mahajan P, Dawrant J, Kheradpour A, et al.: Response to Lenvatinib in Children with Papillary Thyroid Carcinoma. Thyroid 28 (11): 1450-1454, 2018.
- Brose MS, Cabanillas ME, Cohen EE, et al.: Vemurafenib in patients with BRAF(V600E)-positive metastatic or unresectable papillary thyroid cancer refractory to radioactive iodine: a non-randomised, multicentre, open-label, phase 2 trial. Lancet Oncol 17 (9): 1272-82, 2016.
- Subbiah V, Kreitman RJ, Wainberg ZA, et al.: Dabrafenib and Trametinib Treatment in Patients With Locally Advanced or Metastatic BRAF V600-Mutant Anaplastic Thyroid Cancer. J Clin Oncol 36 (1): 7-13, 2018.
- Drilon A, Laetsch TW, Kummar S, et al.: Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med 378 (8): 731-739, 2018.
- Chu YH, Dias-Santagata D, Farahani AA, et al.: Clinicopathologic and molecular characterization of NTRK-rearranged thyroid carcinoma (NRTC). Mod Pathol 33 (11): 2186-2197, 2020.
- Bayer HealthCare Pharmaceuticals: VITRAKVI (larotrectinib): Prescribing Information. Stamford, Conn: Loxo Oncology, Inc., 2018.
Available online . Last accessed November 29, 2024. - Wirth LJ, Sherman E, Robinson B, et al.: Efficacy of Selpercatinib in RET-Altered Thyroid Cancers. N Engl J Med 383 (9): 825-835, 2020.
- Eli Lilly and Company: RETEVMO (selpercatinib): Prescribing Information. Indianapolis, Ind: Lilly USA, LLC, 2024.
Available online . Last accessed November 29, 2024. - Brose MS, Robinson B, Sherman SI, et al.: Cabozantinib for radioiodine-refractory differentiated thyroid cancer (COSMIC-311): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 22 (8): 1126-1138, 2021.
- Duke ES, Barone AK, Chatterjee S, et al.: FDA Approval Summary: Cabozantinib for Differentiated Thyroid Cancer. Clin Cancer Res 28 (19): 4173-4177, 2022.
Cáncer de tiroides medular
El carcinoma de tiroides medular es una forma rara de carcinoma de tiroides que se origina en las células C parafoliculares secretoras de calcitonina y representa menos del 10 % de todos los casos de carcinoma de tiroides en niños.[
Factores de riesgo
En los niños, el carcinoma de tiroides medular por lo general se relaciona con variantes patogénicas germinales de RET en el contexto del síndrome de neoplasia endocrina múltiple de tipo 2 (NEM2 o MEN2).[
En un estudio de una sola institución se analizó de manera retrospectiva a 144 pacientes de 21 años o menos con carcinoma de tiroides medular que se presentaron entre 1961 y 2019.[
Cuadro clínico inicial y factores pronósticos
Los niños con cáncer de tiroides por lo general presentan una masa tiroidea con adenopatía cervical indolora o sin ella.[
Los niños con carcinoma de tiroides medular presentan una evolución clínica de gran malignidad; el 50 % de los pacientes tienen metástasis hematógenas en el momento del diagnóstico.[
En una revisión de 430 pacientes de 0 a 21 años con cáncer de tiroides medular, se notificó que el pronóstico más precario se relacionó con edad más avanzada (16–21 años) en el momento del diagnóstico, tumor de más de 2 cm de diámetro, márgenes positivos después de la tiroidectomía total y metástasis ganglionares.[
Entre 1997 y 2019, el registro de la German Society for Pediatric Oncology and Hematology–Malignant Endocrine Tumors identificó un total de 57 pacientes con carcinoma de tiroides medular y 17 pacientes con hiperplasia de células C.[
- La tasa de supervivencia general (SG) fue del 87 % y la tasa de supervivencia sin complicaciones (SSC) fue del 52 %.
- En total, el 96,4 % de los pacientes presentaban síndromes de NEM2; 37 de 42 pacientes tenían NEM2A y 3 de 28 pacientes tenían NEM2B (variante RET M918T).
- Las tasas de SSC a 10 años fueron del 78 % en los pacientes con NEM2A y del 38 % en los pacientes con NEM2B (P < 0,001).
- En análisis multivariantes, el compromiso ganglionar y las concentraciones elevadas posoperatorias de calcitonina fueron factores pronósticos adversos importantes para la SSC.
En niños con NEM2B hereditaria, el carcinoma de tiroides medular a veces se detecta durante el primer año de vida y es posible que ocurran metástasis ganglionares antes de los 5 años de edad. El reconocimiento de neuromas mucosos, antecedentes de alacrimia, estreñimiento (secundario a ganglioneuromatosis intestinal) y características faciales y hábito marfanoide es crítico para el diagnóstico temprano porque la variante RET M918T, asociada a NEM2B, es muchas veces una variante de novo. Cerca del 50 % de los pacientes con NEM2B presentan un feocromocitoma. Hay un grado variable de riesgo de presentar feocromocitoma e hiperparatiroidismo en la NEM2A, según la variante específica de RET.[
El Instituto Nacional del Cáncer está llevando a cabo un estudio sobre la evolución natural del cáncer de tiroides medular en niños y adultos jóvenes (NCT01660984).
Para obtener más información, consultar
Características histológicas y moleculares del cáncer de tiroides medular
Los tumores de tiroides se clasifican como adenomas o carcinomas.[
El carcinoma de tiroides medular es una neoplasia maligna neuroendocrina derivada de las células C parafoliculares de la glándula tiroides que se originan en la cresta neural. En los niños, el carcinoma de tiroides medular es un trastorno monogénico causado por una variante de ganancia de función hereditaria o de novo en el protooncogén RET que se relaciona con NEM2A o NEM2B, según la variante específica.[
Tratamiento del carcinoma de tiroides medular
Los carcinomas de tiroides medular se relacionan con frecuencia con el síndrome de NEM2. Para obtener más información, consultar
Las opciones de tratamiento del carcinoma de tiroides medular son las siguientes:
-
Cirugía . -
Terapia con inhibidores de tirosina–cinasas .
Cirugía
El tratamiento de los niños con carcinoma de tiroides medular es sobre todo quirúrgico. Los investigadores concluyeron que la disección profiláctica de los ganglios linfáticos centrales no se debería realizar en pacientes con cáncer de tiroides medular hereditario si sus concentraciones séricas basales de calcitonina son inferiores a 40 pg/ml.[
La mayoría de los casos de carcinoma de tiroides medular en la niñez se presentan en el contexto de los síndromes NEM2A y NEM2B. En esos casos familiares, se indican pruebas y asesoramiento genético tempranos, y se recomienda cirugía profiláctica para los niños con una variante patogénica germinal de RET. Las fuertes correlaciones genotipo-fenotipo facilitaron la formulación de directrices de intervención, que incluyen exámenes de detección y la edad en la que se debería realizar la tiroidectomía profiláctica.[
Evidencia (cirugía):
- En un análisis retrospectivo se identificaron 167 niños con variantes de RET que se sometieron a tiroidectomía profiláctica. En este grupo participaron 109 pacientes sin una disección ganglionar central simultánea y 58 con una disección ganglionar central simultánea. El hipoparatiroidismo posoperatorio fue más frecuente en niños mayores (32 % en el grupo de edad más avanzada vs. 3 % en el grupo de edad más joven; P = 0,002), con independencia de si se llevó a cabo una disección de ganglios linfáticos centrales. Tres niños presentaron parálisis del nervio laríngeo recurrente después de someterse a disección de los ganglios linfáticos centrales (P = 0,040). Todas las complicaciones se resolvieron en un plazo de 6 meses. La normalización de las concentraciones de calcitonina sérica posoperatoria fue posible en 114 de los 115 niños (99,1 %) que presentaron un aumento en los valores preoperatorios. Los niños se clasificaron en grupos de riesgo según el tipo específico de variante de RET (consultar el
Cuadro 2 ).[16 ]- En la categoría de riesgo más alto, se encontró carcinoma de tiroides medular en 5 de 6 niños (83 %) de 3 años o menos.
- En la categoría de riesgo alto, se encontró carcinoma de tiroides medular en 6 de 20 niños (30 %) de 3 años o menos, 16 de 36 niños (44 %) de 4 a 6 años, y 11 de 16 niños (69 %) de 7 a 12 años (P = 0,081).
- En la categoría de riesgo moderado, se encontró carcinoma de tiroides medular en 1 de 9 niños (11 %) de 3 años o menos, 1 de 26 niños (4 %) de 4 a 6 años, 3 de 26 niños (12 %) de 7 a 12 años, y 7 de 16 niños (44 %) de 13 a 18 años (P = 0,006).
La American Thyroid Association ha propuesto las siguientes directrices para la tiroidectomía profiláctica en niños con carcinoma de tiroides medular hereditario (consultar el
| | Categoría de riesgo de carcinoma de tiroides medular | ||
|---|---|---|---|
| | Más alto (NEM2B) | Alto (NEM2A) | Moderado (NEM2A) |
| NEM2A = neoplasia endocrina múltiple de tipo 2A; NEM2B = neoplasia endocrina múltiple de tipo 2B. | |||
| a Adaptación de Wells et al.[ |
|||
| Variante de RET | M918T | A883F, C634F/G/R/S/W/Y | G533C, C609F/G/R/S/Y, C611F/G/S/Y/W, C618F/R/S, C620F/R/S, C630R/Y, D631Y, K666E, E768D, L790F, V804L, V804M, S891A, R912P |
| Edad para la tiroidectomía profiláctica | Tiroidectomía total en el primer año de vida, preferentemente en los primeros meses de vida. | Tiroidectomía total a los 5 años o antes según la concentración de calcitonina sérica. | Tiroidectomía total cuando las concentraciones de calcitonina sérica excedan los límites normales o en otro momento oportuno si los padres prefieren evitar un período de vigilancia largo. |
Terapia con inhibidor de tirosina–cinasas
Se evaluaron y aprobaron varios inhibidores de tirosina–cinasas (ITC) para pacientes con cáncer de tiroides medular en estadio avanzado.
- Vandetanib. El vandetanib es un inhibidor de la cinasa de RET, VEGFR y de la señalización del EGFR. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el vandetanib para el tratamiento del cáncer de tiroides medular sintomático o progresivo en pacientes adultos con enfermedad irresecable, localmente avanzada o metastásica. La aprobación se fundamentó en un ensayo aleatorizado de fase III controlado con placebo en el que se observó una mejora notable de la supervivencia sin progresión (SSP) en los pacientes asignados al azar para recibir vandetanib (cociente de riesgos instantáneos, 0,35). En el ensayo también se observó una ventaja en la tasa de respuesta objetiva para los pacientes que recibieron vandetanib (44 vs. 1 % para el grupo de placebo).[
17 ,18 ]En un ensayo de fase I/II, se administró vandetanib a niños con carcinoma de tiroides medular localmente avanzado o metastásico. De 16 pacientes, solo 1 no respondió al tratamiento y 7 presentaron respuestas parciales con una tasa de respuesta objetiva del 44 %. La enfermedad recidivó en 3 de esos pacientes, pero 11 de 16 pacientes tratados con vandetanib seguían recibiendo la terapia en el momento del informe. La duración de la terapia en la cohorte completa osciló entre 2 y 52 meses, con una mediana de 27 meses.[
19 ] En una evaluación de los desenlaces a largo plazo en una cohorte de 17 niños y adolescentes con carcinoma de tiroides medular avanzado que recibieron vandetanib, se notificó una mediana de SSP de 6,7 años y una tasa de SG a 5 años del 88,2 %.[20 ] - Cabozantinib. El cabozantinib es un inhibidor de las cinasas de RET, MET y VEGFR. También ha demostrado actividad contra el cáncer de tiroides medular irresecable (10 de 35 pacientes adultos [29 %] presentaron respuestas parciales).[
21 ] En un ensayo con enmascaramiento doble de fase III, se comparó el cabozantinib con un placebo en adultos con carcinoma de tiroides medular progresivo metastásico.[22 ] La SSP estimada fue de 11,2 meses en los pacientes que recibieron cabozantinib y de 4 meses en los pacientes que recibieron el placebo. Al cabo de 1 año, el 47,3 % de los pacientes tratados con cabozantinib estaban vivos y sin progresión, en comparación con el 7,2 % de los pacientes que recibieron el placebo. Los efectos adversos importantes derivaron en la reducción de las dosis en el 79 % de los pacientes e interrupción del tratamiento con cabozantinib en el 16 % de los pacientes. La FDA aprobó el cabozantinib en 2012 para el tratamiento de adultos con cáncer de tiroides medular metastásico. - Selpercatinib. El selpercatinib es un inhibidor de RET. En un ensayo de fase I/II de terapia con selpercatinib para pacientes con cánceres que presentan alteración de RET, se inscribieron 55 pacientes con cáncer de tiroides medular (intervalo de edad, 17–84 años) que habían recibido tratamiento con vandetanib o cabozantinib y 88 pacientes con cáncer de tiroides medular (intervalo de edad, 15–82 años) que no habían recibido tratamiento con vandetanib o cabozantinib.[
23 ]- En la cohorte que ya había recibido tratamiento, el 69 % de los pacientes tuvieron una respuesta objetiva, y la mediana de duración de las respuestas no se había alcanzado al momento de una mediana de seguimiento de 14 meses.
- En la cohorte de pacientes sin tratamiento previo, el 73 % de los pacientes logró una respuesta objetiva con una mediana de duración de la respuesta de 22 meses.
- Los efectos adversos relacionados con el tratamiento de grados 3 y 4 fueron hipertensión (12 %), aumento de las concentraciones de alanina–aminotransferasa (10 %) y aspartato–aminotransferasa (7 %), diarrea (3 %) y prolongación del intervalo QT (2 %).
- En una cohorte pequeña de 6 niños con carcinoma de tiroides medular recidivante tratados con selpercatinib, todos los pacientes tuvieron respuestas duraderas al cabo de una mediana de seguimiento de 13 meses.[
24 ] - En 2024, la FDA otorgó la aprobación completa al selpercatinib para el tratamiento de pacientes adultos y pediátricos de 2 años o más con cáncer de tiroides medular positivo para fusión RET avanzado o metastásico que requieren terapia sistémica.[
25 ]
Para obtener más información, consultar
Opciones de tratamiento en evaluación clínica para el carcinoma de tiroides medular
La información en inglés sobre los ensayos clínicos patrocinados por el NCI se encuentra en el
Referencias:
- Dermody S, Walls A, Harley EH: Pediatric thyroid cancer: An update from the SEER database 2007-2012. Int J Pediatr Otorhinolaryngol 89: 121-6, 2016.
- Viola D, Romei C, Elisei R: Medullary thyroid carcinoma in children. Endocr Dev 26: 202-13, 2014.
- Bauer AJ: Molecular Genetics of Thyroid Cancer in Children and Adolescents. Endocrinol Metab Clin North Am 46 (2): 389-403, 2017.
- Hensley SG, Hu MI, Bassett RL, et al.: Pediatric Medullary Thyroid Carcinoma: Clinical Presentations and Long-Term Outcomes in 144 Patients Over 6 Decades. J Clin Endocrinol Metab 109 (9): 2256-2268, 2024.
- Al-Qurayshi Z, Hauch A, Srivastav S, et al.: A National Perspective of the Risk, Presentation, and Outcomes of Pediatric Thyroid Cancer. JAMA Otolaryngol Head Neck Surg 142 (5): 472-8, 2016.
- Acquaviva G, Visani M, Repaci A, et al.: Molecular pathology of thyroid tumours of follicular cells: a review of genetic alterations and their clinicopathological relevance. Histopathology 72 (1): 6-31, 2018.
- Francis GL, Waguespack SG, Bauer AJ, et al.: Management Guidelines for Children with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 25 (7): 716-59, 2015.
- Waguespack SG, Rich TA, Perrier ND, et al.: Management of medullary thyroid carcinoma and MEN2 syndromes in childhood. Nat Rev Endocrinol 7 (10): 596-607, 2011.
- Raval MV, Sturgeon C, Bentrem DJ, et al.: Influence of lymph node metastases on survival in pediatric medullary thyroid cancer. J Pediatr Surg 45 (10): 1947-54, 2010.
- Kuhlen M, Frühwald MC, Dunstheimer DPA, et al.: Revisiting the genotype-phenotype correlation in children with medullary thyroid carcinoma: A report from the GPOH-MET registry. Pediatr Blood Cancer 67 (4): e28171, 2020.
- Wells SA, Asa SL, Dralle H, et al.: Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 25 (6): 567-610, 2015.
- Dinauer C, Francis GL: Thyroid cancer in children. Endocrinol Metab Clin North Am 36 (3): 779-806, vii, 2007.
- Vasko V, Bauer AJ, Tuttle RM, et al.: Papillary and follicular thyroid cancers in children. Endocr Dev 10: 140-72, 2007.
- Halac I, Zimmerman D: Thyroid nodules and cancers in children. Endocrinol Metab Clin North Am 34 (3): 725-44, x, 2005.
- Machens A, Elwerr M, Thanh PN, et al.: Impact of central node dissection on postoperative morbidity in pediatric patients with suspected or proven thyroid cancer. Surgery 160 (2): 484-92, 2016.
- Machens A, Elwerr M, Lorenz K, et al.: Long-term outcome of prophylactic thyroidectomy in children carrying RET germline mutations. Br J Surg 105 (2): e150-e157, 2018.
- Wells SA, Robinson BG, Gagel RF, et al.: Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phase III trial. J Clin Oncol 30 (2): 134-41, 2012.
- Thornton K, Kim G, Maher VE, et al.: Vandetanib for the treatment of symptomatic or progressive medullary thyroid cancer in patients with unresectable locally advanced or metastatic disease: U.S. Food and Drug Administration drug approval summary. Clin Cancer Res 18 (14): 3722-30, 2012.
- Fox E, Widemann BC, Chuk MK, et al.: Vandetanib in children and adolescents with multiple endocrine neoplasia type 2B associated medullary thyroid carcinoma. Clin Cancer Res 19 (15): 4239-48, 2013.
- Kraft IL, Akshintala S, Zhu Y, et al.: Outcomes of Children and Adolescents with Advanced Hereditary Medullary Thyroid Carcinoma Treated with Vandetanib. Clin Cancer Res 24 (4): 753-765, 2018.
- Kurzrock R, Sherman SI, Ball DW, et al.: Activity of XL184 (Cabozantinib), an oral tyrosine kinase inhibitor, in patients with medullary thyroid cancer. J Clin Oncol 29 (19): 2660-6, 2011.
- Elisei R, Schlumberger MJ, Müller SP, et al.: Cabozantinib in progressive medullary thyroid cancer. J Clin Oncol 31 (29): 3639-46, 2013.
- Wirth LJ, Sherman E, Robinson B, et al.: Efficacy of Selpercatinib in RET-Altered Thyroid Cancers. N Engl J Med 383 (9): 825-835, 2020.
- Shankar A, Kurzawinski T, Ross E, et al.: Treatment outcome with a selective RET tyrosine kinase inhibitor selpercatinib in children with multiple endocrine neoplasia type 2 and advanced medullary thyroid carcinoma. Eur J Cancer 158: 38-46, 2021.
- Eli Lilly and Company: RETEVMO (selpercatinib): Prescribing Information. Indianapolis, Ind: Lilly USA, LLC, 2024.
Available online . Last accessed November 29, 2024.
Consideraciones especiales para el tratamiento de niños con cáncer
El cáncer en niños y adolescentes es raro, aunque desde 1975 se ha observado un aumento gradual de la incidencia general.[
- Médicos de atención primaria.
- Cirujanos pediatras.
- Patólogos.
- Radioncólogo pediatras.
- Oncólogos y hematólogos pediatras.
- Oftalmólogos.
- Especialistas en rehabilitación.
- Enfermeros de oncología pediátrica.
- Trabajadores o asistentes sociales.
- Profesionales de la vida infantil.
- Psicólogos.
- Nutricionistas y dietistas.
Para obtener información específica sobre los cuidados médicos de apoyo para niños y adolescentes con cáncer, consultar los resúmenes de
La American Academy of Pediatrics estableció pautas para los centros de oncología pediátrica y su función en el tratamiento de los pacientes con cáncer infantil.[
Se han logrado mejoras notables en la supervivencia de niños y adolescentes con cáncer. Entre 1975 y 2020, la mortalidad por cáncer infantil disminuyó en más del 50 %.[
El cáncer infantil (cáncer en edad pediátrica) es una enfermedad rara con cerca de 15 000 casos anuales diagnosticados antes de los 20 años de edad en los Estados Unidos.[
La designación de un tumor raro es diferente entre los grupos pediátricos y de adultos. En el caso de los adultos, se considera que un cáncer es raro cuando su incidencia anual es inferior a 6 casos por 100 000 personas. Representan hasta el 24 % de los cánceres diagnosticados en la Unión Europea y alrededor del 20 % de los cánceres diagnosticados en los Estados Unidos.[
- En una iniciativa conjunta de la European Union Joint Action on Rare Cancers y el European Cooperative Study Group for Rare Pediatric Cancers se estimó que el 11 % de todos los cánceres en pacientes menores de 20 años se podrían clasificar como muy raros. Este grupo de consenso definió los cánceres muy raros como los cánceres con incidencia anual inferior a 2 casos por millón de personas. Sin embargo, también se incluyen en este grupo de tumores muy raros otros 3 tipos histológicos (carcinoma de tiroides, melanoma y cáncer de testículo) con incidencias superiores a 2 casos por millón de personas, porque se cuenta con poco conocimiento y experiencia sobre el tratamiento de estos tumores.[
9 ] - El Children's Oncology Group (COG) define los cánceres raros en pediatría según la lista del subgrupo XI de la International Classification of Childhood Cancer, en la que se incluyen los cánceres de tiroides, los cánceres de piel melanoma y no melanoma, además de los múltiples tipos de carcinomas (por ejemplo, los carcinomas de corteza suprarrenal, los carcinomas de nasofaringe y la mayoría de los carcinomas de tipo adulto, como los cánceres de mama, los cánceres colorrectales, etc.).[
10 ] Estos cánceres representan casi el 5 % de aquellos diagnosticados entre los 0 y 14 años de edad y casi el 27 % de los que se diagnostican entre los 15 a 19 años de edad.[4 ]La mayoría de los cánceres del subgrupo XI son melanomas o cánceres de tiroides, mientras que otros tipos de cáncer solo representan el 2 % de los cánceres diagnosticados entre los 0 y 14 años de edad y el 9,3 % de los cánceres entre los 15 y 19 años de edad.
Estudiar estos cánceres raros es un reto por el número bajo de pacientes con cualquier diagnóstico individual, el predominio de estos cánceres raros en adolescentes y la carencia de ensayos clínicos con adolescentes que tienen estos cánceres.
También es posible obtener información sobre estos tumores en fuentes relacionadas con el cáncer en adultos, por ejemplo,
Referencias:
- Smith MA, Seibel NL, Altekruse SF, et al.: Outcomes for children and adolescents with cancer: challenges for the twenty-first century. J Clin Oncol 28 (15): 2625-34, 2010.
- American Academy of Pediatrics: Standards for pediatric cancer centers. Pediatrics 134 (2): 410-4, 2014.
Also available online . Last accessed February 25, 2025. - Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014.
- National Cancer Institute: NCCR*Explorer: An interactive website for NCCR cancer statistics. Bethesda, MD: National Cancer Institute.
Available online . Last accessed February 25, 2025. - Surveillance Research Program, National Cancer Institute: SEER*Explorer: An interactive website for SEER cancer statistics. Bethesda, MD: National Cancer Institute.
Available online . Last accessed December 30, 2024. - Ward E, DeSantis C, Robbins A, et al.: Childhood and adolescent cancer statistics, 2014. CA Cancer J Clin 64 (2): 83-103, 2014 Mar-Apr.
- Gatta G, Capocaccia R, Botta L, et al.: Burden and centralised treatment in Europe of rare tumours: results of RARECAREnet-a population-based study. Lancet Oncol 18 (8): 1022-1039, 2017.
- DeSantis CE, Kramer JL, Jemal A: The burden of rare cancers in the United States. CA Cancer J Clin 67 (4): 261-272, 2017.
- Ferrari A, Brecht IB, Gatta G, et al.: Defining and listing very rare cancers of paediatric age: consensus of the Joint Action on Rare Cancers in cooperation with the European Cooperative Study Group for Pediatric Rare Tumors. Eur J Cancer 110: 120-126, 2019.
- Pappo AS, Krailo M, Chen Z, et al.: Infrequent tumor initiative of the Children's Oncology Group: initial lessons learned and their impact on future plans. J Clin Oncol 28 (33): 5011-6, 2010.
Actualizaciones más recientes a este resumen (04 / 10 / 2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Este resumen fue objeto de revisión integral.
El
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de tiroides infantil. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de tiroides infantil son:
- Denise Adams, MD (Children's Hospital Boston)
- Karen J. Marcus, MD, FACR (Dana-Farber of Boston Children's Cancer Center and Blood Disorders Harvard Medical School)
- William H. Meyer, MD
- Paul A. Meyers, MD (Memorial Sloan-Kettering Cancer Center)
- Thomas A. Olson, MD (Aflac Cancer and Blood Disorders Center of Children's Healthcare of Atlanta - Egleston Campus)
- Arthur Kim Ritchey, MD (Children's Hospital of Pittsburgh of UPMC)
- Carlos Rodriguez-Galindo, MD (St. Jude Children's Research Hospital)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como "En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]".
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Tratamiento del cáncer de tiroides infantil. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como "estándar" o "en evaluación clínica". Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del
Última revisión: 2025-04-10
Esta información no reemplaza el consejo de un médico. Ignite Healthwise, LLC, niega toda garantía y responsabilidad por el uso de esta información. El uso que usted haga de esta información implica que usted acepta los
Healthwise, Healthwise para cada decisión de la salud, y el logo de Healthwise son marcas de fábrica de Ignite Healthwise, LLC.
Page Footer
Quiero...
Audiencia
Sitios seguros para miembros
Información sobre The Cigna Group
Aviso legal
Los planes individuales y familiares de seguro médico y dental están asegurados por Cigna Health and Life Insurance Company (CHLIC), Cigna HealthCare of Arizona, Inc., Cigna HealthCare of Illinois, Inc., Cigna HealthCare of Georgia, Inc., Cigna HealthCare of North Carolina, Inc., Cigna HealthCare of South Carolina, Inc. y Cigna HealthCare of Texas, Inc. Los planes de beneficios de salud y de seguro de salud de grupo están asegurados o administrados por CHLIC, Connecticut General Life Insurance Company (CGLIC) o sus afiliadas (puedes ver
Todas las pólizas de seguros y los planes de beneficios de grupo contienen exclusiones y limitaciones. Para conocer la disponibilidad, los costos y detalles completos de la cobertura, comunícate con un agente autorizado o con un representante de ventas de Cigna. Este sitio web no está dirigido a los residentes de New Mexico.