Comprar planes
Comprar tu propia cobertura
Planes a través de tu empleador
Conoce sobre los beneficios médicos, dentales, de farmacia y voluntarios que tu empleador puede ofrecer.
Aprender
¿Vives o trabajas fuera del país?
Tratamiento del meduloblastoma y otros tumores embrionarios del sistema nervioso central infantil (PDQ®) : Tratamiento - información para profesionales de salud [NCI]
Esta información es producida y suministrada por el Instituto Nacional del Cáncer (NCI, por sus siglas en inglés). La información en este tema puede haber cambiado desde que se escribió. Para la información más actual, comuníquese con el Instituto Nacional del Cáncer a través del Internet en la página web http://cancer.gov o llame al 1-800-4-CANCER.
Información general sobre el meduloblastoma y otros tumores embrionarios del sistema nervioso central
Clasificación de la Organización Mundial de la Salud de los tumores embrionarios del sistema nervioso central y del pineoblastoma
Los tumores embrionarios son un grupo de lesiones biológicamente heterogéneas que comparten la tendencia a diseminarse por el recorrido del líquido cefalorraquídeo (LCR) en el sistema nervioso central (SNC). Aunque hay una variabilidad importante, estos tumores se agrupan juntos desde el punto de vista histológico porque se componen, al menos en parte, de células hipercromáticas (tumores de células azules en tinción estándar), con citoplasma escaso, concentración densa y grado alto de actividad mitótica. En cierta medida, es posible utilizar otras características histológicas e inmunohistoquímicas, como el grado de transformación celular visible y los linajes celulares identificables (ependimarios, gliales, etc.), para diferenciar estos tumores. Sin embargo, a partir de una convención aceptada por la Organización Mundial de la Salud (OMS), estos tumores también se dividen según el supuesto lugar del SNC en el que se originan. Los estudios moleculares han confirmado las diferencias entre los tumores que surgen en diferentes áreas del encéfalo y dan credibilidad parcial a este enfoque de clasificación.[
En 2016, la OMS propuso un sistema de clasificación de integración fenotípica y genotípica para los tumores del SNC en el que se establece un diagnóstico escalonado a partir del grado de la OMS y de las clasificaciones histológicas y moleculares.[
El diagnóstico patológico de los tumores embrionarios se basa sobre todo en las características microscópicas histológicas e inmunohistológicas. No obstante, los estudios genéticos moleculares se emplean cada vez más para subclasificar los tumores embrionarios. Se están usando estos hallazgos moleculares y genéticos para estratificar el riesgo y planificar el tratamiento.[
La siguiente es la clasificación de la OMS de 2021 para los tumores embrionarios:[
-
Meduloblastoma .- Meduloblastoma definido por características moleculares.
- Meduloblastoma con activación de WNT.
- Meduloblastoma con activación de SHH y TP53 natural.
- Meduloblastoma con activación de SHH y alteración de TP53.
- Meduloblastoma sin WNT ni SHH.
- Meduloblastoma definido por características histológicas.
- Meduloblastoma nodular desmoplásico.
- Meduloblastoma con nodularidad extensa.
- Meduloblastoma de células grandes.
- Meduloblastoma anaplásico.
- Meduloblastoma definido por características moleculares.
- Otros tumores embrionarios del SNC.
- Tumor teratoide rabdoide atípico.
- Tumor neuroepitelial cribiforme.
- Tumor embrionario con rosetas de capas múltiples.
- Neuroblastoma del SNC con activación de FOXR2.
- Tumor del SNC con duplicación interna en tándem de BCOR.
- Tumor embrionario del SNC, sin clasificar/sin otra indicación.
La OMS clasifica el pineoblastoma como un tumor del parénquima pineal, aunque en el pasado se agrupó de forma convencional con los tumores embrionarios. La siguiente es la clasificación de la OMS de 2021 para estos tumores:[
- Pineocitoma.
- Tumor del parénquima pineal de diferenciación intermedia.
- Pineoblastoma.
- Tumor papilar de la región pineal.
- Tumor mixoide desmoplásico de la región pineal con alteración de SMARCB1.
Debido a que el tratamiento de los pineoblastomas es muy similar al de los tumores embrionarios, en este resumen se analizan los pineoblastomas. Se identificó un tumor muy similar, el tumor de parénquima pineal de diferenciación intermedia, pero no se considera un tumor embrionario y se presenta principalmente en adultos.[
Características anatómicas
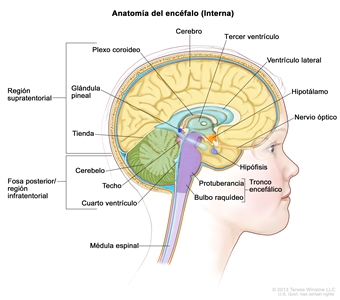
Incidencia
Los tumores embrionarios comprenden entre el 20 % y el 25 % de los tumores primarios del SNC (tumores encefálicos malignos y astrocitomas pilocíticos) que surgen en niños. Estos tumores se presentan a lo largo de todo el grupo etario pediátrico, pero suelen agruparse en edades tempranas. La incidencia de tumores embrionarios en los niños de 1 a 9 años es de 5 a 10 veces más alta que en los adultos (consultar el
| Grupo etario (años) | Tasa de incidencia anual (casos por millón) |
|---|---|
| a Fuente: Childhood cancer by the International Classification of Childhood Cancer[ |
|
| <5 | 11 |
| 5–9 | 7 |
| 10–19 | 3–4 |
Los meduloblastomas representan la gran mayoría de los tumores embrionarios infantiles y, por definición, se presentan en la fosa posterior (consultar la
Evaluación diagnóstica y estadificación
Los estudios de imágenes y el análisis del LCR se incluyen en la evaluación para el diagnóstico y la estadificación.
Estudios con imágenes
Por lo general, el diagnóstico se establece mediante imágenes por resonancia magnética (IRM) o tomografía computarizada (TC). Se prefieren las IRM porque es el método que permite visualizar mejor la relación anatómica entre el tumor y el encéfalo circundante, así como la diseminación tumoral.[
Después del diagnóstico, la evaluación de los tumores embrionarios es bastante similar; en esencia, es independiente del subtipo histológico y de la ubicación del tumor. Dada la tendencia de estos tumores a diseminarse por todo el SNC de manera temprana en el curso de la enfermedad, se indica la evaluación de imágenes del sistema nervioso central obtenidas mediante IRM de todo el encéfalo, la médula espinal y la columna vertebral. Es preferible captar las imágenes antes de la cirugía para evitar artefactos posoperatorios, en especial, sangre. Estas imágenes a veces son difíciles de interpretar y se deben obtener por lo menos en dos planos: con contraste (gadolinio) y sin contraste.[
- En los análisis por subgrupos se identificó una proporción más alta de hallazgos equívocos en el subgrupo de SHH (P = 0,007).
- La supervivencia general (SG) a 5 años en niños con hallazgos equívocos en la IRM (80 %) no fue diferente a la SG a 5 años en pacientes con hallazgos normales (84,8 %) en la IRM, mientras que la SG en los pacientes con metástasis M3 fue inferior (54,7 %) (P = 0,02).
No obstante, en un estudio prospectivo del Children's Oncology Group (COG) se trató a 400 niños sin enfermedad metastásica con una dosis reducida (23,4 Gy) de radioterapia craneoespinal. En casi el 20 % de los pacientes con revisión neurorradiográfica central se encontraron indicios de posible enfermedad residual excesiva o enfermedad metastásica, o se consideró que las imágenes eran inadecuadas para evaluar de forma completa el sistema nervioso central. Para los pacientes con imágenes revisadas de manera central, los niños considerados con enfermedad metastásica tuvieron una SG precaria, en comparación con aquellos con enfermedad no diseminada. El subgrupo con imágenes inadecuadas, según la revisión central, tuvo una tasa de supervivencia intermedia entre la de los niños con imágenes adecuadas y la de los que tenían enfermedad metastásica.[
Después de la cirugía, se indica la obtención de imágenes del sitio del tumor primario para determinar la extensión de la enfermedad residual.
Análisis del líquido cefalorraquídeo
Después de la cirugía, se hace un análisis del líquido cefalorraquídeo (LCR) lumbar, si se considera inocuo. Las neuroimágenes y el análisis del LCR se consideran complementarios, porque hasta un 10 % de los pacientes presentarán células tumorales que flotan libremente en el LCR sin indicios evidentes de enfermedad leptomeníngea en la IRM.[
El análisis del LCR se hace de manera convencional de 14 a 21 días después de la cirugía. Si el LCR se obtiene en el transcurso de los 14 días que siguen a la operación, es posible que la detección de células tumorales en el LCR se relacione con la intervención quirúrgica. En la mayoría de los sistemas de estadificación, si se obtiene líquido en los primeros días después de la cirugía y hay positividad, ese resultado se debe confirmar con una punción lumbar posterior para que se considere de importancia diagnóstica. Por el contrario, si no se detectan células tumorales en el LCR no se necesita ninguna confirmación. Cuando se considera que es arriesgado obtener líquido con una punción espinal lumbar, es posible obtener líquido ventricular; sin embargo, este método a veces no es tan sensible como la evaluación del líquido lumbar.[
Debido a que los tumores embrionarios casi nunca son metastásicos en los huesos, la médula ósea o en otras partes del cuerpo en el momento del diagnóstico, no se indican estudios como aspiraciones de la médula ósea, radiografías del tórax o gammagrafías óseas, a menos que haya síntomas o signos que indiquen compromiso orgánico.
Factores pronósticos
Hay varios parámetros clínicos y biológicos que se relacionan con la probabilidad de controlar la enfermedad de los tumores embrionarios después del tratamiento.[
-
Alcance de la enfermedad en el sistema nervioso central en el momento del diagnóstico . -
Edad en el momento del diagnóstico . -
Cantidad de enfermedad residual después de la cirugía definitiva . -
Características histopatológicas del tumor . -
Características biológicas y moleculares de las células tumorales .
Cada vez está más claro, en especial en el caso de los meduloblastomas, que el desenlace también se relaciona con las características moleculares del tumor; sin embargo, esto no se ha demostrado de forma definitiva en el caso de otros tumores embrionarios.[
En estudios anteriores, se observó que la presencia de compromiso del tronco encefálico en niños con meduloblastoma era un factor pronóstico; en estudios posteriores sobre tratamiento de pacientes con radiación y quimioterapia, no se encontró que tuviera valor predictivo.[
Para los pacientes con tumores embrionarios, es fundamental obtener un diagnóstico exacto. Por ejemplo, en el ensayo ACNS0332 (NCT00392327) se inscribieron 80 pacientes con meduloblastoma de riesgo alto, TNEP-SNC supratentorial y pineoblastoma; 60 pacientes contaban con suficiente tejido para la evaluación. De estos tumores, 31 se localizaron fuera de la región pineal, 22 (71 %) de ellos eran tumores que no se pretendían incluir en el ensayo, incluso 18 gliomas de grado alto, 2 tumores teratoides rabdoides atípicos y 2 ependimomas. Los desenlaces entre los tipos de tumores fueron muy diferentes. Los pacientes con tumores embrionarios supratentoriales o pineoblastomas exhibieron una tasa de supervivencia sin complicaciones (SSC) a 5 años del 62,8 % (intervalo de confianza [IC] 95 %, 43,4–82,2 %) y una tasa de SG del 78,5 % (IC 95 %, 62,2–94,8 %), mientras que los pacientes con una clasificación molecular de gliomas de grado alto exhibieron una tasa de SSC del 5,6 % (IC 95 %, 0–13 %) y una tasa de SG del 12% (IC 95 %, 0–24,7 %). Las tasas de supervivencia de los pacientes con gliomas de grado alto son similares a los de pacientes que participaron en estudios históricos en los que se evitó el uso de irradiación craneoespinal y quimioterapia intensiva. Por tanto, para los pacientes con TNEP-SNC o pineoblastoma, el pronóstico es mucho mejor que lo que se presumía una vez se eliminaron los casos de gliomas de grado alto confirmados mediante análisis molecular.[
El pronóstico es precario para los pacientes con meduloepitelioma y ETMR, con tasas de supervivencia a 5 años que oscilan entre el 0 % y el 30 %.[
Alcance de la enfermedad en el sistema nervioso central en el momento del diagnóstico
Los pacientes con enfermedad diseminada por el sistema nervioso central (SNC) en el momento del diagnóstico tienen el riesgo más alto de recaída de la enfermedad.[
Es posible que los tumores embrionarios distintos del meduloblastoma y los pineoblastomas estén diseminados en el momento del diagnóstico, aunque la incidencia de la diseminación es un poco más baja que para los meduloblastomas. Se documentó la diseminación en el momento del diagnóstico en alrededor del 10 % al 20 %.[
Edad en el momento del diagnóstico
Una edad menor de 3 años en el momento del diagnóstico (excepto en casos de meduloblastoma desmoplásico o meduloblastoma con nodularidad extensa [MBNE]) augura un desenlace desfavorable para aquellos con meduloblastoma y, posiblemente, otros tumores embrionarios.[
Cantidad de enfermedad residual después de la cirugía definitiva
La extensión de la resección después de la cirugía ha dejado de usarse para la predicción del desenlace y se ha reemplazado por la cantidad de enfermedad residual después de la cirugía medida mediante una IRM posoperatoria.[
En estudios anteriores, se observó que la extensión de la resección de los meduloblastomas se relaciona con la supervivencia.[
En un estudio retrospectivo colaborativo internacional participaron 787 pacientes de todas las edades con meduloblastoma tratado de varias maneras; en el análisis se incluyó la clasificación por subgrupos moleculares y factores clínicos. En el análisis multivariante se encontró que la resección subtotal (>1,5 cm2 de enfermedad residual), pero no la resección casi total (<1,5 cm2 de enfermedad residual), se relacionó con una supervivencia sin progresión inferior, en comparación con la resección macroscópica total. En el estudio se indica que no se justifican los intentos por extirpar completamente el tumor, en especial cuando la probabilidad de morbilidad neurológica es alta, porque parece que la resección macroscópica total tiene muy pocos beneficios o no los tiene cuando se compara con la resección casi total. Este resultado otorga credibilidad al abordaje vigente, según el cual los pacientes con enfermedad de más de 1,5 cm2 se consideran pacientes de riesgo alto.[
En los pacientes con otras formas de tumores embrionarios, no se ha mostrado de forma definitiva que la extensión de la resección afecte la supervivencia.[
Características histopatológicas del tumor
En análisis retrospectivos, se observó que las características histopatológicas de los meduloblastomas, como variante de células grandes, anaplasia y desmoplasia, se correlacionan con el desenlace.[
En el caso de otros tumores embrionarios, las variaciones histológicas no se relacionan con desenlaces diferentes.
Características biológicas y moleculares de las células tumorales
Medida de la enfermedad residual mínima
En un estudio, las variaciones en el número de copias en el LCR, similares a las encontradas en los tumores primarios, pronosticaron la recaída cuando se presentaron después de la radioterapia, o durante o después de la quimioterapia. Si este hallazgo se reproduce en ensayos clínicos prospectivos y el método de medición está disponible, será una medida importante de la enfermedad residual mínima y con probabilidad formará parte de la evaluación de referencia, así como de las pruebas de vigilancia.[
Análisis genómico
El análisis genómico (como los perfiles de expresión génica de RNA y metilación de DNA, así como la secuenciación de DNA para identificar variantes) de secciones incluidas en parafina de muestras frescas congeladas o fijadas en formol, ha permitido identificar subtipos moleculares de meduloblastoma.[
Para los tumores embrionarios distintos del meduloblastoma, también se han identificado subtipos moleculares con diferentes desenlaces mediante el análisis genómico integrado. Para obtener información más detallada, consultar la sección
Seguimiento después del tratamiento
Es más probable que se presente la recaída de niños con tumores embrionarios en los primeros 18 meses posteriores al diagnóstico.[
| Período de vigilancia | Frecuencia de las consultas durante el período de vigilancia | Pruebas |
|---|---|---|
| IRM = imágenes por resonancia magnética. | ||
| a Para el pineoblastoma, continuar con evaluaciones de la médula espinal cada 6 meses durante 5 años desde el momento del diagnóstico. Aunque estas indicaciones se basan en una muestra pequeña, hay evidencia científica que indica que se debe continuar con las pruebas de vigilancia de la médula espinal y la columna vertebral hasta 5 años después del diagnóstico.[ |
||
| Primeros 3 años después del diagnóstico | Cada 3 meses | Examen físico |
| Imágenes del encéfalo cada 3 meses durante los 3 primeros años; luego, cada 6 meses durante los 2 años siguientes y después por elección del médico tratante o según el protocolo; IRM de la médula espinal y la columna vertebral cada 3 meses durante los primeros 2 años; luego, cada 6 meses durante 1 año, y luego por elección del médico tratante o según el protocoloa | ||
| Evaluación endocrinológica 1 vez por año | ||
| Pruebas neuropsicológicas cada 1–2 años | ||
| 3–5 años después del diagnóstico | Cada 6 meses | Examen físico |
| Imágenes del encéfalo, la médula espinal y la columna vertebral 1 vez por año | ||
| Evaluación endocrinológica 1 vez por año | ||
| Pruebas neuropsicológicas cada 1–2 años | ||
| Más de 5 años después del diagnóstico | Una vez por año | Examen físico |
| Imágenes del encéfalo 1 vez por año | ||
| Evaluación endocrinológica 1 vez por año | ||
| Pruebas neuropsicológicas cada 1–2 años (opcionales) | ||
En la actualidad se investiga la elaboración de estrategias de vigilancia distintas a pruebas por imágenes para pacientes con meduloblastoma. En un estudio de 134 niños con meduloblastoma recién diagnosticado se detectaron variaciones en el número de copias al inicio en 123 pacientes (92 %) mediante la evaluación del tumor primario, y en 65 pacientes (49 %) mediante análisis del LCR. Las variaciones en el número de copias se detectaron con más frecuencia en el LCR de los pacientes con enfermedad diseminada y en aquellos con progresión posterior. Se necesitan estudios prospectivos para evaluar la posibilidad de que el análisis del número de copias en el LCR sea un elemento de las pruebas de vigilancia, como medida de la enfermedad residual mínima y de la recaída temprana del meduloblastoma.[
Los niños y adolescentes sobrevivientes de cáncer necesitan un seguimiento minucioso, ya que es posible que los efectos secundarios del tratamiento del cáncer persistan o se presenten meses o años después de este. Para obtener información específica sobre la incidencia, el tipo y la vigilancia de los efectos tardíos en los niños y adolescentes sobrevivientes de cáncer, consultar
Referencias:
- Pomeroy SL, Tamayo P, Gaasenbeek M, et al.: Prediction of central nervous system embryonal tumour outcome based on gene expression. Nature 415 (6870): 436-42, 2002.
- Louis DN, Perry A, Reifenberger G, et al.: The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 131 (6): 803-20, 2016.
- Pfister S, Remke M, Benner A, et al.: Outcome prediction in pediatric medulloblastoma based on DNA copy-number aberrations of chromosomes 6q and 17q and the MYC and MYCN loci. J Clin Oncol 27 (10): 1627-36, 2009.
- Taylor MD, Northcott PA, Korshunov A, et al.: Molecular subgroups of medulloblastoma: the current consensus. Acta Neuropathol 123 (4): 465-72, 2012.
- Kool M, Koster J, Bunt J, et al.: Integrated genomics identifies five medulloblastoma subtypes with distinct genetic profiles, pathway signatures and clinicopathological features. PLoS One 3 (8): e3088, 2008.
- Ellison DW, Onilude OE, Lindsey JC, et al.: beta-Catenin status predicts a favorable outcome in childhood medulloblastoma: the United Kingdom Children's Cancer Study Group Brain Tumour Committee. J Clin Oncol 23 (31): 7951-7, 2005.
- WHO Classification of Tumours Editorial Board, ed.: WHO Classification of Tumours: Central Nervous System Tumours. Vol. 6. 5th ed. IARC Press; 2021.
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021.
- Childhood cancer by the ICCC. In: Howlader N, Noone AM, Krapcho M, et al., eds.: SEER Cancer Statistics Review, 1975-2009 (Vintage 2009 Populations). National Cancer Institute, 2012, Section 29.
Also available online . Last accessed August 11, 2022. - Smoll NR, Drummond KJ: The incidence of medulloblastomas and primitive neurectodermal tumours in adults and children. J Clin Neurosci 19 (11): 1541-4, 2012.
- Chintagumpala MM, Paulino A, Panigrahy A, et al.: Embryonal and pineal region tumors. In: Pizzo PA, Poplack DG, eds.: Principles and Practice of Pediatric Oncology. 7th ed. Lippincott Williams and Wilkins, 2015, pp 671-99.
- Packer RJ, Gajjar A, Vezina G, et al.: Phase III study of craniospinal radiation therapy followed by adjuvant chemotherapy for newly diagnosed average-risk medulloblastoma. J Clin Oncol 24 (25): 4202-8, 2006.
- Bennett J, Ashmawy R, Ramaswamy V, et al.: The clinical significance of equivocal findings on spinal MRI in children with medulloblastoma. Pediatr Blood Cancer 64 (8): , 2017.
- Michalski JM, Janss AJ, Vezina LG, et al.: Children's Oncology Group Phase III Trial of Reduced-Dose and Reduced-Volume Radiotherapy With Chemotherapy for Newly Diagnosed Average-Risk Medulloblastoma. J Clin Oncol 39 (24): 2685-2697, 2021.
- Warren KE, Vezina G, Poussaint TY, et al.: Response assessment in medulloblastoma and leptomeningeal seeding tumors: recommendations from the Response Assessment in Pediatric Neuro-Oncology committee. Neuro Oncol 20 (1): 13-23, 2018.
- Fouladi M, Gajjar A, Boyett JM, et al.: Comparison of CSF cytology and spinal magnetic resonance imaging in the detection of leptomeningeal disease in pediatric medulloblastoma or primitive neuroectodermal tumor. J Clin Oncol 17 (10): 3234-7, 1999.
- Zeltzer PM, Boyett JM, Finlay JL, et al.: Metastasis stage, adjuvant treatment, and residual tumor are prognostic factors for medulloblastoma in children: conclusions from the Children's Cancer Group 921 randomized phase III study. J Clin Oncol 17 (3): 832-45, 1999.
- Yao MS, Mehta MP, Boyett JM, et al.: The effect of M-stage on patterns of failure in posterior fossa primitive neuroectodermal tumors treated on CCG-921: a phase III study in a high-risk patient population. Int J Radiat Oncol Biol Phys 38 (3): 469-76, 1997.
- Thompson MC, Fuller C, Hogg TL, et al.: Genomics identifies medulloblastoma subgroups that are enriched for specific genetic alterations. J Clin Oncol 24 (12): 1924-31, 2006.
- Northcott PA, Korshunov A, Witt H, et al.: Medulloblastoma comprises four distinct molecular variants. J Clin Oncol 29 (11): 1408-14, 2011.
- Rutkowski S, von Hoff K, Emser A, et al.: Survival and prognostic factors of early childhood medulloblastoma: an international meta-analysis. J Clin Oncol 28 (33): 4961-8, 2010.
- Kolodziejczak AS, Guerrini-Rousseau L, Planchon JM, et al.: Clinical outcome of pediatric medulloblastoma patients with Li-Fraumeni syndrome. Neuro Oncol 25 (12): 2273-2286, 2023.
- Cohen BH, Zeltzer PM, Boyett JM, et al.: Prognostic factors and treatment results for supratentorial primitive neuroectodermal tumors in children using radiation and chemotherapy: a Childrens Cancer Group randomized trial. J Clin Oncol 13 (7): 1687-96, 1995.
- Reddy AT, Janss AJ, Phillips PC, et al.: Outcome for children with supratentorial primitive neuroectodermal tumors treated with surgery, radiation, and chemotherapy. Cancer 88 (9): 2189-93, 2000.
- Timmermann B, Kortmann RD, Kühl J, et al.: Role of radiotherapy in the treatment of supratentorial primitive neuroectodermal tumors in childhood: results of the prospective German brain tumor trials HIT 88/89 and 91. J Clin Oncol 20 (3): 842-9, 2002.
- Jakacki RI, Zeltzer PM, Boyett JM, et al.: Survival and prognostic factors following radiation and/or chemotherapy for primitive neuroectodermal tumors of the pineal region in infants and children: a report of the Childrens Cancer Group. J Clin Oncol 13 (6): 1377-83, 1995.
- Hwang EI, Kool M, Burger PC, et al.: Extensive Molecular and Clinical Heterogeneity in Patients With Histologically Diagnosed CNS-PNET Treated as a Single Entity: A Report From the Children's Oncology Group Randomized ACNS0332 Trial. J Clin Oncol : JCO2017764720, 2018.
- Louis DN, Ohgaki H, Wiestler OD, et al.: The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 114 (2): 97-109, 2007.
- Sharma MC, Mahapatra AK, Gaikwad S, et al.: Pigmented medulloepithelioma: report of a case and review of the literature. Childs Nerv Syst 14 (1-2): 74-8, 1998 Jan-Feb.
- Müller K, Zwiener I, Welker H, et al.: Curative treatment for central nervous system medulloepithelioma despite residual disease after resection. Report of two cases treated according to the GPHO Protocol HIT 2000 and review of the literature. Strahlenther Onkol 187 (11): 757-62, 2011.
- Horwitz M, Dufour C, Leblond P, et al.: Embryonal tumors with multilayered rosettes in children: the SFCE experience. Childs Nerv Syst 32 (2): 299-305, 2016.
- Leary SE, Zhou T, Holmes E, et al.: Histology predicts a favorable outcome in young children with desmoplastic medulloblastoma: a report from the children's oncology group. Cancer 117 (14): 3262-7, 2011.
- Giangaspero F, Perilongo G, Fondelli MP, et al.: Medulloblastoma with extensive nodularity: a variant with favorable prognosis. J Neurosurg 91 (6): 971-7, 1999.
- von Bueren AO, von Hoff K, Pietsch T, et al.: Treatment of young children with localized medulloblastoma by chemotherapy alone: results of the prospective, multicenter trial HIT 2000 confirming the prognostic impact of histology. Neuro Oncol 13 (6): 669-79, 2011.
- Rutkowski S, Gerber NU, von Hoff K, et al.: Treatment of early childhood medulloblastoma by postoperative chemotherapy and deferred radiotherapy. Neuro Oncol 11 (2): 201-10, 2009.
- Rutkowski S, Bode U, Deinlein F, et al.: Treatment of early childhood medulloblastoma by postoperative chemotherapy alone. N Engl J Med 352 (10): 978-86, 2005.
- Mynarek M, Pizer B, Dufour C, et al.: Evaluation of age-dependent treatment strategies for children and young adults with pineoblastoma: analysis of pooled European Society for Paediatric Oncology (SIOP-E) and US Head Start data. Neuro Oncol 19 (4): 576-585, 2017.
- Albright AL, Wisoff JH, Zeltzer PM, et al.: Effects of medulloblastoma resections on outcome in children: a report from the Children's Cancer Group. Neurosurgery 38 (2): 265-71, 1996.
- Taylor RE, Bailey CC, Robinson K, et al.: Results of a randomized study of preradiation chemotherapy versus radiotherapy alone for nonmetastatic medulloblastoma: The International Society of Paediatric Oncology/United Kingdom Children's Cancer Study Group PNET-3 Study. J Clin Oncol 21 (8): 1581-91, 2003.
- Lannering B, Rutkowski S, Doz F, et al.: Hyperfractionated versus conventional radiotherapy followed by chemotherapy in standard-risk medulloblastoma: results from the randomized multicenter HIT-SIOP PNET 4 trial. J Clin Oncol 30 (26): 3187-93, 2012.
- Thompson EM, Hielscher T, Bouffet E, et al.: Prognostic value of medulloblastoma extent of resection after accounting for molecular subgroup: a retrospective integrated clinical and molecular analysis. Lancet Oncol 17 (4): 484-95, 2016.
- Jakacki RI, Burger PC, Kocak M, et al.: Outcome and prognostic factors for children with supratentorial primitive neuroectodermal tumors treated with carboplatin during radiotherapy: a report from the Children's Oncology Group. Pediatr Blood Cancer 62 (5): 776-83, 2015.
- McManamy CS, Lamont JM, Taylor RE, et al.: Morphophenotypic variation predicts clinical behavior in childhood non-desmoplastic medulloblastomas. J Neuropathol Exp Neurol 62 (6): 627-32, 2003.
- Massimino M, Antonelli M, Gandola L, et al.: Histological variants of medulloblastoma are the most powerful clinical prognostic indicators. Pediatr Blood Cancer 60 (2): 210-6, 2013.
- Eberhart CG, Kratz J, Wang Y, et al.: Histopathological and molecular prognostic markers in medulloblastoma: c-myc, N-myc, TrkC, and anaplasia. J Neuropathol Exp Neurol 63 (5): 441-9, 2004.
- Garrè ML, Cama A, Bagnasco F, et al.: Medulloblastoma variants: age-dependent occurrence and relation to Gorlin syndrome--a new clinical perspective. Clin Cancer Res 15 (7): 2463-71, 2009.
- Liu APY, Smith KS, Kumar R, et al.: Serial assessment of measurable residual disease in medulloblastoma liquid biopsies. Cancer Cell 39 (11): 1519-1530.e4, 2021.
- Tabori U, Baskin B, Shago M, et al.: Universal poor survival in children with medulloblastoma harboring somatic TP53 mutations. J Clin Oncol 28 (8): 1345-50, 2010.
- Onvani S, Etame AB, Smith CA, et al.: Genetics of medulloblastoma: clues for novel therapies. Expert Rev Neurother 10 (5): 811-23, 2010.
- Dubuc AM, Northcott PA, Mack S, et al.: The genetics of pediatric brain tumors. Curr Neurol Neurosci Rep 10 (3): 215-23, 2010.
- Giangaspero F, Wellek S, Masuoka J, et al.: Stratification of medulloblastoma on the basis of histopathological grading. Acta Neuropathol 112 (1): 5-12, 2006.
- Jones DT, Jäger N, Kool M, et al.: Dissecting the genomic complexity underlying medulloblastoma. Nature 488 (7409): 100-5, 2012.
- Peyrl A, Chocholous M, Kieran MW, et al.: Antiangiogenic metronomic therapy for children with recurrent embryonal brain tumors. Pediatr Blood Cancer 59 (3): 511-7, 2012.
- Kool M, Korshunov A, Remke M, et al.: Molecular subgroups of medulloblastoma: an international meta-analysis of transcriptome, genetic aberrations, and clinical data of WNT, SHH, Group 3, and Group 4 medulloblastomas. Acta Neuropathol 123 (4): 473-84, 2012.
- Schwalbe EC, Williamson D, Lindsey JC, et al.: DNA methylation profiling of medulloblastoma allows robust subclassification and improved outcome prediction using formalin-fixed biopsies. Acta Neuropathol 125 (3): 359-71, 2013.
- Shih DJ, Northcott PA, Remke M, et al.: Cytogenetic prognostication within medulloblastoma subgroups. J Clin Oncol 32 (9): 886-96, 2014.
- Goschzik T, Schwalbe EC, Hicks D, et al.: Prognostic effect of whole chromosomal aberration signatures in standard-risk, non-WNT/non-SHH medulloblastoma: a retrospective, molecular analysis of the HIT-SIOP PNET 4 trial. Lancet Oncol 19 (12): 1602-1616, 2018.
- Polkinghorn WR, Tarbell NJ: Medulloblastoma: tumorigenesis, current clinical paradigm, and efforts to improve risk stratification. Nat Clin Pract Oncol 4 (5): 295-304, 2007.
- Ramaswamy V, Remke M, Bouffet E, et al.: Recurrence patterns across medulloblastoma subgroups: an integrated clinical and molecular analysis. Lancet Oncol 14 (12): 1200-7, 2013.
- Packer RJ, Zhou T, Holmes E, et al.: Survival and secondary tumors in children with medulloblastoma receiving radiotherapy and adjuvant chemotherapy: results of Children's Oncology Group trial A9961. Neuro Oncol 15 (1): 97-103, 2013.
- Shaw DW, Geyer JR, Berger MS, et al.: Asymptomatic recurrence detection with surveillance scanning in children with medulloblastoma. J Clin Oncol 15 (5): 1811-3, 1997.
- Torres CF, Rebsamen S, Silber JH, et al.: Surveillance scanning of children with medulloblastoma. N Engl J Med 330 (13): 892-5, 1994.
- Kramer ED, Vezina LG, Packer RJ, et al.: Staging and surveillance of children with central nervous system neoplasms: recommendations of the Neurology and Tumor Imaging Committees of the Children's Cancer Group. Pediatr Neurosurg 20 (4): 254-62; discussion 262-3, 1994.
- Sabel M, Fleischhack G, Tippelt S, et al.: Relapse patterns and outcome after relapse in standard risk medulloblastoma: a report from the HIT-SIOP-PNET4 study. J Neurooncol 129 (3): 515-524, 2016.
- Perreault S, Lober RM, Carret AS, et al.: Surveillance imaging in children with malignant CNS tumors: low yield of spine MRI. J Neurooncol 116 (3): 617-23, 2014.
Meduloblastoma infantil
Síndromes hereditarios de predisposición al cáncer relacionados con el meduloblastoma
Cada vez más se encuentran variantes de la línea germinal en subgrupos de niños con tumores de encéfalo, como el meduloblastoma, y la presencia de estas variantes los predispone a padecer otros tipos de cáncer además del meduloblastoma.[
El meduloblastoma se presenta en el entorno de síndromes hereditarios de predisposición al cáncer en cerca del 5 % de los pacientes.[
Entre los síndromes que se sabe que están relacionados con el meduloblastoma están los siguientes:
- Síndrome de Turcot (relacionado con variantes de la línea germinal en APC),[
3 ] que es exclusivo del subtipo con activación de WNT.[2 ] - Síndrome de Rubinstein-Taybi (relacionado con variantes de la línea germinal en CREBBP).[
4 ,5 ,6 ] - Síndrome de Gorlin (también conocido como síndrome del nevo de células basales o síndrome del carcinoma nevoide de células basales, relacionado con variantes de la línea germinal en PTCH1 y SUFU).[
7 ,8 ,9 ,10 ,11 ] El riesgo de presentar meduloblastoma en pacientes con síndrome de Gorlin parece que es más alto en los que tienen variantes de SUFU que en los que tienen variantes de la línea germinal en PTCH1. En un estudio, 2 de 115 personas (1,7 %) con síndrome de Gorlin y una variante de PTCH1 presentaron un meduloblastoma comprobado por análisis patológico, en comparación con 3 de 9 personas (33 %) de 3 familias con síndrome de Gorlin relacionado con alteraciones en SUFU. Todos los pacientes con alteraciones en SUFU presentaron meduloblastoma antes de los 3 años de edad.[11 ] - Síndrome de Li-Fraumeni está relacionado con variantes de la línea germinal en TP53.[
12 ,13 ] Las variantes patogénicas de la línea germinal en TP53 se restringen al subtipo con activación de erizo sónico (sonic hedgehog, SHH).[2 ,14 ] - Anemia de Fanconi (relacionada con variantes de BRCA2).[
15 ,16 ,17 ,18 ]
Las variantes patogénicas germinales heterocigotas deletéreas en GPR161 se identificaron en cerca del 3 % de los casos de meduloblastoma SHH.[
En el 14 % de los pacientes pediátricos con meduloblastoma SHH se identificaron nuevas variantes patogénicas germinales de pérdida de función en la subunidad mayor del complejo Elongator, ELP1, conservado evolutivamente. El ELP1 fue el gen de predisposición al meduloblastoma más común, y aumentó la prevalencia de la predisposición genética hasta el 40 % entre los pacientes pediátricos con meduloblastoma SHH.[
A veces, el meduloblastoma es la manifestación inicial de la presencia de variantes patogénicas de la línea germinal en estos genes de predisposición. Las pruebas de la línea germinal se deben considerar en las siguientes circunstancias:
- Se hace una prueba de variantes de APC en pacientes de meduloblastoma con activación de WNT en ausencia de una variante somática de CTNNB1.
- Se hacen pruebas de variantes de SUFU, PTCH1, TP53, PALB2 y BRCA2 en pacientes de meduloblastoma con activación de SHH. Los pacientes con tumores desmoplásicos con nodularidad extensa se deberán evaluar con cuidado para identificar estigmas del síndrome de Gorlin.[
7 ] En un informe se observó que el meduloblastoma con nodularidad extensa (MBNE) se relacionó con el síndrome de Gorlin en 5 de 12 casos.[7 ] El síndrome de Gorlin es un trastorno autosómico dominante que produce en las personas afectadas predisposición a presentar carcinomas de células basales más adelante en la vida, en especial en la piel del campo de irradiación. Es posible diagnosticar el síndrome a una edad temprana mediante la identificación de características dermatológicas y esqueléticas, como queratoquistes en la mandíbula, costillas bífidas o fusionadas, macrocefalia y calcificaciones en la hoz del cerebelo.[7 ] - Pruebas de variantes de PALB2 y BRCA2, en pacientes con antecedentes familiares de cánceres relacionados con BRCA o deficiencia de reparación por recombinación homóloga.
Cuadro clínico inicial
Por definición, los meduloblastomas aparecen en la fosa posterior.[
- Inicio relativamente súbito de cefaleas, en especial, al levantarse por la mañana.
- Náuseas o vómitos.
- Letargo.
- Ataxia, incluso inestabilidad del tronco.
- Cierto grado de nistagmo.
- Papiledema.
De los pacientes con meduloblastoma, el 20 % no presentará hidrocefalia en el momento del diagnóstico y, en este caso, es más probable que exhiban deficiencias cerebelosas. Por ejemplo, es posible que los meduloblastomas de las partes más laterales del cerebelo no causen hidrocefalia y, debido a su ubicación, es más probable que produzcan disfunción cerebelosa lateralizante (ataxia apendicular), que se manifiesta por dismetría unilateral, inestabilidad y debilidad de los pares craneales VI y VII en el mismo lado del tumor. Luego, cuando el tumor crece hacia la línea media y bloquea el LCR, se hacen evidentes los síntomas más clásicos relacionados con la hidrocefalia.
Las manifestaciones en los pares craneales son menos frecuentes, salvo por parálisis unilateral o bilateral del par craneal VI que, por lo general, se relaciona con la hidrocefalia.[
En los lactantes, el cuadro clínico inicial del meduloblastoma es más variable y a veces incluye los siguientes signos y síntomas:
- Letargo inespecífico.
- Retrasos psicomotores.
- Pérdida de los hitos del desarrollo.
- Dificultades de alimentación.
- Aumento de la circunferencia de la cabeza.
En el examen clínico, a veces se observa un abultamiento de la fontanela anterior por aumento de la presión intracraneal y movimientos oculares anormales, incluso desviación de la mirada hacia abajo (el llamado signo del sol poniente) debido a la pérdida de la mirada hacia arriba secundaria a la compresión del techo del mesencéfalo.
Clasificación celular y molecular
En la clasificación de la Organización Mundial de la Salud (OMS) de 2021 el meduloblastoma se clasifica según sus características histológicas y moleculares. El tumor se clasifica como meduloblastoma definido por características histológicas si no se han realizado pruebas de biomarcadores.[
- Meduloblastoma.
- Meduloblastoma definido por características moleculares.
- Meduloblastoma con activación de WNT.
- Meduloblastoma con activación de SHH y TP53 natural.
- Meduloblastoma con activación de SHH y alteración de TP53.
- Meduloblastoma sin WNT ni SHH.
- Meduloblastoma definido por características histológicas.
- Meduloblastoma nodular desmoplásico.
- Meduloblastoma con nodularidad extensa.
- Meduloblastoma de células grandes.
- Meduloblastoma anaplásico.
- Meduloblastoma definido por características moleculares.
Se ha prestado especial atención a los meduloblastomas que exhiben características anaplásicas, como aumento del tamaño nuclear, marcado pleomorfismo citológico, mitosis numerosas y cuerpos apoptóticos.[
La incidencia de meduloblastoma con la variante histológica desmoplásica o nodular, que por lo común surge en un hemisferio cerebeloso, es más alta en los lactantes, menos común en los niños y vuelve a aumentar en los adolescentes y adultos. La variante histológica desmoplásica o nodular es diferente del MBNE; la variante nodular tiene una arquitectura lobulillar expandida. El subtipo MBNE se presenta de manera casi exclusiva en lactantes y tiene un pronóstico excelente.[
Subtipos moleculares del meduloblastoma
Se han identificado múltiples subtipos de meduloblastoma mediante análisis molecular integrador.[
Es probable que diferentes áreas del mismo tumor presenten variantes genéticas dispares, lo que aumenta la complejidad al elaborar un tratamiento eficaz dirigido al nivel molecular.[
Es posible establecer nuevas divisiones dentro de estos subgrupos, lo que proporcionará aún más información pronóstica útil.[
Meduloblastoma con activación de WNT
Los tumores WNT son meduloblastomas con alteraciones en la vía de señalización WNT que representan alrededor del 10 % de todos los meduloblastomas.[
Se observan variantes de CTNNB1 en el 85 % al 90 % de los casos de meduloblastoma WNT, y se detectan variantes de APC en muchos de los casos que no tienen variantes de CTNNB1. Los pacientes de meduloblastoma WNT con tumores que tienen variantes de APC a menudo presentan el síndrome de Turcot (es decir, variantes patogénicas de la línea germinal en APC).[
El subconjunto WNT se observa de manera primaria en niños grandes, adolescentes y adultos, y no muestra un predominio por el sexo masculino. Se cree que el subconjunto tiene origen en el tronco encefálico, en la región del labio rómbico embrionario.[
Meduloblastoma con activación de SHH y alteración deTP53, y meduloblastoma con activación de SHH yTP53natural
Los tumores SHH son meduloblastomas con alteraciones en la vía de señalización SHH y representan alrededor del 25 % de todos los casos de meduloblastomas.[
Las variantes patogénicas germinales heterocigotas deletéreas en el gen GPR161 se identificaron en cerca del 3 % de los casos de meduloblastoma SHH.[
Las variantes del tercer nucleótido (r.3A>G) de los RNA nucleares pequeños (snRNA) U1 de los empalmosomas son muy específicas del meduloblastoma SHH.[
Los meduloblastomas SHH exhiben una distribución etaria bimodal y se observan más a menudo en niños menores de 3 años, al final de la adolescencia y en la edad adulta. Se cree que los tumores surgen en la capa granular externa del cerebelo. La heterogeneidad en la edad de presentación esquematiza diferentes subgrupos identificados mediante caracterización molecular adicional, como se describe a continuación:
- El subgrupo de meduloblastoma más común en niños de 3 a 16 años, que se llama SHH-α (subgrupo provisional en la clasificación de meduloblastoma de 2021), tiene alteración de TP53 y exhibe enriquecimiento de amplificaciones de MYCN y GLI2.[
50 ,52 ] Las amplificaciones de PTCH1 y SUFU en ocasiones se presentan en este subtipo y son mutuamente excluyentes de las variantes de TP53 (a menudo de la línea germinal), mientras que la variante de SMO es infrecuente.[14 ,52 ,63 ] Las variantes de los snRNA U1 se presentan en cerca del 25 % de los casos de meduloblastoma SSH-α e indican un pronóstico muy precario.[62 ] - Se han descrito dos subtipos de meduloblastomas SHH que se presentan de manera primaria en niños menores de 3 años.[
50 ] Uno de estos subtipos, que se llama SHH-β, es metastásico con mayor frecuencia, y a menudo tiene amplificaciones focales.[64 ] El segundo de estos subtipos, que se llama SSH-γ, exhibe enriquecimiento del tipo histológico del meduloblastoma con nodularidad extensa (MBNE). Las variantes de la vía SHH en niños menores de 3 años con meduloblastoma incluyen las variantes de PTCH1 y SUFU.[52 ] Las variantes de SUFU casi no se observan en niños más grandes ni en adultos; en ellos, son comunes las alteraciones de la línea germinal.[63 ]En informes en los que se usaron matrices de metilación del DNA también se identificaron 2 subtipos de meduloblastoma SHH en niños jóvenes.[
28 ,64 ] Uno de estos subtipos abarcó todos los casos con variantes de SMO y se relacionó con un pronóstico favorable. El otro subtipo exhibió la mayoría de las variantes de SUFU y se relacionó con una tasa de supervivencia sin progresión (SSP) mucho más baja. Ambos subtipos exhibieron variantes de PTCH1. - Un cuarto subtipo de SHH, que se llama SHH-δ, incluye la mayoría de los casos de meduloblastomas SHH en adultos.[
50 ] Prácticamente todos los casos de meduloblastoma SHH-δ tienen la variante r.A>3 en los snRNA U1 [62 ] y cerca del 90 % de los casos exhiben una variante del promotor de TERT.[50 ] También se observan variantes de PTCH1 y SMO en adultos con meduloblastoma SHH.
El desenlace de los pacientes con meduloblastoma SHH no metastásico es relativamente favorable para niños menores de 3 años y adultos.[
Los pacientes con hallazgos moleculares desfavorables tienen un pronóstico desfavorable, menos del 50 % de los pacientes sobreviven después del tratamiento convencional.[
En la clasificación de 2021 de la OMS, el meduloblastoma SHH con variante de TP53 se considera una entidad diferenciada (meduloblastoma con activación de SHH y alteración de TP53).[
Meduloblastoma sin activación de WNT ni SHH
En la clasificación de la OMS se combinan los casos de meduloblastomas de los grupos 3 y 4 en una sola entidad, en parte por la ausencia de efecto clínico inmediato de esta diferenciación. Los meduloblastomas del grupo 3 representan cerca de un 25 % de los casos de meduloblastoma, mientras que los meduloblastoma del grupo 4 representan cerca de un 40 % de los casos de meduloblastoma.[
Se observan varias alteraciones genómicas en los meduloblastomas del grupo 3 y 4; no obstante, ninguna alteración única se presenta en más de un 10 % a un 20 % de los casos. Las alteraciones genómicas son las siguientes:
- La amplificación de MYC fue la alteración diferenciada más común notificada para los meduloblastomas del grupo 3, que se presenta en alrededor del 15 % de los casos.[
44 ,51 ] - La alteración genómica diferenciada más común descrita para el meduloblastoma del grupo 4 (alrededor de un 15 % de los casos) fue la activación de PRDM6 por secuestro del activador de transcripción como consecuencia de duplicación en tándem del gen adyacente SNCAIP.[
51 ] - Otras alteraciones genómicas que se observaron en casos de los grupos 3 y 4 fueron amplificación de MYCN y variantes estructurales que llevan a la sobreexpresión de GFI1 o GFI1B mediante secuestro del activador de transcripción.
- El isocromosoma 17q (i17q) es la anormalidad citogenética más común y se observa en un porcentaje alto de los casos del grupo 4, así como en los casos del grupo 3, pero pocas veces se observa en los meduloblastomas WNT y SHH.[
44 ,51 ] La presencia de i17q no parece afectar el pronóstico de los pacientes de los grupos 3 y 4.[72 ]
Los pacientes del grupo 3 con amplificación de MYC o sobreexpresión de MYC tienen un pronóstico precario.[
Los meduloblastomas del grupo 4 se presentan durante toda la infancia y la niñez, así como en la edad adulta. El pronóstico de los pacientes con meduloblastoma del grupo 4 es similar al de los pacientes con meduloblastoma sin activación de WNT y es posible que se vea afectado por factores adicionales como la presencia de enfermedad metastásica, pérdida del cromosoma 11q y pérdida del cromosoma 17p.[
Para los pacientes de riesgo estándar del grupo 3 y 4 (es decir, sin amplificación de MYC ni enfermedad metastásica), la ganancia o pérdida de cromosomas enteros acarrea un pronóstico favorable. Estos hallazgos se obtuvieron de datos de 91 pacientes con meduloblastoma sin activación de WNT ni SHH que participaron en el ensayo clínico SIOP-PNET-4 (NCT01351870) y se confirmaron en un grupo independiente de 70 niños con meduloblastoma sin activación de WNT ni SHH tratados entre 1990 y 2014.[
- La ganancia o pérdida de uno o más cromosomas enteros se relacionó con una tasa de supervivencia sin complicaciones (SSC) a 5 años del 93 % en comparación con el 64 % para la ausencia de ganancia o pérdida de cromosomas enteros.
- Las ganancias o pérdidas de cromosomas enteros más comunes son la ganancia del cromosoma 7 y la pérdida de los cromosomas 8 y 11.
- El discriminador pronóstico con desempeño óptimo es la presentación simultánea de dos o más de las siguientes alteraciones: ganancia del cromosoma 7, pérdida del cromosoma 8 y pérdida del cromosoma 11. Alrededor del 40 % de los pacientes de riesgo estándar de los grupos 3 y 4 tuvieron 2 o más de estas alteraciones cromosómicas; la tasa de SSC a 5 años fue del 100 % en comparación con el 68 % para los pacientes con menos de 2 de estas alteraciones.
- En una cohorte independiente, se confirmó la importancia pronóstica de 2 o más ganancias o pérdidas versus 0 o 1 ganancias o pérdidas de los cromosomas 7, 8 y 11 (tasa de SSC a 5 años, el 95 % de los pacientes con 2 o más vs. el 59 % de los pacientes con 1 o menos).
Es probable que la clasificación del meduloblastoma en cuatro subtipos principales se modifique en el futuro.[
No se sabe si la clasificación para los adultos con meduloblastoma tiene la misma capacidad pronóstica que para los niños.[
Evaluación para la estadificación
Tradicionalmente, la estadificación se basó en una evaluación intraoperatoria del tamaño y la extensión del tumor, junto con neuroimágenes posoperatorias del encéfalo, la médula espinal y la columna vertebral, así como evaluación citológica del líquido cefalorraquídeo (LCR) (sistema Chang). La evaluación intraoperatoria de la extensión del tumor se reemplazó y ahora se usan imágenes del eje encefalomedular antes del diagnóstico e imágenes posoperatorias para determinar la cantidad de enfermedad residual en el sitio primario. Se utilizan las siguientes pruebas y procedimientos para la estadificación:
- Imágenes por resonancia magnética (IRM) del encéfalo, la médula espinal y la columna vertebral (a menudo preoperatorias).
- IRM posoperatorias del encéfalo para determinar la cantidad de enfermedad residual.
- Análisis del LCR lumbar.[
76 ,77 ,78 ]
La extensión del tumor se define como sigue:
- M0: sin diseminación.
- M1: solo prueba citológica positiva en el LCR.
- M2: diseminación nodular macroscópica en el espacio subaracnoideo cerebeloso o cerebral; en un ventrículo lateral o en el tercer ventrículo.
- M3: diseminación nodular macroscópica en el espacio subaracnoideo de la médula espinal.
- M4: metástasis extraneural.
El grado de enfermedad residual posoperatorio se designa como sigue:
- Resección macroscópica total o resección casi total: sin indicios de enfermedad residual mínima (≤1,5 cm2) después de la resección.
- Resección subtotal: enfermedad residual después del diagnóstico (>1,5 cm2 de enfermedad residual cuantificable).
- Biopsia: sin resección tumoral; solo se extrae una muestra de tejido del tumor.
Desde la década de 1990, se han realizado estudios prospectivos con este sistema de estadificación para dividir a los pacientes en subgrupos de meduloblastoma de riesgo promedio y de riesgo alto.[
Se ha incorporado la presencia de anaplasia histológica difusa (>50 % de la pieza de patología) como un complemento en los sistemas de estadificación. Si se encuentra anaplasia difusa, se aumenta el estadio para los pacientes que tienen enfermedad de riesgo promedio con el fin de reflejar una enfermedad de riesgo alto.
Estratificación del riesgo
La estratificación del riesgo se basa en la evaluación neurorradiográfica de la enfermedad diseminada, el examen citológico del LCR, la evaluación posoperatoria mediante neuroimágenes para determinar la cantidad de enfermedad residual y la edad del paciente. Para obtener más información, consultar la sección
- Riesgo promedio: niños mayores de 3 años con tumores total o casi totalmente resecados (<1,5 cm2 de enfermedad residual) y sin enfermedad metastásica.[
77 ] - Riesgo alto: niños mayores de 3 años con enfermedad metastásica o resección subtotal (>1,5 cm2 de enfermedad residual).[
77 ] La enfermedad metastásica incluye indicios neurorradiográficos de enfermedad diseminada, resultado positivo en el estudio citológico del LCR lumbar o ventricular obtenido más de 14 días después de la cirugía o enfermedad extraneural.[77 ] Los niños con tumores que exhiben anaplasia difusa, que de otro modo se hubieran clasificado como de riesgo promedio, se asignan al grupo de riesgo alto.[26 ,38 ]
Para los niños más pequeños (en algunos estudios, niños menores de 3 años y en otros estudios menores de 4 o 5 años), se usó una asignación similar a un grupo de riesgo promedio (sin diseminación y ≤1,5 cm2 de enfermedad residual) y un grupo de riesgo alto (enfermedad diseminada o >1,5 cm2 de enfermedad residual). Las característica histológicas de desmoplasia también se han utilizado para indicar subgrupos de riesgo más bajo, en especial, el subgrupo de MBNE.[
Es posible que la asignación a un grupo de riesgo en función de la extensión de la resección de la enfermedad en el momento del diagnóstico no pronostique el resultado del tratamiento. Los factores genético moleculares e histológicos quizás proporcionen más información, aunque se deben evaluar en el entorno de la edad del paciente, la extensión de la enfermedad en el momento del diagnóstico y el tratamiento.[
Aspectos generales de las opciones de tratamiento del meduloblastoma infantil
En el
| Grupo de tratamiento | Opciones de tratamiento estándar | |
|---|---|---|
| Meduloblastoma infantilrecién diagnosticado | Niños pequeños con meduloblastoma | |
| |
||
| Niños mayores de 3 años con meduloblastoma de riesgo promedio | |
|
| |
||
| |
||
| Niños mayores de 3 años con meduloblastoma de riesgo alto | |
|
| |
||
| |
||
| Meduloblastoma infantilrecidivante | No hay opciones de tratamiento estándar. Para obtener más información, consultar la sección |
|
Cirugía
La cirugía se considera una parte del tratamiento estándar para la confirmación histológica del tipo de tumor y una forma de mejorar el desenlace. La resección total o casi total se considera óptima, si se lleva a cabo de forma inocua.[
Después de la cirugía, a veces los niños presentan deficiencias neurológicas importantes causadas por una lesión encefálica preoperatoria relacionada con el tumor, hidrocefalia o lesión encefálica relacionada con la operación.[
- Retraso en el inicio del habla.
- Parálisis suprabulbar.
- Ataxia.
- Hipotonía.
- Labilidad emocional.
La causa del síndrome de mutismo cerebeloso (también conocido como síndrome de fosa posterior) no está clara, aunque se han postulado como posibles causas las lesiones del vermis cerebeloso y la interrupción de las vías corticocerebelosas.[
Radioterapia
La dosis de radioterapia dirigida al sitio del tumor primario, por lo general, oscila entre 54 y 55,8 Gy.[
Por lo general, la quimioterapia se administra durante la radioterapia y después de esta.
Se intenta evitar o posponer la radiación para los niños menores de 3 años por su intenso efecto en esta edad. Los niños de todas las edades son susceptibles a los efectos adversos de la radiación en el desarrollo encefálico. Con frecuencia, se han observado efectos debilitantes del desarrollo neurocognitivo, el crecimiento y el funcionamiento endocrino, en especial en los niños pequeños.[
Quimioterapia
La quimioterapia, que por lo habitual se administra durante la radioterapia y después de esta, es un componente estándar del tratamiento para los niños mayores con meduloblastoma y otros tumores embrionarios. Es posible usar quimioterapia para posponer y, algunas veces, evitar la necesidad de radioterapia en el 20 % al 40 % de los niños menores de 3 a 4 años con meduloblastoma que no se ha diseminado.[
Tratamiento del meduloblastoma infantil
Tratamiento de niños pequeños con meduloblastoma
Las tasas de supervivencia sin complicaciones (SSC) a 5 años para niños pequeños con meduloblastoma, descritos de manera arbitraria en el pasado como niños de 3 años o menos en el momento del diagnóstico, han oscilado entre el 30 % y el 70 %. No hay consenso sobre qué edad constituye una población de niños pequeños con meduloblastoma que se tratan mejor con quimioterapia postoperatoria inmediata y radioterapia diferida o sin radioterapia. La mayoría de los estudios coinciden en que, en los pacientes de 3 años o menos, debe considerarse seriamente la quimioterapia inicial. En pacientes de 3 a 4 años, y tal vez de hasta 5 años, algunos investigadores han recomendado retrasar la radioterapia o evitarla por completo. Estas decisiones se basan en múltiples factores, como el subtipo histológico, el subtipo molecular, la extensión de la enfermedad en el momento del diagnóstico, el estado neurológico y del neurodesarrollo preexistente y las preferencias de la familia. La mayoría de los supervivientes a largo plazo que han sido tratados con éxito solo con quimioterapia han tenido tumores no diseminados completamente resecados.[
El tratamiento de los niños pequeños con meduloblastoma recién diagnosticado continúa evolucionando. Los resultados son contradictorios, la comparación entre estudios es difícil por las diferencias en los regímenes farmacológicos, el uso de radioterapia craneoespinal y de refuerzo local al final de la quimioterapia, o cuando los niños alcanzan la edad de 3 años.
Las opciones de tratamiento estándar para niños pequeños con meduloblastoma recién diagnosticado son las siguientes:
-
Cirugía . -
Quimioterapia adyuvante .
Cirugía
Si es viable, la resección quirúrgica completa del tumor es el tratamiento óptimo. La resecabilidad quirúrgica se relaciona con el tipo histológico, porque los pacientes con meduloblastoma desmoplásico o meduloblastoma de nodularidad extensa (MBNE) exhiben una tasa más alta de resección completa que los pacientes con meduloblastoma clásico.[
Quimioterapia adyuvante
Los tratamientos para los niños pequeños con meduloblastoma han incluido el uso de abordajes quimioterapéuticos multifarmacológicos, con fármacos como ciclofosfamida, etopósido, cisplatino y vincristina, con dosis altas de metotrexato intravenoso simultáneo o metotrexato intraventricular, o sin ellas.[
Meduloblastoma desmoplásico, meduloblastoma con nodularidad extensa o tumores con señalización de SHH
En una serie de estudios se ha demostrado que la quimioterapia intensiva, que incluye dosis altas de metotrexato sistémico y metotrexato intraventricular o dosis altas de quimioterapia con rescate de células madre, sin radioterapia, es un tratamiento eficaz para la mayoría de los lactantes y niños muy pequeños con meduloblastoma.
Evidencia (quimioterapia):
- En el ensayo multicéntrico alemán Hirntumor (HIT) 2000, se usó un régimen de quimioterapia multifarmacológica que incluía dosis altas de metotrexato intravenoso e intraventricular. Este régimen farmacológico no incluyó quimioterapia a dosis altas apoyada por rescate de médula ósea o células madre periféricas.[
80 ]- En el estudio, 19 pacientes con meduloblastoma desmoplásico o con nodularidad extensa (MBNE) tuvieron una tasa de SSC a 5 años del 90 % (± 7 %) y una tasa de SG del 100 % (± 0 %).
- Todos los pacientes se trataron con quimioterapia posoperatoria sola y no se administró radiación antes de la progresión.
- Una cohorte ampliada del ensayo alemán HIT 2000 incluyó otros 23 niños con desmoplasia nodular o MBNE que fueron tratados con el mismo régimen. Se notificaron los siguientes resultados:[
64 ,110 ]- Los resultados combinados confirmaron una supervivencia excelente, con una tasa de SSC a 5 años superior al 90 %.
- En esta cohorte ampliada, se realizó una caracterización molecular y se identificó un subconjunto de tumores con señalización de SHH. Estos pacientes con tumores que exhibían señalización de SHH tenían un pronóstico excelente similar.
- La caracterización adicional del subtipo molecular de señalización de SHH mediante anomalías cromosómicas no identificó ninguna diferencia en la SSC ni en la SG.
- En otros estudios se ha indicado que la subdivisión adicional por anomalías cromosómicas en niños pequeños con meduloblastoma con activación de SHH era predictiva del resultado.
- En un ensayo clínico del COG (CCG-9921) también se observó un resultado favorable para los niños con meduloblastoma desmoplásico (incluido MBNE). En este estudio, los pacientes con tumores desmoplásicos no recibieron la radiación antes de la progresión.[
102 ]- Los pacientes del grupo de tumores desmoplásicos lograron una tasa de SSC del 77 % (±9 %) y una tasa de SG del 85 % (±8 %), en comparación con una tasa de SSC del 17 % (±5 %) y una tasa de SG del 29 % (±6 %) para los pacientes del grupo de tumores no desmoplásicos (P < 0,0001 para las comparaciones de SSC y SG).
- En el estudio COG-ACNS1221 (NCT02017964) se probó una quimioterapia sistémica idéntica a la usada en el ensayo alemán HIT 2000, salvo por la omisión del metotrexato intraventricular.[
28 ]- El estudio se suspendió antes de lo previsto debido a una tasa de recaídas superior a la esperada, con una tasa de SSP a 2 años del 52 % en los 25 pacientes estudiados.
- Otra opción de tratamiento para los niños menores de 3 años en el momento del diagnóstico es la quimioterapia de dosis alta. Los resultados de los ensayos en los que se utilizaron regímenes quimioterapéuticos mielosupresores de dosis más altas apoyados con rescate de células madre también mostraron que un subgrupo de pacientes con meduloblastoma menores de 3 años y, en algunos estudios, menores de 5 años, en el momento del diagnóstico se puede tratar de manera exitosa con quimioterapia sola.[
103 ,105 ,111 ][Nivel de evidencia B4]; [112 ]- Las mejores tasas de supervivencia con este abordaje quimioterapéutico a dosis más altas se han observado en pacientes con meduloblastoma desmoplásico y MBNE.[
112 ]- Tras el tratamiento con quimioterapia sin radioterapia simultánea, los pacientes con enfermedad no diseminada lograron tasas de supervivencia de casi el 90 %, y los pacientes con enfermedad diseminada lograron tasas de supervivencia del 80 %.
- Las mejores tasas de supervivencia con este abordaje quimioterapéutico a dosis más altas se han observado en pacientes con meduloblastoma desmoplásico y MBNE.[
- En un estudio se informó de los resultados de lactantes y niños pequeños con meduloblastoma recidivante a los que se trató inicialmente sin irradiación craneoespinal (ICE).[
113 ]- Una parte sustancial de estos niños recibieron tratamiento exitoso con regímenes a base de ICE.
- La tasa de supervivencia a los 3 años tras la recaída fue del 52,4 % para los pacientes a los que se trató con intención curativa.
- En el informe se observó que la mayor edad en el momento del diagnóstico, la recaída local y el subtipo de meduloblastoma infantil SHH se relacionaban con una mejor supervivencia tras la recaída.
- La adición de quimioterapia a la ICE no mejoró los desenlaces.
Meduloblastoma no desmoplásico, meduloblastoma sin nodularidad extensa y sin señalización de SHH
En comparación con los niños que tienen meduloblastoma desmoplásico o MBNE tratados con los actuales regímenes de quimioterapia intensiva, los niños con otros subtipos histológicos o moleculares no evolucionan tan bien. En un estudio reciente se indicó que los pacientes con tumores del grupo 4 identificados mediante análisis molecular evolucionaron bien con quimioterapia sola.[
Evidencia (quimioterapia):
- En los niños con tumores no desmoplásicos, sin nodularidad extensa ni señalización de SHH, las tasas de SSC son inferiores al 40 %, a pesar del uso de quimioterapia intensiva suplementada con metotrexato (intravenoso e intraventricular) o el uso de regímenes de quimioterapia de dosis altas con apoyo de rescate de células madre.[
67 ,102 ,110 ,112 ,114 ]- El desenlace es particularmente precario cuando estos pacientes tienen enfermedad diseminada.
- En algunos estudios se agregó la radiación dirigida al sitio del tumor primario o el eje craneoespinal después de la quimioterapia, lo que hace más difícil evaluar la eficacia de la quimioterapia.[
110 ,112 ,114 ]
No hay acuerdo sobre cuánta radioterapia (dosis y alcance) se debe administrar, y a qué edad se debe comenzar la radioterapia para los pacientes jóvenes con enfermedad localizada o diseminada.
- En el estudio HIT 2000 ampliado, la adición de radioterapia focal dirigida al sitio del tumor primario en pacientes con enfermedad localizada administrada después de la quimioterapia no mejoró la SSC ni la SG.[
110 ] - En el estudio del St. Jude Children's Research Hospital SJYC07 (NCT00602667) la radioterapia focal tampoco mejoró la SSC en lactantes con meduloblastoma de riesgo intermedio (tasa de SSC a 5 años, 25 % ± 12 %).[
64 ] - En el estudio del COG P9934 (NCT00006461), en el que también se empleó radioterapia focal, se observó una SSC similar (tasa de SSC a 4 años, 23 % ± 12 %) para pacientes con meduloblastoma no desmoplásico.[
115 ] - En el estudio SJYC07 de St. Jude, 29 de los 54 lactantes con meduloblastoma que progresaron recibieron irradiación craneoespinal (mediana de dosis, 36 Gy). De los 29 pacientes, 18 (62 %) sobrevivieron, en comparación con 6 (24 %) de los 25 pacientes que no recibieron irradiación craneoespinal.[
64 ]
Tratamiento de los niños mayores de 3 años con meduloblastoma de riesgo promedio
Las opciones de tratamiento estándar para los niños mayores de 3 años con meduloblastoma recién diagnosticado de riesgo promedio son las siguientes:
-
Cirugía . -
Radioterapia adyuvante . -
Quimioterapia adyuvante .
Cirugía
Si es viable, la extirpación total o casi total del tumor se considera óptima.[
Radioterapia adyuvante
Por lo general, la radioterapia se inicia después de la cirugía, con quimioterapia simultánea o sin esta.[
La dosis de radiación para los pacientes con meduloblastoma de riesgo promedio es de 54 Gy dirigidos a la fosa posterior o el lecho del tumor local, y de 23,4 Gy dirigidos a todo el eje encefalomedular (es decir, todo el encéfalo, la médula espinal y la columna vertebral), que se conoce como irradiación craneoespinal.[
Evidencia (radioterapia adyuvante):
- Cuando se usa radioterapia sola con dosis de radiación craneoespinal de 35 Gy y un refuerzo dirigido a la fosa posterior de 55 Gy, las tasas de SSC a 5 años oscilan entre el 50 % y el 65 % en quienes exhiben enfermedad sin diseminación.[
79 ,117 ] - No se conoce la dosis mínima de radiación craneoespinal necesaria para el control de la enfermedad. Los intentos de disminuir la dosis de radioterapia craneoespinal a 23,4 Gy sin quimioterapia han dado lugar a un aumento de la incidencia de recaídas leptomeníngeas aisladas.[
122 ] En una serie se intentó tratar a niños con tumores con activación de WNT mediante radioterapia focal sola, sin irradiación craneoespinal. En el estudio se observó una incidencia inaceptable de fracaso neuroaxial al omitirse la irradiación craneoespinal inicial.[123 ]Se evaluaron dosis y volúmenes de refuerzo de radiación craneoespinal más bajos en un estudio del COG (NCT00085735). Se asignaron al azar a niños de 3 a 7 años para recibir dosis de radiación craneoespinal de 18 Gy o 23,4 Gy, así como un refuerzo volumen dirigido a toda la fosa posterior versus refuerzo de volumen diana limitado al lecho tumoral.[
59 ][Nivel de evidencia A1]- En los resultados se reveló que la dosis de 18 Gy de irradiación craneoespinal fue menos eficaz que la dosis de 23,4 Gy de irradiación craneoespinal (tasa de SSC a 5 años del 82,6 % ± 4,2 % y tasa de SG del 85,8 % en los pacientes que recibieron 23,4 Gy vs. tasa de SSC del 71,9 % ± 4,9 % y tasa de SG del 77,9 % ± 4,9 % para los pacientes que recibieron 18 Gy).
- La tasa de SSC a 5 años fue del 82,5 % para los pacientes que recibieron radioterapia dirigida al lecho tumoral, en comparación con el 80,5 % para los pacientes que recibieron radioterapia en la fosa posterior. Por lo tanto, la radioterapia dirigida al lecho tumoral no fue menos eficaz que la radioterapia dirigida a la fosa posterior (cociente de riesgos instantáneos, 0,97; intervalo de confianza superior 94 %, 1,32).
El análisis según subgrupos moleculares demostró que los niños con meduloblastoma del grupo 4 que recibieron 18 Gy de radioterapia craneoespinal tuvieron una SSC más precaria que los que recibieron 23,4 Gy. Esto no se demostró en los otros subgrupos moleculares, aunque el estudio no tenía la dimensión necesaria para el análisis de subgrupos moleculares.[
59 ] Se está investigando la reducción de la dosis de irradiación craneoespinal a 18 Gy en pacientes con meduloblastoma WNT (NCT02724579), el subgrupo molecular de mejor pronóstico. - En el estudio SIOP-PNET-4 (NCT01351870) se comparó la radioterapia diaria (fracciones de 1,8 Gy, con 23,4 Gy dirigidos al eje encefalomedular y un refuerzo de 30 Gy a la fosa posterior) con radiación 2 veces al día (fracciones de 1 Gy, con 36 Gy y un refuerzo de 24 Gy dirigidos a la fosa posterior).[
124 ]- Al cabo de una mediana de seguimiento de 7,8 años, la SG a 10 años no fue significativamente diferente entre los dos grupos de radiación.
- No se notificaron efectos secundarios a largo plazo en este estudio.
- Si se añade quimioterapia después de la radioterapia, la radioterapia craneoespinal de 23,4 Gy ha mostrado ser una dosis eficaz.[
93 ,124 ,125 ,126 ] Se están evaluando dosis más bajas. - Aunque el refuerzo estándar para el meduloblastoma se dirige a la fosa posterior, las pautas de los datos de fracaso indica que la radioterapia dirigida al lecho tumoral, en lugar de toda la fosa posterior, es igualmente eficaz y quizás se relacione con reducción de la toxicidad.[
127 ,128 ]; [59 ][Nivel de evidencia A1]
Quimioterapia adyuvante
En la actualidad, la quimioterapia es un componente estándar del tratamiento de los niños con meduloblastoma de riesgo promedio.
Evidencia (quimioterapia adyuvante):
- En estudios aleatorizados prospectivos y en ensayos de un solo grupo, se indica que la quimioterapia adyuvante administrada durante la radioterapia y después de esta mejora la SG de los niños con meduloblastoma de riesgo promedio.[
90 ,116 ,117 ,118 ,119 ,120 ]- La administración de la radioterapia y la quimioterapia durante la cirugía y después de esta, mostró tasas de SSC a 5 años del 70 % al 85 %.[
116 ,117 ,118 ]; [129 ][Nivel de evidencia B4]
- La administración de la radioterapia y la quimioterapia durante la cirugía y después de esta, mostró tasas de SSC a 5 años del 70 % al 85 %.[
- Se observó que, si se usa una dosis más baja de radiación de 23,4 Gy dirigida al eje encefalomedular y se combina con quimioterapia, se logra el control de la enfermedad en hasta el 85 % de los pacientes y es posible disminuir la gravedad de las secuelas neurocognitivas a largo plazo.[
93 ,125 ,126 ,130 ] - Se ha utilizado con éxito una variedad de regímenes quimioterapéuticos, incluso la combinación de cisplatino, lomustina y vincristina, o la combinación de cisplatino, ciclofosfamida y vincristina.[
116 ,117 ,130 ,131 ]- Estas terapias aumentaron las tasas de SSC y SG a los 5 y 10 años, y es posible que redujeran la incidencia de la recaída tardía.
- No obstante, los sobrevivientes a largo plazo tratados con terapia multimodal presentan un riesgo alto de efectos tardíos como hipoacusia, complicaciones cardíacas y neoplasias secundarias.[
132 ]
Además, después de la radioterapia, el uso de dosis altas de ciclofosfamida con apoyo de rescate de células madre periféricas, pero con reducción de las dosis acumuladas de vincristina y cisplatino, se ha traducido en tasas de supervivencia similares.[
58 ] - Aunque el meduloblastoma a menudo es sensible a la quimioterapia, la quimioterapia prerradiación no ha mostrado mejorar la supervivencia en pacientes con meduloblastoma de riesgo promedio, en comparación con el tratamiento con radioterapia y quimioterapia posterior. En algunos estudios prospectivos, la quimioterapia prerradiación, se relacionó con una tasa de supervivencia más precaria.[
117 ,118 ,119 ,120 ]
Tratamiento de los niños mayores de 3 años con meduloblastoma de riesgo alto
Las opciones de tratamiento estándar para los niños mayores de 3 años con diagnóstico reciente de meduloblastoma y que tienen enfermedad metastásica o se sometieron a una resección subtotal incluyen los siguientes procedimientos:
-
Cirugía . -
Radioterapia adyuvante . -
Quimioterapia adyuvante .
En numerosos estudios se mostró que el tratamiento multimodal mejora la duración del control de la enfermedad y la supervivencia sin enfermedad (SSE) general en los pacientes de riesgo alto.[
Cirugía
El tratamiento para los pacientes de riesgo alto es el mismo que para los de riesgo promedio. Si es viable, un intento de resección macroscópica total se considera óptimo.[
Radioterapia adyuvante
A diferencia del tratamiento de riesgo estándar, la dosis de radiación craneoespinal, por lo general, es de 36 Gy.
Quimioterapia adyuvante
Evidencia (quimioterapia adyuvante):
- Los fármacos útiles para niños con enfermedad de riesgo promedio son los mismos que se han utilizado ampliamente en los niños con enfermedad de riesgo alto, como cisplatino, lomustina, ciclofosfamida, etopósido y vincristina.[
138 ]- Estas terapias aumentaron las tasas de SSC y SG a los 5 y 10 años, y es posible que redujeran la incidencia de la recaída tardía.
- No obstante, los sobrevivientes a largo plazo tratados con terapia multimodal presentan un riesgo alto de efectos tardíos como hipoacusia, complicaciones cardíacas y neoplasias secundarias.[
132 ]
- También se han usado dosis altas de quimioterapia no mieloablativa después del rescate con células madre periféricas y reducción de las dosis acumuladas de vincristina y cisplatino; esto se tradujo en tasas de SSP a 5 años de alrededor del 60 %.[
58 ] - En el estudio del COG ACNS0332 (NCT00392327) se asignó al azar a los pacientes para recibir carboplatino diario, en comparación con vincristina semanal, durante la radioterapia (36 Gy craneoespinales y un refuerzo en la fosa posterior) seguido de 6 ciclos de tratamiento adyuvante con cisplatino, ciclofosfamida y vincristina.[
134 ]- En los 261 pacientes evaluables, la tasa de SSC a 5 años fue del 62,9 % y la tasa de SG fue del 73,4 %.
- Para toda la cohorte, no hubo ninguna diferencia en la tasa de SSC para los pacientes tratados con carboplatino (66,4 %) que para los pacientes que no recibieron carboplatino (59,2 %).
- En un análisis de subconjuntos basado en la subagrupación molecular, los pacientes con meduloblastoma del grupo 3 parecieron beneficiarse del uso de carboplatino diario durante la radioterapia, con una tasa de SSC a 5 años del 73,2 % para los pacientes que recibieron carboplatino, en comparación con el 53,7 % para los que no lo recibieron.
- Una segunda aleatorización que probaba la utilidad del tratamiento de mantenimiento con isotretinoína se cerró en el momento de un análisis interino planificado por futilidad.
- En un ensayo de 51 pacientes con enfermedad de riesgo alto recién diagnosticada, los pacientes fueron tratados con quimioterapia de inducción postoperatoria (etopósido y carboplatino) seguida de 2 ciclos de dosis altas de tiotepa con rescate de células madre periféricas y radioterapia craneoespinal adaptada al riesgo.[
135 ]- Las tasas de SSC y SG a 5 años fueron del 76 %.
Opciones de tratamiento en evaluación clínica para el meduloblastoma infantil
Tal vez haya ensayos clínicos terapéuticos de fase inicial para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del
Referencias:
- Zhang J, Walsh MF, Wu G, et al.: Germline Mutations in Predisposition Genes in Pediatric Cancer. N Engl J Med 373 (24): 2336-46, 2015.
- Waszak SM, Northcott PA, Buchhalter I, et al.: Spectrum and prevalence of genetic predisposition in medulloblastoma: a retrospective genetic study and prospective validation in a clinical trial cohort. Lancet Oncol 19 (6): 785-798, 2018.
- Hamilton SR, Liu B, Parsons RE, et al.: The molecular basis of Turcot's syndrome. N Engl J Med 332 (13): 839-47, 1995.
- Taylor MD, Mainprize TG, Rutka JT, et al.: Medulloblastoma in a child with Rubenstein-Taybi Syndrome: case report and review of the literature. Pediatr Neurosurg 35 (5): 235-8, 2001.
- Miller RW, Rubinstein JH: Tumors in Rubinstein-Taybi syndrome. Am J Med Genet 56 (1): 112-5, 1995.
- Bourdeaut F, Miquel C, Richer W, et al.: Rubinstein-Taybi syndrome predisposing to non-WNT, non-SHH, group 3 medulloblastoma. Pediatr Blood Cancer 61 (2): 383-6, 2014.
- Garrè ML, Cama A, Bagnasco F, et al.: Medulloblastoma variants: age-dependent occurrence and relation to Gorlin syndrome--a new clinical perspective. Clin Cancer Res 15 (7): 2463-71, 2009.
- Pastorino L, Ghiorzo P, Nasti S, et al.: Identification of a SUFU germline mutation in a family with Gorlin syndrome. Am J Med Genet A 149A (7): 1539-43, 2009.
- Brugières L, Remenieras A, Pierron G, et al.: High frequency of germline SUFU mutations in children with desmoplastic/nodular medulloblastoma younger than 3 years of age. J Clin Oncol 30 (17): 2087-93, 2012.
- Evans DG, Farndon PA, Burnell LD, et al.: The incidence of Gorlin syndrome in 173 consecutive cases of medulloblastoma. Br J Cancer 64 (5): 959-61, 1991.
- Smith MJ, Beetz C, Williams SG, et al.: Germline mutations in SUFU cause Gorlin syndrome-associated childhood medulloblastoma and redefine the risk associated with PTCH1 mutations. J Clin Oncol 32 (36): 4155-61, 2014.
- Li FP, Fraumeni JF: Rhabdomyosarcoma in children: epidemiologic study and identification of a familial cancer syndrome. J Natl Cancer Inst 43 (6): 1365-73, 1969.
- Pearson AD, Craft AW, Ratcliffe JM, et al.: Two families with the Li-Fraumeni cancer family syndrome. J Med Genet 19 (5): 362-5, 1982.
- Kolodziejczak AS, Guerrini-Rousseau L, Planchon JM, et al.: Clinical outcome of pediatric medulloblastoma patients with Li-Fraumeni syndrome. Neuro Oncol 25 (12): 2273-2286, 2023.
- de Chadarévian JP, Vekemans M, Bernstein M: Fanconi's anemia, medulloblastoma, Wilms' tumor, horseshoe kidney, and gonadal dysgenesis. Arch Pathol Lab Med 109 (4): 367-9, 1985.
- Offit K, Levran O, Mullaney B, et al.: Shared genetic susceptibility to breast cancer, brain tumors, and Fanconi anemia. J Natl Cancer Inst 95 (20): 1548-51, 2003.
- Dewire MD, Ellison DW, Patay Z, et al.: Fanconi anemia and biallelic BRCA2 mutation diagnosed in a young child with an embryonal CNS tumor. Pediatr Blood Cancer 53 (6): 1140-2, 2009.
- Reid S, Renwick A, Seal S, et al.: Biallelic BRCA2 mutations are associated with multiple malignancies in childhood including familial Wilms tumour. J Med Genet 42 (2): 147-51, 2005.
- Begemann M, Waszak SM, Robinson GW, et al.: Germline GPR161 Mutations Predispose to Pediatric Medulloblastoma. J Clin Oncol 38 (1): 43-50, 2020.
- Waszak SM, Robinson GW, Gudenas BL, et al.: Germline Elongator mutations in Sonic Hedgehog medulloblastoma. Nature 580 (7803): 396-401, 2020.
- Rorke LB: The cerebellar medulloblastoma and its relationship to primitive neuroectodermal tumors. J Neuropathol Exp Neurol 42 (1): 1-15, 1983.
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021.
- Ramaswamy V, Remke M, Shih D, et al.: Duration of the pre-diagnostic interval in medulloblastoma is subgroup dependent. Pediatr Blood Cancer 61 (7): 1190-4, 2014.
- WHO Classification of Tumours Editorial Board, ed.: WHO Classification of Tumours: Central Nervous System Tumours. Vol. 6. 5th ed. IARC Press; 2021.
- McManamy CS, Lamont JM, Taylor RE, et al.: Morphophenotypic variation predicts clinical behavior in childhood non-desmoplastic medulloblastomas. J Neuropathol Exp Neurol 62 (6): 627-32, 2003.
- Eberhart CG, Kratz J, Wang Y, et al.: Histopathological and molecular prognostic markers in medulloblastoma: c-myc, N-myc, TrkC, and anaplasia. J Neuropathol Exp Neurol 63 (5): 441-9, 2004.
- Giangaspero F, Perilongo G, Fondelli MP, et al.: Medulloblastoma with extensive nodularity: a variant with favorable prognosis. J Neurosurg 91 (6): 971-7, 1999.
- Lafay-Cousin L, Bouffet E, Strother D, et al.: Phase II Study of Nonmetastatic Desmoplastic Medulloblastoma in Children Younger Than 4 Years of Age: A Report of the Children's Oncology Group (ACNS1221). J Clin Oncol 38 (3): 223-231, 2020.
- Korshunov A, Okonechnikov K, Sahm F, et al.: Transcriptional profiling of medulloblastoma with extensive nodularity (MBEN) reveals two clinically relevant tumor subsets with VSNL1 as potent prognostic marker. Acta Neuropathol 139 (3): 583-596, 2020.
- Onvani S, Etame AB, Smith CA, et al.: Genetics of medulloblastoma: clues for novel therapies. Expert Rev Neurother 10 (5): 811-23, 2010.
- Dubuc AM, Northcott PA, Mack S, et al.: The genetics of pediatric brain tumors. Curr Neurol Neurosci Rep 10 (3): 215-23, 2010.
- Thompson MC, Fuller C, Hogg TL, et al.: Genomics identifies medulloblastoma subgroups that are enriched for specific genetic alterations. J Clin Oncol 24 (12): 1924-31, 2006.
- Kool M, Koster J, Bunt J, et al.: Integrated genomics identifies five medulloblastoma subtypes with distinct genetic profiles, pathway signatures and clinicopathological features. PLoS One 3 (8): e3088, 2008.
- Tabori U, Baskin B, Shago M, et al.: Universal poor survival in children with medulloblastoma harboring somatic TP53 mutations. J Clin Oncol 28 (8): 1345-50, 2010.
- Pfister S, Remke M, Benner A, et al.: Outcome prediction in pediatric medulloblastoma based on DNA copy-number aberrations of chromosomes 6q and 17q and the MYC and MYCN loci. J Clin Oncol 27 (10): 1627-36, 2009.
- Ellison DW, Onilude OE, Lindsey JC, et al.: beta-Catenin status predicts a favorable outcome in childhood medulloblastoma: the United Kingdom Children's Cancer Study Group Brain Tumour Committee. J Clin Oncol 23 (31): 7951-7, 2005.
- Polkinghorn WR, Tarbell NJ: Medulloblastoma: tumorigenesis, current clinical paradigm, and efforts to improve risk stratification. Nat Clin Pract Oncol 4 (5): 295-304, 2007.
- Giangaspero F, Wellek S, Masuoka J, et al.: Stratification of medulloblastoma on the basis of histopathological grading. Acta Neuropathol 112 (1): 5-12, 2006.
- Northcott PA, Korshunov A, Witt H, et al.: Medulloblastoma comprises four distinct molecular variants. J Clin Oncol 29 (11): 1408-14, 2011.
- Pomeroy SL, Tamayo P, Gaasenbeek M, et al.: Prediction of central nervous system embryonal tumour outcome based on gene expression. Nature 415 (6870): 436-42, 2002.
- Jones DT, Jäger N, Kool M, et al.: Dissecting the genomic complexity underlying medulloblastoma. Nature 488 (7409): 100-5, 2012.
- Peyrl A, Chocholous M, Kieran MW, et al.: Antiangiogenic metronomic therapy for children with recurrent embryonal brain tumors. Pediatr Blood Cancer 59 (3): 511-7, 2012.
- Taylor MD, Northcott PA, Korshunov A, et al.: Molecular subgroups of medulloblastoma: the current consensus. Acta Neuropathol 123 (4): 465-72, 2012.
- Kool M, Korshunov A, Remke M, et al.: Molecular subgroups of medulloblastoma: an international meta-analysis of transcriptome, genetic aberrations, and clinical data of WNT, SHH, Group 3, and Group 4 medulloblastomas. Acta Neuropathol 123 (4): 473-84, 2012.
- Pietsch T, Schmidt R, Remke M, et al.: Prognostic significance of clinical, histopathological, and molecular characteristics of medulloblastomas in the prospective HIT2000 multicenter clinical trial cohort. Acta Neuropathol 128 (1): 137-49, 2014.
- Cho YJ, Tsherniak A, Tamayo P, et al.: Integrative genomic analysis of medulloblastoma identifies a molecular subgroup that drives poor clinical outcome. J Clin Oncol 29 (11): 1424-30, 2011.
- Gajjar A, Bowers DC, Karajannis MA, et al.: Pediatric Brain Tumors: Innovative Genomic Information Is Transforming the Diagnostic and Clinical Landscape. J Clin Oncol 33 (27): 2986-98, 2015.
- Morrissy AS, Cavalli FMG, Remke M, et al.: Spatial heterogeneity in medulloblastoma. Nat Genet 49 (5): 780-788, 2017.
- Wang X, Dubuc AM, Ramaswamy V, et al.: Medulloblastoma subgroups remain stable across primary and metastatic compartments. Acta Neuropathol 129 (3): 449-57, 2015.
- Cavalli FMG, Remke M, Rampasek L, et al.: Intertumoral Heterogeneity within Medulloblastoma Subgroups. Cancer Cell 31 (6): 737-754.e6, 2017.
- Northcott PA, Buchhalter I, Morrissy AS, et al.: The whole-genome landscape of medulloblastoma subtypes. Nature 547 (7663): 311-317, 2017.
- Schwalbe EC, Lindsey JC, Nakjang S, et al.: Novel molecular subgroups for clinical classification and outcome prediction in childhood medulloblastoma: a cohort study. Lancet Oncol 18 (7): 958-971, 2017.
- Hicks D, Rafiee G, Schwalbe EC, et al.: The molecular landscape and associated clinical experience in infant medulloblastoma: prognostic significance of second-generation subtypes. Neuropathol Appl Neurobiol 47 (2): 236-250, 2021.
- Northcott PA, Jones DT, Kool M, et al.: Medulloblastomics: the end of the beginning. Nat Rev Cancer 12 (12): 818-34, 2012.
- Korshunov A, Sahm F, Zheludkova O, et al.: DNA methylation profiling is a method of choice for molecular verification of pediatric WNT-activated medulloblastomas. Neuro Oncol 21 (2): 214-221, 2019.
- Gibson P, Tong Y, Robinson G, et al.: Subtypes of medulloblastoma have distinct developmental origins. Nature 468 (7327): 1095-9, 2010.
- Ellison DW, Dalton J, Kocak M, et al.: Medulloblastoma: clinicopathological correlates of SHH, WNT, and non-SHH/WNT molecular subgroups. Acta Neuropathol 121 (3): 381-96, 2011.
- Gajjar A, Chintagumpala M, Ashley D, et al.: Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. Lancet Oncol 7 (10): 813-20, 2006.
- Michalski JM, Janss AJ, Vezina LG, et al.: Children's Oncology Group Phase III Trial of Reduced-Dose and Reduced-Volume Radiotherapy With Chemotherapy for Newly Diagnosed Average-Risk Medulloblastoma. J Clin Oncol 39 (24): 2685-2697, 2021.
- Goschzik T, Mynarek M, Doerner E, et al.: Genetic alterations of TP53 and OTX2 indicate increased risk of relapse in WNT medulloblastomas. Acta Neuropathol 144 (6): 1143-1156, 2022.
- Shuai S, Suzuki H, Diaz-Navarro A, et al.: The U1 spliceosomal RNA is recurrently mutated in multiple cancers. Nature 574 (7780): 712-716, 2019.
- Suzuki H, Kumar SA, Shuai S, et al.: Recurrent noncoding U1 snRNA mutations drive cryptic splicing in SHH medulloblastoma. Nature 574 (7780): 707-711, 2019.
- Kool M, Jones DT, Jäger N, et al.: Genome sequencing of SHH medulloblastoma predicts genotype-related response to smoothened inhibition. Cancer Cell 25 (3): 393-405, 2014.
- Robinson GW, Rudneva VA, Buchhalter I, et al.: Risk-adapted therapy for young children with medulloblastoma (SJYC07): therapeutic and molecular outcomes from a multicentre, phase 2 trial. Lancet Oncol 19 (6): 768-784, 2018.
- Leary SE, Zhou T, Holmes E, et al.: Histology predicts a favorable outcome in young children with desmoplastic medulloblastoma: a report from the children's oncology group. Cancer 117 (14): 3262-7, 2011.
- Rutkowski S, von Hoff K, Emser A, et al.: Survival and prognostic factors of early childhood medulloblastoma: an international meta-analysis. J Clin Oncol 28 (33): 4961-8, 2010.
- von Bueren AO, von Hoff K, Pietsch T, et al.: Treatment of young children with localized medulloblastoma by chemotherapy alone: results of the prospective, multicenter trial HIT 2000 confirming the prognostic impact of histology. Neuro Oncol 13 (6): 669-79, 2011.
- Shih DJ, Northcott PA, Remke M, et al.: Cytogenetic prognostication within medulloblastoma subgroups. J Clin Oncol 32 (9): 886-96, 2014.
- Schwalbe EC, Williamson D, Lindsey JC, et al.: DNA methylation profiling of medulloblastoma allows robust subclassification and improved outcome prediction using formalin-fixed biopsies. Acta Neuropathol 125 (3): 359-71, 2013.
- Zhukova N, Ramaswamy V, Remke M, et al.: Subgroup-specific prognostic implications of TP53 mutation in medulloblastoma. J Clin Oncol 31 (23): 2927-35, 2013.
- Gajjar A, Robinson GW, Smith KS, et al.: Outcomes by Clinical and Molecular Features in Children With Medulloblastoma Treated With Risk-Adapted Therapy: Results of an International Phase III Trial (SJMB03). J Clin Oncol 39 (7): 822-835, 2021.
- Goschzik T, Schwalbe EC, Hicks D, et al.: Prognostic effect of whole chromosomal aberration signatures in standard-risk, non-WNT/non-SHH medulloblastoma: a retrospective, molecular analysis of the HIT-SIOP PNET 4 trial. Lancet Oncol 19 (12): 1602-1616, 2018.
- Gottardo NG, Hansford JR, McGlade JP, et al.: Medulloblastoma Down Under 2013: a report from the third annual meeting of the International Medulloblastoma Working Group. Acta Neuropathol 127 (2): 189-201, 2014.
- Louis DN, Perry A, Burger P, et al.: International Society Of Neuropathology--Haarlem consensus guidelines for nervous system tumor classification and grading. Brain Pathol 24 (5): 429-35, 2014.
- Sharma T, Schwalbe EC, Williamson D, et al.: Second-generation molecular subgrouping of medulloblastoma: an international meta-analysis of Group 3 and Group 4 subtypes. Acta Neuropathol 138 (2): 309-326, 2019.
- Fouladi M, Gajjar A, Boyett JM, et al.: Comparison of CSF cytology and spinal magnetic resonance imaging in the detection of leptomeningeal disease in pediatric medulloblastoma or primitive neuroectodermal tumor. J Clin Oncol 17 (10): 3234-7, 1999.
- Zeltzer PM, Boyett JM, Finlay JL, et al.: Metastasis stage, adjuvant treatment, and residual tumor are prognostic factors for medulloblastoma in children: conclusions from the Children's Cancer Group 921 randomized phase III study. J Clin Oncol 17 (3): 832-45, 1999.
- Yao MS, Mehta MP, Boyett JM, et al.: The effect of M-stage on patterns of failure in posterior fossa primitive neuroectodermal tumors treated on CCG-921: a phase III study in a high-risk patient population. Int J Radiat Oncol Biol Phys 38 (3): 469-76, 1997.
- Taylor RE, Bailey CC, Robinson K, et al.: Results of a randomized study of preradiation chemotherapy versus radiotherapy alone for nonmetastatic medulloblastoma: The International Society of Paediatric Oncology/United Kingdom Children's Cancer Study Group PNET-3 Study. J Clin Oncol 21 (8): 1581-91, 2003.
- Rutkowski S, Bode U, Deinlein F, et al.: Treatment of early childhood medulloblastoma by postoperative chemotherapy alone. N Engl J Med 352 (10): 978-86, 2005.
- Rutkowski S, Gerber NU, von Hoff K, et al.: Treatment of early childhood medulloblastoma by postoperative chemotherapy and deferred radiotherapy. Neuro Oncol 11 (2): 201-10, 2009.
- Ramaswamy V, Remke M, Adamski J, et al.: Medulloblastoma subgroup-specific outcomes in irradiated children: who are the true high-risk patients? Neuro Oncol 18 (2): 291-7, 2016.
- Albright AL, Wisoff JH, Zeltzer PM, et al.: Effects of medulloblastoma resections on outcome in children: a report from the Children's Cancer Group. Neurosurgery 38 (2): 265-71, 1996.
- Thompson EM, Hielscher T, Bouffet E, et al.: Prognostic value of medulloblastoma extent of resection after accounting for molecular subgroup: a retrospective integrated clinical and molecular analysis. Lancet Oncol 17 (4): 484-95, 2016.
- Stargatt R, Rosenfeld JV, Maixner W, et al.: Multiple factors contribute to neuropsychological outcome in children with posterior fossa tumors. Dev Neuropsychol 32 (2): 729-48, 2007.
- Pollack IF, Polinko P, Albright AL, et al.: Mutism and pseudobulbar symptoms after resection of posterior fossa tumors in children: incidence and pathophysiology. Neurosurgery 37 (5): 885-93, 1995.
- Robertson PL, Muraszko KM, Holmes EJ, et al.: Incidence and severity of postoperative cerebellar mutism syndrome in children with medulloblastoma: a prospective study by the Children's Oncology Group. J Neurosurg 105 (6): 444-51, 2006.
- Wells EM, Khademian ZP, Walsh KS, et al.: Postoperative cerebellar mutism syndrome following treatment of medulloblastoma: neuroradiographic features and origin. J Neurosurg Pediatr 5 (4): 329-34, 2010.
- Gudrunardottir T, Sehested A, Juhler M, et al.: Cerebellar mutism: review of the literature. Childs Nerv Syst 27 (3): 355-63, 2011.
- Wolfe-Christensen C, Mullins LL, Scott JG, et al.: Persistent psychosocial problems in children who develop posterior fossa syndrome after medulloblastoma resection. Pediatr Blood Cancer 49 (5): 723-6, 2007.
- Jabarkheel R, Amayiri N, Yecies D, et al.: Molecular correlates of cerebellar mutism syndrome in medulloblastoma. Neuro Oncol 22 (2): 290-297, 2020.
- Khan RB, Patay Z, Klimo P, et al.: Clinical features, neurologic recovery, and risk factors of postoperative posterior fossa syndrome and delayed recovery: a prospective study. Neuro Oncol 23 (9): 1586-1596, 2021.
- Packer RJ, Gajjar A, Vezina G, et al.: Phase III study of craniospinal radiation therapy followed by adjuvant chemotherapy for newly diagnosed average-risk medulloblastoma. J Clin Oncol 24 (25): 4202-8, 2006.
- Yock TI, Yeap BY, Ebb DH, et al.: Long-term toxic effects of proton radiotherapy for paediatric medulloblastoma: a phase 2 single-arm study. Lancet Oncol 17 (3): 287-98, 2016.
- Eaton BR, Esiashvili N, Kim S, et al.: Clinical Outcomes Among Children With Standard-Risk Medulloblastoma Treated With Proton and Photon Radiation Therapy: A Comparison of Disease Control and Overall Survival. Int J Radiat Oncol Biol Phys 94 (1): 133-8, 2016.
- Paulino AC, Mahajan A, Ye R, et al.: Ototoxicity and cochlear sparing in children with medulloblastoma: Proton vs. photon radiotherapy. Radiother Oncol 128 (1): 128-132, 2018.
- Ris MD, Packer R, Goldwein J, et al.: Intellectual outcome after reduced-dose radiation therapy plus adjuvant chemotherapy for medulloblastoma: a Children's Cancer Group study. J Clin Oncol 19 (15): 3470-6, 2001.
- Packer RJ, Sutton LN, Atkins TE, et al.: A prospective study of cognitive function in children receiving whole-brain radiotherapy and chemotherapy: 2-year results. J Neurosurg 70 (5): 707-13, 1989.
- Johnson DL, McCabe MA, Nicholson HS, et al.: Quality of long-term survival in young children with medulloblastoma. J Neurosurg 80 (6): 1004-10, 1994.
- Walter AW, Mulhern RK, Gajjar A, et al.: Survival and neurodevelopmental outcome of young children with medulloblastoma at St Jude Children's Research Hospital. J Clin Oncol 17 (12): 3720-8, 1999.
- Laughton SJ, Merchant TE, Sklar CA, et al.: Endocrine outcomes for children with embryonal brain tumors after risk-adapted craniospinal and conformal primary-site irradiation and high-dose chemotherapy with stem-cell rescue on the SJMB-96 trial. J Clin Oncol 26 (7): 1112-8, 2008.
- Geyer JR, Sposto R, Jennings M, et al.: Multiagent chemotherapy and deferred radiotherapy in infants with malignant brain tumors: a report from the Children's Cancer Group. J Clin Oncol 23 (30): 7621-31, 2005.
- Chi SN, Gardner SL, Levy AS, et al.: Feasibility and response to induction chemotherapy intensified with high-dose methotrexate for young children with newly diagnosed high-risk disseminated medulloblastoma. J Clin Oncol 22 (24): 4881-7, 2004.
- Grill J, Sainte-Rose C, Jouvet A, et al.: Treatment of medulloblastoma with postoperative chemotherapy alone: an SFOP prospective trial in young children. Lancet Oncol 6 (8): 573-80, 2005.
- Cohen BH, Geyer JR, Miller DC, et al.: Pilot Study of Intensive Chemotherapy With Peripheral Hematopoietic Cell Support for Children Less Than 3 Years of Age With Malignant Brain Tumors, the CCG-99703 Phase I/II Study. A Report From the Children's Oncology Group. Pediatr Neurol 53 (1): 31-46, 2015.
- Duffner PK, Horowitz ME, Krischer JP, et al.: Postoperative chemotherapy and delayed radiation in children less than three years of age with malignant brain tumors. N Engl J Med 328 (24): 1725-31, 1993.
- Ater JL, van Eys J, Woo SY, et al.: MOPP chemotherapy without irradiation as primary postsurgical therapy for brain tumors in infants and young children. J Neurooncol 32 (3): 243-52, 1997.
- Grundy RG, Wilne SH, Robinson KJ, et al.: Primary postoperative chemotherapy without radiotherapy for treatment of brain tumours other than ependymoma in children under 3 years: results of the first UKCCSG/SIOP CNS 9204 trial. Eur J Cancer 46 (1): 120-33, 2010.
- Blaney SM, Kocak M, Gajjar A, et al.: Pilot study of systemic and intrathecal mafosfamide followed by conformal radiation for infants with intracranial central nervous system tumors: a pediatric brain tumor consortium study (PBTC-001). J Neurooncol 109 (3): 565-71, 2012.
- Mynarek M, von Hoff K, Pietsch T, et al.: Nonmetastatic Medulloblastoma of Early Childhood: Results From the Prospective Clinical Trial HIT-2000 and An Extended Validation Cohort. J Clin Oncol 38 (18): 2028-2040, 2020.
- Dhall G, Grodman H, Ji L, et al.: Outcome of children less than three years old at diagnosis with non-metastatic medulloblastoma treated with chemotherapy on the "Head Start" I and II protocols. Pediatr Blood Cancer 50 (6): 1169-75, 2008.
- Dhall G, O'Neil SH, Ji L, et al.: Excellent outcome of young children with nodular desmoplastic medulloblastoma treated on "Head Start" III: a multi-institutional, prospective clinical trial. Neuro Oncol 22 (12): 1862-1872, 2020.
- Erker C, Mynarek M, Bailey S, et al.: Outcomes of Infants and Young Children With Relapsed Medulloblastoma After Initial Craniospinal Irradiation-Sparing Approaches: An International Cohort Study. J Clin Oncol 41 (10): 1921-1932, 2023.
- Lafay-Cousin L, Smith A, Chi SN, et al.: Clinical, Pathological, and Molecular Characterization of Infant Medulloblastomas Treated with Sequential High-Dose Chemotherapy. Pediatr Blood Cancer 63 (9): 1527-34, 2016.
- Ashley DM, Merchant TE, Strother D, et al.: Induction chemotherapy and conformal radiation therapy for very young children with nonmetastatic medulloblastoma: Children's Oncology Group study P9934. J Clin Oncol 30 (26): 3181-6, 2012.
- Packer RJ, Sutton LN, Elterman R, et al.: Outcome for children with medulloblastoma treated with radiation and cisplatin, CCNU, and vincristine chemotherapy. J Neurosurg 81 (5): 690-8, 1994.
- Bailey CC, Gnekow A, Wellek S, et al.: Prospective randomised trial of chemotherapy given before radiotherapy in childhood medulloblastoma. International Society of Paediatric Oncology (SIOP) and the (German) Society of Paediatric Oncology (GPO): SIOP II. Med Pediatr Oncol 25 (3): 166-78, 1995.
- Kortmann RD, Kühl J, Timmermann B, et al.: Postoperative neoadjuvant chemotherapy before radiotherapy as compared to immediate radiotherapy followed by maintenance chemotherapy in the treatment of medulloblastoma in childhood: results of the German prospective randomized trial HIT '91. Int J Radiat Oncol Biol Phys 46 (2): 269-79, 2000.
- Taylor RE, Bailey CC, Robinson KJ, et al.: Impact of radiotherapy parameters on outcome in the International Society of Paediatric Oncology/United Kingdom Children's Cancer Study Group PNET-3 study of preradiotherapy chemotherapy for M0-M1 medulloblastoma. Int J Radiat Oncol Biol Phys 58 (4): 1184-93, 2004.
- von Hoff K, Hinkes B, Gerber NU, et al.: Long-term outcome and clinical prognostic factors in children with medulloblastoma treated in the prospective randomised multicentre trial HIT'91. Eur J Cancer 45 (7): 1209-17, 2009.
- Cohen KJ, Munjapara V, Aguilera D, et al.: A Pilot Study Omitting Radiation in the Treatment of Children with Newly Diagnosed Wnt-Activated Medulloblastoma. Clin Cancer Res 29 (24): 5031-5037, 2023.
- Thomas PR, Deutsch M, Kepner JL, et al.: Low-stage medulloblastoma: final analysis of trial comparing standard-dose with reduced-dose neuraxis irradiation. J Clin Oncol 18 (16): 3004-11, 2000.
- Gupta T, Pervez S, Dasgupta A, et al.: Omission of Upfront Craniospinal Irradiation in Patients with Low-Risk WNT-Pathway Medulloblastoma Is Associated with Unacceptably High Risk of Neuraxial Failure. Clin Cancer Res 28 (19): 4180-4185, 2022.
- Sabel M, Fleischhack G, Tippelt S, et al.: Relapse patterns and outcome after relapse in standard risk medulloblastoma: a report from the HIT-SIOP-PNET4 study. J Neurooncol 129 (3): 515-524, 2016.
- Oyharcabal-Bourden V, Kalifa C, Gentet JC, et al.: Standard-risk medulloblastoma treated by adjuvant chemotherapy followed by reduced-dose craniospinal radiation therapy: a French Society of Pediatric Oncology Study. J Clin Oncol 23 (21): 4726-34, 2005.
- Merchant TE, Kun LE, Krasin MJ, et al.: Multi-institution prospective trial of reduced-dose craniospinal irradiation (23.4 Gy) followed by conformal posterior fossa (36 Gy) and primary site irradiation (55.8 Gy) and dose-intensive chemotherapy for average-risk medulloblastoma. Int J Radiat Oncol Biol Phys 70 (3): 782-7, 2008.
- Fukunaga-Johnson N, Sandler HM, Marsh R, et al.: The use of 3D conformal radiotherapy (3D CRT) to spare the cochlea in patients with medulloblastoma. Int J Radiat Oncol Biol Phys 41 (1): 77-82, 1998.
- Huang E, Teh BS, Strother DR, et al.: Intensity-modulated radiation therapy for pediatric medulloblastoma: early report on the reduction of ototoxicity. Int J Radiat Oncol Biol Phys 52 (3): 599-605, 2002.
- Carrie C, Grill J, Figarella-Branger D, et al.: Online quality control, hyperfractionated radiotherapy alone and reduced boost volume for standard risk medulloblastoma: long-term results of MSFOP 98. J Clin Oncol 27 (11): 1879-83, 2009.
- Packer RJ, Goldwein J, Nicholson HS, et al.: Treatment of children with medulloblastomas with reduced-dose craniospinal radiation therapy and adjuvant chemotherapy: A Children's Cancer Group Study. J Clin Oncol 17 (7): 2127-36, 1999.
- Nageswara Rao AA, Wallace DJ, Billups C, et al.: Cumulative cisplatin dose is not associated with event-free or overall survival in children with newly diagnosed average-risk medulloblastoma treated with cisplatin based adjuvant chemotherapy: report from the Children's Oncology Group. Pediatr Blood Cancer 61 (1): 102-6, 2014.
- Salloum R, Chen Y, Yasui Y, et al.: Late Morbidity and Mortality Among Medulloblastoma Survivors Diagnosed Across Three Decades: A Report From the Childhood Cancer Survivor Study. J Clin Oncol 37 (9): 731-740, 2019.
- Verlooy J, Mosseri V, Bracard S, et al.: Treatment of high risk medulloblastomas in children above the age of 3 years: a SFOP study. Eur J Cancer 42 (17): 3004-14, 2006.
- Leary SES, Packer RJ, Li Y, et al.: Efficacy of Carboplatin and Isotretinoin in Children With High-risk Medulloblastoma: A Randomized Clinical Trial From the Children's Oncology Group. JAMA Oncol 7 (9): 1313-1321, 2021.
- Dufour C, Foulon S, Geoffray A, et al.: Prognostic relevance of clinical and molecular risk factors in children with high-risk medulloblastoma treated in the phase II trial PNET HR+5. Neuro Oncol 23 (7): 1163-1172, 2021.
- Gandola L, Massimino M, Cefalo G, et al.: Hyperfractionated accelerated radiotherapy in the Milan strategy for metastatic medulloblastoma. J Clin Oncol 27 (4): 566-71, 2009.
- Evans AE, Jenkin RD, Sposto R, et al.: The treatment of medulloblastoma. Results of a prospective randomized trial of radiation therapy with and without CCNU, vincristine, and prednisone. J Neurosurg 72 (4): 572-82, 1990.
- Jakacki RI, Burger PC, Zhou T, et al.: Outcome of children with metastatic medulloblastoma treated with carboplatin during craniospinal radiotherapy: a Children's Oncology Group Phase I/II study. J Clin Oncol 30 (21): 2648-53, 2012.
- Tarbell NJ, Friedman H, Polkinghorn WR, et al.: High-risk medulloblastoma: a pediatric oncology group randomized trial of chemotherapy before or after radiation therapy (POG 9031). J Clin Oncol 31 (23): 2936-41, 2013.
- von Bueren AO, Kortmann RD, von Hoff K, et al.: Treatment of Children and Adolescents With Metastatic Medulloblastoma and Prognostic Relevance of Clinical and Biologic Parameters. J Clin Oncol 34 (34): 4151-4160, 2016.
Tumores embrionarios distintos del meduloblastoma infantil
La clasificación de la Organización Mundial de la Salud (OMS) de 2021 de los tumores del sistema nervioso central (SNC) se, enumera en la sección
Cuadro clínico inicial
En los tumores embrionarios distintos del meduloblastoma, el cuadro clínico inicial también es relativamente rápido y depende de la ubicación del tumor en el sistema nervioso. Los tumores embrionarios suelen crecer rápido y, por lo común, se diagnostican durante los primeros 3 meses a partir de la aparición de los síntomas.
Los tumores embrionarios distintos del meduloblastoma surgen en cualquier lugar del SNC y su presentación clínica es variable. Por lo general, producen disfunción neurológica importante relacionada con letargo y vómitos. Los tumores embrionarios supratentoriales (consultar la
Clasificación celular y molecular
En la clasificación de tumores del SNC de la OMS de 2021 se incluyen los tumores embrionarios distintos del meduloblastoma, a partir de sus características histológicas e inmunohistológicas y, en algunos casos, por hallazgos moleculares. Esta clasificación incluye los siguientes tumores:[
- Tumor teratoide rabdoide atípico (TTRA).
- Tumor neuroepitelial cribiforme.
- Tumor embrionario con rosetas de capas múltiples (ETMR).
- Neuroblastoma del SNC con activación de FOXR2.
- Tumor del SNC con duplicación interna en tándem de BCOR.
- Tumor embrionario del sistema nervioso central, sin clasificar (SC) o sin otra indicación (SAI).
SC se define como un tumor no clasificado en otro lugar. La nomenclatura SAI se usa para los tumores que no pueden clasificarse de otro modo. Para muchas lesiones, existen características histológicas superpuestas, y la agrupación basada en la metilación es fundamental para lograr un diagnóstico específico.[
Subtipos de tumores embrionarios distintos del meduloblastoma
Subtipos moleculares de tumores embrionarios distintos del meduloblastoma
En los estudios en el que se aplicaron métodos de agrupamiento sin supervisión de los patrones de metilación del DNA a tumores embrionarios distintos del meduloblastoma, se observó que cerca de la mitad de los tumores diagnosticados como tumores embrionarios distintos del meduloblastoma exhibían perfiles moleculares característicos de otros tumores de encéfalo (cerebrales) infantiles conocidos (por ejemplo, glioma de grado alto).[
Entre los tumores diagnosticados como tumores embrionarios distintos del meduloblastoma, la caracterización molecular permitió identificar subtipos distintivos por sus características genómicas y biológicas. Estos subtipos son los siguientes:
- Tumor neuroepitelial cribiforme. Este subtipo, que representa menos del 50 % de los tumores embrionarios distintos del meduloblastoma, es un tumor no rabdoide que se presenta en las proximidades de cualquiera de los ventrículos (tercer, cuarto o laterales). Se caracteriza por presentar cordones y cintas cribiformes y exhibe la pérdida de expresión nuclear de SMARCB1. La mediana de edad en el momento del diagnóstico es de 20 meses. Este tumor se presenta con más frecuencia en los hombres, con una proporción hombre-mujer de 1,5 a 1.[
6 ] - Tumor embrionario con rosetas de capas múltiples (ETMR). Este subtipo, que representa hasta el 20 % de los tumores embrionarios distintos del meduloblastoma, abarca los tumores neuroepiteliales embrionarios de encéfalo que forman rosetas, que antes se clasificaban como tumores embrionarios con neurópilo abundante y rosetas verdaderas (ETANTR), ependimoblastomas o meduloepiteliomas.[
4 ,7 ] Los ETMR se presentan con mayor frecuencia en niños pequeños (mediana de edad en el momento del diagnóstico, 2-3 años), pero es posible que se presenten también en niños más grandes.[5 ,7 ,8 ,9 ,10 ,11 ]A nivel molecular, los ETMR se definen por el alto grado de amplificación del complejo de microRNA C19MC y por una fusión génica entre TTYH1 y C19MC.[
7 ,12 ,13 ] Esta fusión génica pone la expresión de C19MC bajo el control del promotor de TTYH1, lo que produce un grado alto de expresión anormal de los microRNA dentro del conglomerado. La Organización Mundial de la Salud (OMS) admite que se clasifiquen como ETMR, sin otra indicación (SAI), los tumores con características histológicas semejantes, pero sin alteraciones de C19MC. Es posible que esta subclase de tumores sin alteraciones de C19MC albergue variantes bialélicas de DICER1. - Neuroblastoma del sistema nervioso central (SNC) con activación de FOXR2 (NB-FOXR2 del SNC). Este tumor, que representa entre el 10 % y el 15 % de los tumores embrionarios distintos del meduloblastoma, tal vez se presente en niños menores de 3 años, pero es más frecuente en niños más grandes. Este subtipo se caracteriza por alteraciones genómicas que conducen a un aumento de la expresión del factor de transcripción FOXR2.[
4 ] El NB-FOXR2 del SNC se observa sobre todo en niños menores de 10 años; las características histológicas de estos tumores suelen ser las del neuroblastoma del SNC o el ganglioneuroblastoma del SNC.[4 ,14 ] No hay una alteración genómica única en los tumores NB-FOXR2 del SNC que conduzca a la sobreexpresión de FOXR2; se han identificado fusiones génicas en las que participan múltiples genes recíprocos de FOXR2.[4 ] La expresión proteica de SOX10 y ANKRD55 detectada mediante inmunohistoquímica se ha propuesto como un potencial biomarcador para diferenciar los tumores NB-FOXR2 del SNC de otros tipos de tumores relacionados.[14 ] - Tumor neuroepitelial de grado alto con alteración en BCOR (HGNET-BCOR del SNC). Este subtipo representa hasta el 3 % de los tumores embrionarios distintos del meduloblastoma y se caracteriza por duplicaciones internas en tándem en BCOR,[
4 ] una alteración genómica que también se encuentra en el sarcoma de células claras de riñón.[15 ,16 ] A pesar de que la mediana de edad en el momento del diagnóstico es de menos de 10 años, se presentan casos en la segunda década de la vida y más tarde.[4 ]
Aunque no figuran como entidades separadas en la clasificación de tumores del SNC de la OMS de 2021, también se han descrito otros tumores embrionarios distintos del meduloblastoma como entidades separadas, entre ellos los siguientes:
- Tumor de la familia de sarcomas de Ewing del SNC con alteración de CIC (EFT-CIC del SNC). Este subtipo de tumor representa entre el 2 % y el 4 % de los tumores embrionarios distintos del meduloblastoma; se caracteriza por alteraciones genómicas que afectan CIC (localizado en el cromosoma 19q13.2); y se ha identificado una fusión con NUTM1 en varios casos evaluados.[
4 ,5 ] Las fusiones del gen CIC también se identificaron en sarcomas similares al de Ewing fuera del SNC; además, la firma de expresión génica de los tumores EFT-CIC del SNC es similar al de estos sarcomas.[4 ] Los tumores EFT-CIC del SNC por lo general se presentan en niños menores de 10 años y se caracterizan por un fenotipo de células pequeñas, pero con características histológicas variables.[4 ] - Tumor neuroepitelial de grado alto del SNC con alteración en MN1 (HGNET-MN1 del SNC). Este subtipo representa entre el 1 % y el 3 % de los tumores embrionarios distintos del meduloblastoma y se caracteriza por fusiones génicas en las que participa MN1 (localizado en el cromosoma 22q12.3) con genes recíprocos de fusión como BEND2 y CXXC5.[
4 ,5 ] El subtipo HGNET-MN1 del SNC muestra un llamativo predominio en el sexo femenino y tiende a presentarse en la segunda década de vida.[4 ] Este subtipo representaba la mayoría de los casos diagnosticados como astroblastoma según el esquema de clasificación de la OMS de 2007.[4 ] Este subtipo no se ha agregado al vocabulario diagnóstico de la OMS. En otros 2 informes en los que se examinaron 35 casos de astroblastomas definidos mediante análisis histológico se observó que 14 exhibían perfiles de metilación compatibles con HGNET-MN1 del SNC o alteraciones de MN1 identificadas por hibridación fluorescente in situ.[17 ,18 ] - Meduloepitelioma. El meduloepitelioma con la clásica amplificación de C19MC se considera un ETMR con alteración de C19MC (consultar la información anterior sobre ETMR). No obstante, cuando un tumor tiene características histológicas de meduloblastoma, pero carece de la amplificación de C19MC, se identifica como un ETMR.[
19 ,20 ] Los tumores de meduloepiteliomas son poco frecuentes y tienden a presentarse con más frecuencia en lactantes y niños pequeños. Los meduloepiteliomas, que en el análisis histológico se asemejan al tubo neural embrionario, tienden a presentarse a nivel supratentorial, sobre todo dentro de los ventrículos, pero también aparecen a nivel infratentorial, en la cola de caballo e incluso en una ubicación extraneural, junto a las raíces de los nervios.[19 ,20 ] El meduloepitelioma intraocular es biológicamente diferente del meduloepitelioma intraaxial.[21 ,22 ] - Tumor embrionario del SNC con amplificación de PLAGL. En un análisis retrospectivo de más de 90 000 tumores encefálicos en niños y adultos se identificó un pequeño subconjunto de tumores embrionarios (n = 31) con perfiles de metilación característicos, con amplificación de grado alto y sobreexpresión de PLAGL1 o PLAGL2.[
23 ] En estos casos no se observaron las alteraciones genéticas recurrentes adicionales que se advirtieron en otros tipos de tumores pediátricos del SNC. Estos tumores se presentaron en todo el encéfalo y estaban compuestos, en la mayoría de los casos, por células primitivas de tipo embrionario sin marcadores de diferenciación glial o neuronal. En esta pequeña cohorte, se observaron diferencias en la edad en el momento del diagnóstico y en la supervivencia general (SG) a los 10 años entre los pacientes con amplificación de PLAGL1 (mediana de edad, 10,5 años; tasa de SG, 66 %), en comparación con amplificación de PLAGL2 (mediana de edad, 2 años; tasa de SG, 25 %).
Evaluación para la estadificación
Los pacientes con tumores embrionarios distintos del meduloblastoma se estadifican de forma similar a la utilizada para los niños con meduloblastoma; sin embargo, los pacientes no se asignan a subgrupos de riesgo promedio y de riesgo alto para fines de tratamiento porque todos los pacientes se consideran de riesgo alto. Para obtener más información, consultar la sección
Tratamiento de los tumores embrionarios distintos del meduloblastoma infantiles
Para obtener más información sobre el tratamiento de los tumores teratoides rabdoides atípicos del sistema nervioso central, consultar
Para obtener más información sobre el tratamiento del meduloepitelioma, consultar la sección
Tratamiento de los niños de 3 años o menos
El tratamiento óptimo de los tumores embrionarios distintos del meduloblastoma infantil sigue sin estar claro y está en estudio. En estudios retrospectivos de un número bastante grande de pacientes se han indicado abordajes de tratamiento para los subgrupos más comunes, como los TTRA, los ETMR y los tumores con activación de FOXR2. Para obtener más información sobre el tratamiento del TTRA, consultar
Las opciones de tratamiento estándar para los niños de 3 años o menos con tumores embrionarios distintos del meduloblastoma, excepto TTRA, ETMR y tumores con activación de FOXR2 , recién diagnosticados son las siguientes:
- Cirugía.
- Quimioterapia adyuvante.
El tratamiento de los niños de 3 años o menos con tumores embrionarios es similar al indicado para niños de 3 años o menos con meduloblastoma. La resección quirúrgica radical es razonable, dada la mejor tasa de supervivencia de los pacientes con meduloblastomas y otros ETMR tras la resección total o casi total.[
Cuando se usa quimioterapia sola, el desenlace ha resultado variable, con tasas de supervivencia a 5 años que oscilan entre el 0 % y el 50 %.[
Tratamiento de los niños mayores de 3 años
Las opciones de tratamiento estándar para los niños mayores de 3 años con tumores embrionarios distintos del meduloblastoma, excepto TTRA, ETMR y tumores con activación de FOXR2, recién diagnosticados son las siguientes:
-
Cirugía . -
Radioterapia adyuvante. -
Quimioterapia adyuvante .
Cirugía
Evidencia (cirugía):
- A menudo es posible extirpar los tumores embrionarios distintos del meduloblastoma; en series de casos notificadas, del 50 % al 75 % de los pacientes se sometieron a resecciones tumorales totales o casi totales.[
29 ,30 ]; [3 ][Nivel de evidencia A1] - El primer paso del tratamiento de los tumores embrionarios distintos del meduloblastoma recién diagnosticados es intentar una resección quirúrgica radical. Aunque en estudios anteriores no se demostró que el grado de la resección pronostique el desenlace,[
29 ,30 ,31 ] en un estudio se demostró una mejora de la supervivencia cuando se resecó todo el tumor.[32 ][Nivel de evidencia B4] En un estudio publicado (COG-ACNS0332 [NCT00392327]) de los tumores embrionarios distintos del meduloblastoma clasificados por análisis molecular se reveló una mejora de la supervivencia general (SG) para los pacientes con menos de 1,5 cm2 de enfermedad residual, en comparación con los pacientes con más de 1,5 cm2 de enfermedad residual.[3 ][Nivel de evidencia A1]
Radioterapia adyuvante
Después de la cirugía, los niños con tumores embrionarios distintos del meduloblastoma suelen recibir un tratamiento similar al de los niños con meduloblastoma de riesgo alto.
Convencionalmente, los pacientes se tratan con radiación dirigida a todo el eje encefalomedular, con refuerzo de radioterapia local, como se administra para el meduloblastoma.[
Quimioterapia adyuvante
Los abordajes quimioterapéuticos durante la radioterapia y después de esta son similares a los utilizados para los niños con meduloblastoma de riesgo alto. Se han observado tasas de SG a 3 y 5 años del 25 % al 50 %.[
En un estudio publicado de pacientes con tumores no pineales diagnosticados como tumores neuroectodérmicos primitivos del SNC (TNEP) mediante patología tradicional, se descubrió que el 71 % de los casos eran glioblastomas u otro tipo de diagnóstico mediante estudios de metilación del DNA. Los pacientes con tumores embrionarios distintos del meduloblastoma (n = 36) (incluso pineoblastomas, n = 26) tuvieron una SG a 5 años del 78,5 % (intervalo de confianza [IC] 95 %, 62,2–94,8 %). Por el contrario, los pacientes con glioblastoma tuvieron una tasa de SG a 5 años del 12 % (IC 95 %, 0–24,7 %). En el estudio no se observó ningún beneficio para los niños que recibieron carboplatino o isotretinoína.[
Tratamiento de los tumores embrionarios con rosetas de capas múltiples o meduloepitelioma infantiles
En una revisión basada en un registro de 159 pacientes con un diagnóstico molecular confirmado de ETMR se notificó los resultados de supervivencia de los distintos tratamientos.[
- Las tasas de supervivencia sin complicaciones (SSC) y de SG a 2 años fueron del 0 % para los pacientes tratados con quimioterapia convencional sin radioterapia, con independencia del grado de resección quirúrgica.
- La tasa de SSC a 2 años fue del 21 % y la tasa de SG fue del 30 % para los pacientes que se sometieron a una resección macroscópica total y fueron tratados con quimioterapia de dosis alta sin radioterapia.
- La tasa de SSC a 2 años fue del 44 % para los niños tratados con quimioterapia de dosis alta y radioterapia tras una resección subtotal y del 66 % para los pacientes que recibieron tratamiento con quimioterapia de dosis alta y radioterapia tras una resección macroscópica total.
- Las funciones relativas de la radioterapia focal versus la radioterapia craneoespinal no pudieron evaluarse en esta revisión.
En una revisión retrospectiva internacional separada, pero posiblemente solapada, 49 pacientes con ETMR confirmados (por la institución tratante) mediante análisis histológico fueron tratados entre 1988 y 2017 de diversas maneras.[
En una publicación posterior, en la que probablemente se incluyeron algunos de los pacientes del estudio retrospectivo, el tratamiento se limitó solo a los pacientes que recibieron quimioterapia y radioterapia en un estudio prospectivo P-HIT o según el protocolo del estudio. En el estudio P-HIT el tratamiento incluyó quimioterapia postoperatoria, quimioterapia con dosis altas y radioterapia para algunos pacientes. Entre 35 pacientes con ETMR, se identificaron 8 supervivientes a largo plazo, 6 de los cuales habían recibido radioterapia craneoespinal o local, además de quimioterapia de inducción y de dosis altas. Ninguno de los pacientes que presentaron enfermedad del tronco encefálico sobrevivió. La supervivencia a 5 años fue mejor para los pacientes con enfermedad localizada, tal vez para los tratados tanto con quimioterapia de inducción como con quimioterapia con dosis altas. No se pudo determinar la función de la radioterapia ni el volumen óptimo de radioterapia (local versus craneoespinal).[
En estos estudios se indica que el pronóstico de los niños con ETMR tal vez no sea tan grave como mostraron los estudios iniciales, en los que se observó una tasa de supervivencia a 5 años del 25 % o inferior. El desenlace es más favorable en los niños con enfermedad localizada en el momento del diagnóstico y en los que recibieron tratamiento con quimioterapia posquirúrgica intensiva, incluido el tratamiento de inducción y de consolidación con dosis altas. La función de la radioterapia aún no se ha demostrado y no hay evidencia de que la radiación craneoespinal en pacientes con enfermedad localizada sea superior a la radioterapia focal.[
Tratamiento del neuroblastoma del sistema nervioso central con activación deFOXR2
El tratamiento óptimo de los pacientes con neuroblastoma del SNC, tumores con activación de FOXR2, no ha sido confirmado por estudios prospectivos. En una revisión retrospectiva de pacientes diagnosticados entre 1988 y 2007, las tasas más altas de supervivencia se observaron tras resecciones completas o casi completas en pacientes con tumores no metastásicos que también recibieron radioterapia craneoespinal y tal vez quimioterapia. Con este tipo de abordaje, hasta el 75 % de los niños (35 de 42) estaban vivos 5 años después del diagnóstico y el tratamiento. Este tumor suele presentarse en una población algo mayor que la de algunos de los otros tumores embrionarios distintos del meduloblastoma.[
Referencias:
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021.
- WHO Classification of Tumours Editorial Board, ed.: WHO Classification of Tumours: Central Nervous System Tumours. Vol. 6. 5th ed. IARC Press; 2021.
- Hwang EI, Kool M, Burger PC, et al.: Extensive Molecular and Clinical Heterogeneity in Patients With Histologically Diagnosed CNS-PNET Treated as a Single Entity: A Report From the Children's Oncology Group Randomized ACNS0332 Trial. J Clin Oncol : JCO2017764720, 2018.
- Sturm D, Orr BA, Toprak UH, et al.: New Brain Tumor Entities Emerge from Molecular Classification of CNS-PNETs. Cell 164 (5): 1060-72, 2016.
- von Hoff K, Haberler C, Schmitt-Hoffner F, et al.: Therapeutic implications of improved molecular diagnostics for rare CNS embryonal tumor entities: results of an international, retrospective study. Neuro Oncol 23 (9): 1597-1611, 2021.
- Johann PD, Hovestadt V, Thomas C, et al.: Cribriform neuroepithelial tumor: molecular characterization of a SMARCB1-deficient non-rhabdoid tumor with favorable long-term outcome. Brain Pathol 27 (4): 411-418, 2017.
- Korshunov A, Sturm D, Ryzhova M, et al.: Embryonal tumor with abundant neuropil and true rosettes (ETANTR), ependymoblastoma, and medulloepithelioma share molecular similarity and comprise a single clinicopathological entity. Acta Neuropathol 128 (2): 279-89, 2014.
- Picard D, Miller S, Hawkins CE, et al.: Markers of survival and metastatic potential in childhood CNS primitive neuro-ectodermal brain tumours: an integrative genomic analysis. Lancet Oncol 13 (8): 838-48, 2012.
- Spence T, Sin-Chan P, Picard D, et al.: CNS-PNETs with C19MC amplification and/or LIN28 expression comprise a distinct histogenetic diagnostic and therapeutic entity. Acta Neuropathol 128 (2): 291-303, 2014.
- Juhnke BO, Gessi M, Gerber NU, et al.: Treatment of embryonal tumors with multilayered rosettes with carboplatin/etoposide induction and high-dose chemotherapy within the prospective P-HIT trial. Neuro Oncol 24 (1): 127-137, 2022.
- Khan S, Solano-Paez P, Suwal T, et al.: Clinical phenotypes and prognostic features of embryonal tumours with multi-layered rosettes: a Rare Brain Tumor Registry study. Lancet Child Adolesc Health 5 (11): 800-813, 2021.
- Kleinman CL, Gerges N, Papillon-Cavanagh S, et al.: Fusion of TTYH1 with the C19MC microRNA cluster drives expression of a brain-specific DNMT3B isoform in the embryonal brain tumor ETMR. Nat Genet 46 (1): 39-44, 2014.
- Li M, Lee KF, Lu Y, et al.: Frequent amplification of a chr19q13.41 microRNA polycistron in aggressive primitive neuroectodermal brain tumors. Cancer Cell 16 (6): 533-46, 2009.
- Korshunov A, Okonechnikov K, Schmitt-Hoffner F, et al.: Molecular analysis of pediatric CNS-PNET revealed nosologic heterogeneity and potent diagnostic markers for CNS neuroblastoma with FOXR2-activation. Acta Neuropathol Commun 9 (1): 20, 2021.
- Ueno-Yokohata H, Okita H, Nakasato K, et al.: Consistent in-frame internal tandem duplications of BCOR characterize clear cell sarcoma of the kidney. Nat Genet 47 (8): 861-3, 2015.
- Roy A, Kumar V, Zorman B, et al.: Recurrent internal tandem duplications of BCOR in clear cell sarcoma of the kidney. Nat Commun 6: 8891, 2015.
- Wood MD, Tihan T, Perry A, et al.: Multimodal molecular analysis of astroblastoma enables reclassification of most cases into more specific molecular entities. Brain Pathol 28 (2): 192-202, 2018.
- Lehman NL, Usubalieva A, Lin T, et al.: Genomic analysis demonstrates that histologically-defined astroblastomas are molecularly heterogeneous and that tumors with MN1 rearrangement exhibit the most favorable prognosis. Acta Neuropathol Commun 7 (1): 42, 2019.
- Louis DN, Ohgaki H, Wiestler OD, et al.: The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 114 (2): 97-109, 2007.
- Sharma MC, Mahapatra AK, Gaikwad S, et al.: Pigmented medulloepithelioma: report of a case and review of the literature. Childs Nerv Syst 14 (1-2): 74-8, 1998 Jan-Feb.
- Jakobiec FA, Kool M, Stagner AM, et al.: Intraocular Medulloepitheliomas and Embryonal Tumors With Multilayered Rosettes of the Brain: Comparative Roles of LIN28A and C19MC. Am J Ophthalmol 159 (6): 1065-1074.e1, 2015.
- Korshunov A, Jakobiec FA, Eberhart CG, et al.: Comparative integrated molecular analysis of intraocular medulloepitheliomas and central nervous system embryonal tumors with multilayered rosettes confirms that they are distinct nosologic entities. Neuropathology 35 (6): 538-44, 2015.
- Keck MK, Sill M, Wittmann A, et al.: Amplification of the PLAG-family genes-PLAGL1 and PLAGL2-is a key feature of the novel tumor type CNS embryonal tumor with PLAGL amplification. Acta Neuropathol 145 (1): 49-69, 2023.
- Geyer JR, Sposto R, Jennings M, et al.: Multiagent chemotherapy and deferred radiotherapy in infants with malignant brain tumors: a report from the Children's Cancer Group. J Clin Oncol 23 (30): 7621-31, 2005.
- Marec-Berard P, Jouvet A, Thiesse P, et al.: Supratentorial embryonal tumors in children under 5 years of age: an SFOP study of treatment with postoperative chemotherapy alone. Med Pediatr Oncol 38 (2): 83-90, 2002.
- Grill J, Sainte-Rose C, Jouvet A, et al.: Treatment of medulloblastoma with postoperative chemotherapy alone: an SFOP prospective trial in young children. Lancet Oncol 6 (8): 573-80, 2005.
- Fangusaro J, Finlay J, Sposto R, et al.: Intensive chemotherapy followed by consolidative myeloablative chemotherapy with autologous hematopoietic cell rescue (AuHCR) in young children with newly diagnosed supratentorial primitive neuroectodermal tumors (sPNETs): report of the Head Start I and II experience. Pediatr Blood Cancer 50 (2): 312-8, 2008.
- Friedrich C, von Bueren AO, von Hoff K, et al.: Treatment of young children with CNS-primitive neuroectodermal tumors/pineoblastomas in the prospective multicenter trial HIT 2000 using different chemotherapy regimens and radiotherapy. Neuro Oncol 15 (2): 224-34, 2013.
- Cohen BH, Zeltzer PM, Boyett JM, et al.: Prognostic factors and treatment results for supratentorial primitive neuroectodermal tumors in children using radiation and chemotherapy: a Childrens Cancer Group randomized trial. J Clin Oncol 13 (7): 1687-96, 1995.
- Reddy AT, Janss AJ, Phillips PC, et al.: Outcome for children with supratentorial primitive neuroectodermal tumors treated with surgery, radiation, and chemotherapy. Cancer 88 (9): 2189-93, 2000.
- Timmermann B, Kortmann RD, Kühl J, et al.: Role of radiotherapy in the treatment of supratentorial primitive neuroectodermal tumors in childhood: results of the prospective German brain tumor trials HIT 88/89 and 91. J Clin Oncol 20 (3): 842-9, 2002.
- Jakacki RI, Burger PC, Kocak M, et al.: Outcome and prognostic factors for children with supratentorial primitive neuroectodermal tumors treated with carboplatin during radiotherapy: a report from the Children's Oncology Group. Pediatr Blood Cancer 62 (5): 776-83, 2015.
- Chintagumpala M, Hassall T, Palmer S, et al.: A pilot study of risk-adapted radiotherapy and chemotherapy in patients with supratentorial PNET. Neuro Oncol 11 (1): 33-40, 2009.
- Johnston DL, Keene DL, Lafay-Cousin L, et al.: Supratentorial primitive neuroectodermal tumors: a Canadian pediatric brain tumor consortium report. J Neurooncol 86 (1): 101-8, 2008.
- Liu APY, Dhanda SK, Lin T, et al.: Molecular classification and outcome of children with rare CNS embryonal tumors: results from St. Jude Children's Research Hospital including the multi-center SJYC07 and SJMB03 clinical trials. Acta Neuropathol 144 (4): 733-746, 2022.
Pineoblastoma infantil
La Organización Mundial de la Salud clasifica los pineoblastomas dentro del grupo de tumores de la región pineal. Sin embargo, se abordan en este resumen porque comparten características histológicas con otros tumores embrionarios y, de manera convencional, se tratan de la misma forma.[
Cuadro clínico inicial
Los pineoblastomas a menudo producen hidrocefalia debido a la obstrucción de la circulación del líquido cefalorraquídeo a la altura del tercer ventrículo, y también producen otros síntomas relacionados con la presión en la parte posterior del tronco encefálico en la región tectal. Es posible que los síntomas incluyan multitud de anomalías en los movimientos oculares (síndrome de Parinaud) que se manifiestan en pupilas que reaccionan mal a la luz, pero mejor a la acomodación; pérdida de la mirada hacia arriba; nistagmo de retracción o convergencia; y retracción palpebral. A medida que crecen, estos tumores a veces causan hemiparesia y ataxia.[
Clasificación celular y molecular
El pineoblastoma tiene características histológicas similares al meduloblastoma, comparte esas características con los tumores embrionarios y se clasifica como un subgrupo de tumores de parénquima pineal.[
En un estudio de 58 niños con pineoblastoma, se formuló un modelo de subclasificación y se dividió a los pacientes en 4 subgrupos. El subgrupo PB-A incluyó solo a 2 pacientes, ambos menores de 2 años, con tumores que tal vez exhibían una alteración en RB1, y que fallecieron por la enfermedad. El subgrupo PB-B y el subgrupo similar a PB-B, los más numerosos, incluyeron a los pacientes con pérdida de DICER1 o de DROSHA, que tenían más edad, y presentaban el mejor pronóstico después del tratamiento inicial con radioterapia craneoespinal. El 4.° subgrupo, PB-FOXR2, incluyó a 5 pacientes, lactantes o niños pequeños, con tasas de supervivencia muy precarias. De los 58 pacientes evaluados en el estudio, 9 no se asignaron a ninguno de los subgrupos. Los tumores de estos 9 pacientes, en conjunto, se parecían más a otros tipos de tumores embrionarios. Estos resultados demuestran la heterogeneidad de los tumores embrionarios de glándula pineal.[
Características genómicas del pineoblastoma
En la actualidad, la Organización Mundial de la Salud (OMS) clasifica el pineoblastoma como un tumor de parénquima pineal, aunque antes era tradicional agruparlo con los tumores embrionarios. Debido a que el tratamiento del pineoblastoma es muy similar al de los tumores embrionarios, aquí se usa la tradición anterior de incluir el pineoblastoma con los tumores embrionarios del sistema nervioso central (SNC). El pineoblastoma se relaciona con variantes patogénicas germinales del gen RB1 y el gen DICER1, como se describe a continuación:
- El pineoblastoma se vincula con variantes patogénicas germinales de RB1; el término retinoblastoma trilateral se usa para el retinoblastoma ocular que se presenta de manera simultánea con un tumor de encéfalo con características histológicas similares que, por lo general, surge en la glándula pineal o en otras estructuras de la línea media. Tradicionalmente, se han notificado tumores intracraneales a entre el 5 % y el 15 % de los niños con retinoblastoma hereditario.[
8 ] Las tasas de pineoblastoma en los niños con retinoblastoma hereditario que se someten a los programas de tratamiento vigentes quizás sean más bajas que los cálculos históricos.[9 ,10 ,11 ] - También se han notificado variantes patogénicas germinales de DICER1 en pacientes con pineoblastoma.[
12 ] Entre 18 pacientes con pineoblastoma, se identificaron 3 pacientes con variantes patogénicas germinales de DICER1, y otros 3 pacientes de pineoblastoma se sabía que eran portadores de variantes patogénicas germinales de DICER1.[12 ] En pacientes de pineoblastoma, las variantes de DICER1 son variantes de pérdida de función; estas son diferentes a las variantes que se observan en los tumores relacionados con el síndrome de DICER1, como el blastoma pleuropulmonar.[12 ]
Se han aplicado métodos genómicos al estudio del pineoblastoma en un intento por conocer mejor las características biológicas de dicho tumor y orientar la futura clasificación molecular. En un metanálisis internacional retrospectivo se analizaron 221 niños y adultos diagnosticados con pineoblastoma y tumores de parénquima pineal de diferenciación intermedia.[
Evaluación para la estadificación
En el 10 % al 30 % de los pacientes con pineoblastoma hay diseminación en el momento del diagnóstico.[
Aspectos generales de las opciones de tratamiento del pineoblastoma infantil
En el
| Grupo de tratamiento | Opciones de tratamiento estándar | |
|---|---|---|
| Pineoblastoma infantilrecién diagnosticado | Niños de 3 años o menos | |
| |
||
| |
||
| Niños mayores de 3 años | |
|
| |
||
| |
||
| Pineoblastoma infantilrecidivante | No hay opciones de tratamiento estándar. Para obtener más información, consultar la sección |
|
Tratamiento del pineoblastoma infantil
Tratamiento de los niños de 3 años o menos
Las opciones de tratamiento estándar para los niños de 3 años o menos con pineoblastoma son las siguientes:
-
Biopsia (para el diagnóstico) o resección total, si es posible . -
Quimioterapia adyuvante . -
Dosis altas de quimioterapia mielosupresora con rescate autógeno de médula ósea o rescate de células madre periféricas .
Biopsia
Por lo general, se realiza una biopsia y, si es posible, una resección total para diagnosticar el pineoblastoma.
Quimioterapia adyuvante
Los niños de 3 años o menos con pineoblastoma se suelen tratar al inicio con quimioterapia con el objetivo de retrasar, o evitar, la necesidad de radioterapia.[
Dosis altas de quimioterapia mielosupresora con rescate autógeno de médula ósea o rescate de células madre periféricas
En niños pequeños se ha utilizado con cierto éxito dosis altas de quimioterapia mielosupresora con rescate autógeno de médula ósea o rescate de células madre periféricas.[
Tratamiento de los niños mayores de 3 años
Las opciones de tratamiento estándar para los niños mayores de 3 años con pineoblastoma recién diagnosticado son las siguientes:
-
Cirugía . -
Radioterapia adyuvante. -
Quimioterapia adyuvante .
Cirugía
Por lo general, la cirugía es el tratamiento inicial de los pacientes con pineoblastoma y sirve para diagnosticar el tipo de tumor.[
Radioterapia adyuvante
El tratamiento posquirúrgico habitual para los pacientes con pineoblastomas empieza con radioterapia, aunque en algunos ensayos se ha utilizado quimioterapia antes de la radiación. La dosis total de radioterapia dirigida al sitio del tumor es de 54 a 55,8 Gy en fracciones convencionales.[
También se recomienda la irradiación craneoespinal con dosis que oscilan entre 23,4 y 36 Gy debido a la propensión de este tumor a diseminarse por todo el espacio subaracnoideo.[
Quimioterapia adyuvante
Por lo general, la quimioterapia se utiliza de la misma manera que se describió para los meduloblastomas de riesgo alto en niños con enfermedad no diseminada en el momento del diagnóstico. Para obtener más información, consultar la sección
La tasa de supervivencia sin enfermedad a 5 años supera el 50 % en los niños con enfermedad localizada en el momento del diagnóstico que se someten a una resección radical.[
Para los pacientes con enfermedad diseminada en el momento del diagnóstico, la supervivencia es mucho más precaria.[
Opciones de tratamiento en evaluación clínica para el pineoblastoma infantil
Está en evaluación una variedad de métodos de tratamiento para los pacientes de pineoblastoma, como el uso de dosis más altas de quimioterapia después de la radioterapia con apoyo de rescate de células madre periféricas, así como la administración de quimioterapia durante la radioterapia.
Tal vez haya ensayos clínicos terapéuticos de fase inicial para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del
Referencias:
- Louis DN, Perry A, Reifenberger G, et al.: The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 131 (6): 803-20, 2016.
- Louis DN, Perry A, Wesseling P, et al.: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 23 (8): 1231-1251, 2021.
- WHO Classification of Tumours Editorial Board, ed.: WHO Classification of Tumours: Central Nervous System Tumours. Vol. 6. 5th ed. IARC Press; 2021.
- Chintagumpala MM, Paulino A, Panigrahy A, et al.: Embryonal and pineal region tumors. In: Pizzo PA, Poplack DG, eds.: Principles and Practice of Pediatric Oncology. 7th ed. Lippincott Williams and Wilkins, 2015, pp 671-99.
- Li BK, Vasiljevic A, Dufour C, et al.: Pineoblastoma segregates into molecular sub-groups with distinct clinico-pathologic features: a Rare Brain Tumor Consortium registry study. Acta Neuropathol 139 (2): 223-241, 2020.
- Pfaff E, Aichmüller C, Sill M, et al.: Molecular subgrouping of primary pineal parenchymal tumors reveals distinct subtypes correlated with clinical parameters and genetic alterations. Acta Neuropathol 139 (2): 243-257, 2020.
- Liu APY, Gudenas B, Lin T, et al.: Risk-adapted therapy and biological heterogeneity in pineoblastoma: integrated clinico-pathological analysis from the prospective, multi-center SJMB03 and SJYC07 trials. Acta Neuropathol 139 (2): 259-271, 2020.
- de Jong MC, Kors WA, de Graaf P, et al.: Trilateral retinoblastoma: a systematic review and meta-analysis. Lancet Oncol 15 (10): 1157-67, 2014.
- Ramasubramanian A, Kytasty C, Meadows AT, et al.: Incidence of pineal gland cyst and pineoblastoma in children with retinoblastoma during the chemoreduction era. Am J Ophthalmol 156 (4): 825-9, 2013.
- Abramson DH, Dunkel IJ, Marr BP, et al.: Incidence of pineal gland cyst and pineoblastoma in children with retinoblastoma during the chemoreduction era. Am J Ophthalmol 156 (6): 1319-20, 2013.
- Turaka K, Shields CL, Meadows AT, et al.: Second malignant neoplasms following chemoreduction with carboplatin, etoposide, and vincristine in 245 patients with intraocular retinoblastoma. Pediatr Blood Cancer 59 (1): 121-5, 2012.
- de Kock L, Sabbaghian N, Druker H, et al.: Germ-line and somatic DICER1 mutations in pineoblastoma. Acta Neuropathol 128 (4): 583-95, 2014.
- Liu APY, Li BK, Pfaff E, et al.: Clinical and molecular heterogeneity of pineal parenchymal tumors: a consensus study. Acta Neuropathol 141 (5): 771-785, 2021.
- Jakacki RI, Zeltzer PM, Boyett JM, et al.: Survival and prognostic factors following radiation and/or chemotherapy for primitive neuroectodermal tumors of the pineal region in infants and children: a report of the Childrens Cancer Group. J Clin Oncol 13 (6): 1377-83, 1995.
- Timmermann B, Kortmann RD, Kühl J, et al.: Role of radiotherapy in the treatment of supratentorial primitive neuroectodermal tumors in childhood: results of the prospective German brain tumor trials HIT 88/89 and 91. J Clin Oncol 20 (3): 842-9, 2002.
- Mason WP, Grovas A, Halpern S, et al.: Intensive chemotherapy and bone marrow rescue for young children with newly diagnosed malignant brain tumors. J Clin Oncol 16 (1): 210-21, 1998.
- Hinkes BG, von Hoff K, Deinlein F, et al.: Childhood pineoblastoma: experiences from the prospective multicenter trials HIT-SKK87, HIT-SKK92 and HIT91. J Neurooncol 81 (2): 217-23, 2007.
- Friedrich C, von Bueren AO, von Hoff K, et al.: Treatment of young children with CNS-primitive neuroectodermal tumors/pineoblastomas in the prospective multicenter trial HIT 2000 using different chemotherapy regimens and radiotherapy. Neuro Oncol 15 (2): 224-34, 2013.
- Fangusaro J, Finlay J, Sposto R, et al.: Intensive chemotherapy followed by consolidative myeloablative chemotherapy with autologous hematopoietic cell rescue (AuHCR) in young children with newly diagnosed supratentorial primitive neuroectodermal tumors (sPNETs): report of the Head Start I and II experience. Pediatr Blood Cancer 50 (2): 312-8, 2008.
- Jakacki RI, Burger PC, Kocak M, et al.: Outcome and prognostic factors for children with supratentorial primitive neuroectodermal tumors treated with carboplatin during radiotherapy: a report from the Children's Oncology Group. Pediatr Blood Cancer 62 (5): 776-83, 2015.
- Gururangan S, McLaughlin C, Quinn J, et al.: High-dose chemotherapy with autologous stem-cell rescue in children and adults with newly diagnosed pineoblastomas. J Clin Oncol 21 (11): 2187-91, 2003.
- Hwang EI, Kool M, Burger PC, et al.: Extensive Molecular and Clinical Heterogeneity in Patients With Histologically Diagnosed CNS-PNET Treated as a Single Entity: A Report From the Children's Oncology Group Randomized ACNS0332 Trial. J Clin Oncol : JCO2017764720, 2018.
Tratamiento del meduloblastoma y otros tumores embrionarios del sistema nervioso central infantil recidivantes
No es raro observar la recidiva de todas las formas de tumores embrionarios del sistema nervioso central (SNC) que se suele presentar en el transcurso de los primeros 36 meses posteriores al tratamiento. Sin embargo, es posible que se presenten tumores recidivantes muchos años después del tratamiento inicial.[
En algunos estudios se encontró que, incluso en pacientes con enfermedad sin diseminación en el momento del diagnóstico e independientemente de la dosis de radioterapia o el tipo de quimioterapia, cerca de un tercio de los pacientes presentará una recaída solo en el sitio del tumor primario; un tercio, en el sitio del tumor primario y en otros sitios distantes, y un tercio, en sitios distantes sin recaída en el sitio primario.[
Opciones de tratamiento
No hay opciones de tratamiento estándar para los tumores embrionarios del SNC infantil recidivantes. Para obtener más información, consultar la sección
Para la mayoría de los niños, el tratamiento es paliativo y el control de la enfermedad es transitorio en pacientes tratados previamente con radioterapia y quimioterapia: más del 80 % de los casos progresan en el transcurso de 2 años.[
Los abordajes de tratamiento son los siguientes:
-
Cirugía . -
Radioterapia . -
Quimioterapia . -
Dosis altas de quimioterapia con rescate de células madre . -
Terapia molecular dirigida
Cirugía
En el momento de la recaída, se indica una evaluación completa de la extensión de la recidiva para todos los tumores embrionarios. Es posible que sea necesaria una biopsia o una resección quirúrgica para confirmar la recaída porque otras entidades, como los tumores secundarios y la necrosis cerebral causada por el tratamiento, a veces son clínicamente indistinguibles de la recidiva tumoral. La necesidad de intervención quirúrgica se debe individualizar de acuerdo con el tipo de tumor inicial, el tiempo entre el tratamiento inicial y la reaparición de la lesión, y la sintomatología clínica.
Radioterapia
Los pacientes con tumores embrionarios recidivantes que ya recibieron radioterapia y quimioterapia quizás sean aptos para recibir radioterapia adicional, según el sitio y la dosis de la radiación previa, incluso reirradiación al sitio del tumor primario, áreas focales de radioterapia dirigida a sitios de enfermedad diseminada y radiación craneoespinal.[
- En un estudio retrospectivo se notificaron los desenlaces de lactantes y niños pequeños con meduloblastoma en recaída que se habían tratado inicialmente en diferentes ensayos clínicos de quimioterapia sin radiación craneoespinal.[
16 ]- En el momento de la recaída, el 73 % de estos niños se trataron con regímenes a base de radioterapia craneoespinal.
- La tasa de supervivencia a 3 años posrecaída fue del 52,4 % en los pacientes que se trataron con intención curativa.
- Una mayor edad en el momento del diagnóstico, la recaída local y el subtipo SHH infantil se relacionaron con una mejor supervivencia posrecaída.
Quimioterapia
Los tumores embrionarios del SNC recidivantes a veces responden a monoquimioterapia, usada sola o en combinación, incluso ciclofosfamida, cisplatino, carboplatino, lomustina, etopósido, topotecán, temozolomida, la combinación de irinotecán y temozolomida (con o sin bevacizumab) y terapia metronómica antiangiogénica.[
En ciertos pacientes con meduloblastoma recidivante, sobre todo lactantes y niños pequeños tratados con quimioterapia sola en el momento del diagnóstico y que presentan recidiva local, es posible lograr el control de la enfermedad a largo plazo luego de someterlos a más tratamiento con quimioterapia y radioterapia local; la posibilidad de control es más alta en los pacientes aptos para una resección completa de la enfermedad recidivante.[
En un estudio del St. Jude Children's Research Hospital (SJYC07 [NCT00602667]), 29 pacientes con enfermedad progresiva recibieron irradiación craneoespinal (mediana de dosis, 36 Gy; intervalo intercuartílico, 36–36). De esos 29 pacientes, 18 (62 %) estaban vivos en el momento de la publicación, en comparación con 6 de 25 pacientes (24 %) que no recibieron irradiación craneoespinal.[
Dosis altas de quimioterapia con rescate de células madre
En los pacientes que recibieron radioterapia, se han obtenido resultados dispares con regímenes quimioterapéuticos de dosis más altas con apoyo de rescate autógeno de médula ósea o de células madre periféricas.[
- El uso de estos regímenes se traduce en respuestas objetivas frecuentes en el 50 % al 75 % de los pacientes; sin embargo, el control de la enfermedad a largo plazo se obtiene en menos del 30 % de los pacientes y se observa, sobre todo, en pacientes en su primera recaída y en quienes solo tienen enfermedad localizada en el momento de la recaída.[
10 ]; [36 ][Nivel de evidencia B4]; [37 ][Nivel de evidencia C1] - Asimismo, los resultados de ensayos nacionales de meduloblastoma recidivante, que especificaron la intención de trasplante como parte de su plan de tratamiento, mostraron que solo alrededor del 5 % de los pacientes que iniciaron un tratamiento de recuperación lograron una supervivencia sin enfermedad a largo plazo con esta estrategia.[
36 ,40 ] Por lo tanto, los estudios que notifican desde el momento del trasplante sobrestiman el beneficio de abordajes basados en trasplante para toda la población de pacientes que recaen. - El control de la enfermedad diseminada a largo plazo es poco frecuente.[
41 ][Nivel de evidencia C1]
Terapia molecular dirigida
Con el aumento del conocimiento de los cambios moleculares y genéticos relacionados con diferentes subtipos de meduloblastoma, la terapia molecular dirigida, también llamada terapia de precisión, se está explorando de manera activa para usarla en los niños con enfermedad recidivante.
En los pacientes con meduloblastomas recidivantes con activación de SHH, el vismodegib (un inhibidor de SHH PTCH1) demostró respuestas radiográficas en 3 de 12 pacientes pediátricos; 2 respuestas se mantuvieron durante menos de 2 meses y 1 respuesta durante más de 6 meses. Solo se observó una respuesta en los pacientes con variantes ubicadas secuencia arriba de la vía de SHH, a nivel de PTCH1 o SMO.[
Opciones de tratamiento en evaluación clínica del meduloblastoma y otros tumores del sistema nervioso central infantil recidivantes
Tal vez haya ensayos clínicos terapéuticos de fase inicial para pacientes seleccionados. Es posible que estos ensayos estén disponibles a través del
Ensayos clínicos en curso
Realizar una
Referencias:
- Taylor RE, Bailey CC, Robinson K, et al.: Results of a randomized study of preradiation chemotherapy versus radiotherapy alone for nonmetastatic medulloblastoma: The International Society of Paediatric Oncology/United Kingdom Children's Cancer Study Group PNET-3 Study. J Clin Oncol 21 (8): 1581-91, 2003.
- Packer RJ, Goldwein J, Nicholson HS, et al.: Treatment of children with medulloblastomas with reduced-dose craniospinal radiation therapy and adjuvant chemotherapy: A Children's Cancer Group Study. J Clin Oncol 17 (7): 2127-36, 1999.
- Sabel M, Fleischhack G, Tippelt S, et al.: Relapse patterns and outcome after relapse in standard risk medulloblastoma: a report from the HIT-SIOP-PNET4 study. J Neurooncol 129 (3): 515-524, 2016.
- Kumar R, Smith KS, Deng M, et al.: Clinical Outcomes and Patient-Matched Molecular Composition of Relapsed Medulloblastoma. J Clin Oncol 39 (7): 807-821, 2021.
- Oyharcabal-Bourden V, Kalifa C, Gentet JC, et al.: Standard-risk medulloblastoma treated by adjuvant chemotherapy followed by reduced-dose craniospinal radiation therapy: a French Society of Pediatric Oncology Study. J Clin Oncol 23 (21): 4726-34, 2005.
- Mazloom A, Zangeneh AH, Paulino AC: Prognostic factors after extraneural metastasis of medulloblastoma. Int J Radiat Oncol Biol Phys 78 (1): 72-8, 2010.
- Johnston DL, Keene D, Strother D, et al.: Survival Following Tumor Recurrence in Children With Medulloblastoma. J Pediatr Hematol Oncol 40 (3): e159-e163, 2018.
- Gentet JC, Doz F, Bouffet E, et al.: Carboplatin and VP 16 in medulloblastoma: a phase II Study of the French Society of Pediatric Oncology (SFOP). Med Pediatr Oncol 23 (5): 422-7, 1994.
- Kadota RP, Mahoney DH, Doyle J, et al.: Dose intensive melphalan and cyclophosphamide with autologous hematopoietic stem cells for recurrent medulloblastoma or germinoma. Pediatr Blood Cancer 51 (5): 675-8, 2008.
- Butturini AM, Jacob M, Aguajo J, et al.: High-dose chemotherapy and autologous hematopoietic progenitor cell rescue in children with recurrent medulloblastoma and supratentorial primitive neuroectodermal tumors: the impact of prior radiotherapy on outcome. Cancer 115 (13): 2956-63, 2009.
- Robinson GW, Rudneva VA, Buchhalter I, et al.: Risk-adapted therapy for young children with medulloblastoma (SJYC07): therapeutic and molecular outcomes from a multicentre, phase 2 trial. Lancet Oncol 19 (6): 768-784, 2018.
- Wetmore C, Herington D, Lin T, et al.: Reirradiation of recurrent medulloblastoma: does clinical benefit outweigh risk for toxicity? Cancer 120 (23): 3731-7, 2014.
- Baroni LV, Freytes C, Fernández Ponce N, et al.: Craniospinal irradiation as part of re-irradiation for children with recurrent medulloblastoma. J Neurooncol 155 (1): 53-61, 2021.
- Hill RM, Richardson S, Schwalbe EC, et al.: Time, pattern, and outcome of medulloblastoma relapse and their association with tumour biology at diagnosis and therapy: a multicentre cohort study. Lancet Child Adolesc Health 4 (12): 865-874, 2020.
- Abe M, Tokumaru S, Tabuchi K, et al.: Stereotactic radiation therapy with chemotherapy in the management of recurrent medulloblastomas. Pediatr Neurosurg 42 (2): 81-8, 2006.
- Erker C, Mynarek M, Bailey S, et al.: Outcomes of Infants and Young Children With Relapsed Medulloblastoma After Initial Craniospinal Irradiation-Sparing Approaches: An International Cohort Study. J Clin Oncol 41 (10): 1921-1932, 2023.
- Friedman HS, Oakes WJ: The chemotherapy of posterior fossa tumors in childhood. J Neurooncol 5 (3): 217-29, 1987.
- Needle MN, Molloy PT, Geyer JR, et al.: Phase II study of daily oral etoposide in children with recurrent brain tumors and other solid tumors. Med Pediatr Oncol 29 (1): 28-32, 1997.
- Gaynon PS, Ettinger LJ, Baum ES, et al.: Carboplatin in childhood brain tumors. A Children's Cancer Study Group Phase II trial. Cancer 66 (12): 2465-9, 1990.
- Allen JC, Walker R, Luks E, et al.: Carboplatin and recurrent childhood brain tumors. J Clin Oncol 5 (3): 459-63, 1987.
- Ashley DM, Longee D, Tien R, et al.: Treatment of patients with pineoblastoma with high dose cyclophosphamide. Med Pediatr Oncol 26 (6): 387-92, 1996.
- Lefkowitz IB, Packer RJ, Siegel KR, et al.: Results of treatment of children with recurrent medulloblastoma/primitive neuroectodermal tumors with lomustine, cisplatin, and vincristine. Cancer 65 (3): 412-7, 1990.
- Friedman HS, Mahaley MS, Schold SC, et al.: Efficacy of vincristine and cyclophosphamide in the therapy of recurrent medulloblastoma. Neurosurgery 18 (3): 335-40, 1986.
- Castello MA, Clerico A, Deb G, et al.: High-dose carboplatin in combination with etoposide (JET regimen) for childhood brain tumors. Am J Pediatr Hematol Oncol 12 (3): 297-300, 1990.
- Cefalo G, Massimino M, Ruggiero A, et al.: Temozolomide is an active agent in children with recurrent medulloblastoma/primitive neuroectodermal tumor: an Italian multi-institutional phase II trial. Neuro Oncol 16 (5): 748-53, 2014.
- Le Teuff G, Castaneda-Heredia A, Dufour C, et al.: Phase II study of temozolomide and topotecan (TOTEM) in children with relapsed or refractory extracranial and central nervous system tumors including medulloblastoma with post hoc Bayesian analysis: A European ITCC study. Pediatr Blood Cancer 67 (1): e28032, 2020.
- Levy AS, Krailo M, Chi S, et al.: Temozolomide with irinotecan versus temozolomide, irinotecan plus bevacizumab for recurrent medulloblastoma of childhood: Report of a COG randomized Phase II screening trial. Pediatr Blood Cancer 68 (8): e29031, 2021.
- Minturn JE, Janss AJ, Fisher PG, et al.: A phase II study of metronomic oral topotecan for recurrent childhood brain tumors. Pediatr Blood Cancer 56 (1): 39-44, 2011.
- Peyrl A, Chocholous M, Kieran MW, et al.: Antiangiogenic metronomic therapy for children with recurrent embryonal brain tumors. Pediatr Blood Cancer 59 (3): 511-7, 2012.
- Peyrl A, Chocholous M, Sabel M, et al.: Sustained Survival Benefit in Recurrent Medulloblastoma by a Metronomic Antiangiogenic Regimen: A Nonrandomized Controlled Trial. JAMA Oncol 9 (12): 1688-1695, 2023.
- Ridola V, Grill J, Doz F, et al.: High-dose chemotherapy with autologous stem cell rescue followed by posterior fossa irradiation for local medulloblastoma recurrence or progression after conventional chemotherapy. Cancer 110 (1): 156-63, 2007.
- Bakst RL, Dunkel IJ, Gilheeney S, et al.: Reirradiation for recurrent medulloblastoma. Cancer 117 (21): 4977-82, 2011.
- Dunkel IJ, Boyett JM, Yates A, et al.: High-dose carboplatin, thiotepa, and etoposide with autologous stem-cell rescue for patients with recurrent medulloblastoma. Children's Cancer Group. J Clin Oncol 16 (1): 222-8, 1998.
- Park JE, Kang J, Yoo KH, et al.: Efficacy of high-dose chemotherapy and autologous stem cell transplantation in patients with relapsed medulloblastoma: a report on the Korean Society for Pediatric Neuro-Oncology (KSPNO)-S-053 study. J Korean Med Sci 25 (8): 1160-6, 2010.
- Gilman AL, Jacobsen C, Bunin N, et al.: Phase I study of tandem high-dose chemotherapy with autologous peripheral blood stem cell rescue for children with recurrent brain tumors: a Pediatric Blood and MarrowTransplant Consortium study. Pediatr Blood Cancer 57 (3): 506-13, 2011.
- Pizer B, Donachie PH, Robinson K, et al.: Treatment of recurrent central nervous system primitive neuroectodermal tumours in children and adolescents: results of a Children's Cancer and Leukaemia Group study. Eur J Cancer 47 (9): 1389-97, 2011.
- Massimino M, Gandola L, Spreafico F, et al.: No salvage using high-dose chemotherapy plus/minus reirradiation for relapsing previously irradiated medulloblastoma. Int J Radiat Oncol Biol Phys 73 (5): 1358-63, 2009.
- Gururangan S, Krauser J, Watral MA, et al.: Efficacy of high-dose chemotherapy or standard salvage therapy in patients with recurrent medulloblastoma. Neuro Oncol 10 (5): 745-51, 2008.
- Dunkel IJ, Gardner SL, Garvin JH, et al.: High-dose carboplatin, thiotepa, and etoposide with autologous stem cell rescue for patients with previously irradiated recurrent medulloblastoma. Neuro Oncol 12 (3): 297-303, 2010.
- Gajjar A, Pizer B: Role of high-dose chemotherapy for recurrent medulloblastoma and other CNS primitive neuroectodermal tumors. Pediatr Blood Cancer 54 (4): 649-51, 2010.
- Bowers DC, Gargan L, Weprin BE, et al.: Impact of site of tumor recurrence upon survival for children with recurrent or progressive medulloblastoma. J Neurosurg 107 (1 Suppl): 5-10, 2007.
- Robinson GW, Orr BA, Wu G, et al.: Vismodegib Exerts Targeted Efficacy Against Recurrent Sonic Hedgehog-Subgroup Medulloblastoma: Results From Phase II Pediatric Brain Tumor Consortium Studies PBTC-025B and PBTC-032. J Clin Oncol 33 (24): 2646-54, 2015.
- Robinson GW, Kaste SC, Chemaitilly W, et al.: Irreversible growth plate fusions in children with medulloblastoma treated with a targeted hedgehog pathway inhibitor. Oncotarget 8 (41): 69295-69302, 2017.
Actualizaciones más recientes a este resumen (02 / 27 / 2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se añadió
Se añadió
El
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del meduloblastoma y otros tumores embrionarios del sistema nervioso central infantil. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del meduloblastoma y otros tumores embrionarios del sistema nervioso central infantil son:
- Kenneth J. Cohen, MD, MBA (Sidney Kimmel Comprehensive Cancer Center at Johns Hopkins Hospital)
- Louis S. Constine, MD (James P. Wilmot Cancer Center at University of Rochester Medical Center)
- Roger J. Packer, MD (Children's National Hospital)
- D. Williams Parsons, MD, PhD (Texas Children's Hospital)
- Malcolm A. Smith, MD, PhD (National Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como "En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]".
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Tratamiento del meduloblastoma y otros tumores embrionarios del sistema nervioso central infantil. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como "estándar" o "en evaluación clínica". Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del
Última revisión: 2025-02-27
Esta información no reemplaza el consejo de un médico. Ignite Healthwise, LLC, niega toda garantía y responsabilidad por el uso de esta información. El uso que usted haga de esta información implica que usted acepta los
Healthwise, Healthwise para cada decisión de la salud, y el logo de Healthwise son marcas de fábrica de Ignite Healthwise, LLC.
Page Footer
Quiero...
Audiencia
Sitios seguros para miembros
Información sobre The Cigna Group
Aviso legal
Los planes individuales y familiares de seguro médico y dental están asegurados por Cigna Health and Life Insurance Company (CHLIC), Cigna HealthCare of Arizona, Inc., Cigna HealthCare of Illinois, Inc., Cigna HealthCare of Georgia, Inc., Cigna HealthCare of North Carolina, Inc., Cigna HealthCare of South Carolina, Inc. y Cigna HealthCare of Texas, Inc. Los planes de beneficios de salud y de seguro de salud de grupo están asegurados o administrados por CHLIC, Connecticut General Life Insurance Company (CGLIC) o sus afiliadas (puedes ver
Todas las pólizas de seguros y los planes de beneficios de grupo contienen exclusiones y limitaciones. Para conocer la disponibilidad, los costos y detalles completos de la cobertura, comunícate con un agente autorizado o con un representante de ventas de Cigna. Este sitio web no está dirigido a los residentes de New Mexico.